Введение. В настоящее время для лечения ряда заболеваний достаточно широко используются лекарственные средства на основе природных биологически активных веществ (БАВ). Как правило, они менее токсичны и обладают ограниченным спектром побочных эффектов. Одним из источников БАВ является сапропель, содержащий комплекс биологически активных соединений (гуминовые кислоты (ГК), углеводы, витамины, полифенолы и др.). Омское Прииртышье является одним из крупных сапропелевых регионов России, поскольку в нём сосредоточено около 1500 млн т возобновляемого сырья-сапропеля. Основными носителями биологической активности в сапропеле являются ГК.
Разработка лекарственных препаратов на основе гуминовых веществ на доклиническом этапе предполагает установление структуры действующего соединения и определение оптимальных методов и методик его стандартизации для контроля качества. При разработке методов стандартизации лекарственных препаратов природного происхождения следует соблюдать принцип унификации методик качественного обнаружения и количественного определения действующих компонентов в ряду: «сырье – субстанция – лекарственный препарат».
Стандартизация гуминовых кислот сопряжена с рядом проблем, из которых наиболее важной является отсутствие научно доказанных данных о молекулярной структуре рассматриваемых соединений. Гуминовые кислоты исследователи изучают, опираясь на «гипотетические структурные молекулы», предложенные разными авторами.
Ряд исследователей при решении вопроса о стандартизации гуминовых кислот предлагают ориентироваться на молекулярные массы их фракций или определять процентное содержание в исходном сырье, применять ИК-спектроскопию для идентификации функциональных групп [7,10], но до сих пор не разработано способов количественной оценки гуминовых кислот с учетом их химической структуры. Следовательно, разработка метода количественного определения функциональных групп гуминовых кислот является актуальной задачей.
В настоящее время набольшее распространение получили титриметрические методы исследования ГК для определения функциональных групп кислотного характера, а именно: баритовый, кальций-ацетатный, алкалиметрический и ацидиметрический.
Баритовый метод определения общей кислотности, основанный на добавлении избытка бария гидроксида и титровании его остатка раствором соляной кислоты, требует больших затрат времени, приводит к сдвигу равновесия и неполному количественному протеканию реакции, поэтому дает заниженные результаты [4].
Кальций-ацетатным методом, основанном на добавлении избытка кальция ацетата и последующем алкалиметрическом титровании выделившейся уксусной кислоты, определяют не только карбоксильные и фенольные группы, но и замещенные фенолы, что приводит к невоспроизводимости результатов. Кроме того, кислотные группы, прочно связанные внутримолекулярными водородными связями, в нейтральной среде не вступают в реакции осаждения [9], в результате чего получаются заниженные результаты.
Алкалиметрический и ацидиметрический методы в водных и неводных (пиридин, этилендиамин, ДМФА, ДМСО и др.) средах [2] с применением индикаторов приводит к уменьшению точности результатов, связанной с маскированием окраски индикатора собственной темно-коричневой окраской растворов ГК.
При использовании потенциометрической индикации конечной точки титрования возникают трудности, связанные с отсутствием четко выраженных перегибов на кривых титрования функциональных групп кислотного характера, что требует последующей математической обработки результатов (расчет дифференциальных кривых, рК функциональных групп и построение кривых Грана). Кроме того, ГК являются полиэлектролитами [5], несут большой рН-зависимый отрицательный заряд, что приводит к внутри- и межмолекулярным электростатическим взаимодействиям между функциональными группами ГК [3], и, как правило, влияют на интерпретацию результатов.
Прямое и обратное потенциометрическое титрование также дают разные результаты [3]: при прямом титровании они ниже, чем в обратном, а причинами могут явиться как неполное взаимодействие фенольных групп (титруются при рН более 10,5), так и медленное взаимодействие определяемых групп с раствором титранта из-за сложной структуры молекул ГК.
Для определения фенольных, карбоксильных, а также гидроксильных групп, образующихся при гидролизе лактонных и ангидридных циклов в образцах углеродсодержащих материалов (активных углях, графитах, углеродных нанотрубках), часто применяется метод Боэма [8], который основан на различной кислотности функциональных групп и расширяет возможности количественного определения титриметрическим методом. При обработке раствором щелочи раскрываются лактонные и ангидридные циклы с образованием -ОН и -СООН групп, которые нейтрализуются вместе со свободными реакционноспособными карбоксильными и гидроксильными группами. При обработке раствором натрия карбоната определяются суммарно карбоксильные и гидролизуемые лактонные группы, а при взаимодействии с натрия гидрокарбонатом исследуют количество только карбоксильных групп. Применение кондуктометрической фиксации конечной точки титрования [5] в методе Боэма позволяет увеличить точность получаемых результатов и избежать трудностей, характерных для потенциометрии.
Целью данной работы явилась оценка возможности применения метода Боэма для количественного определения функциональных групп кислотного характера для включения данного метода в нормативную документацию, характеризующую качество исходного сырья и его производных.
Материалы и методы исследования. Объектами исследования явились высушенные до воздушно-сухого состояния образцы сапропеля оз. Горчаково Тюкалинского района Омской области, а также гуминовые кислоты, выделенные из данных образцов сапропеля по стандартной методике Н.Н. Бамбалова [1].
Исследование количества функциональных групп проводилось по методу Боэма [8] с кондуктометрической фиксацией конечной точки титрования на лабораторном анализаторе «Мультитест КСЛ» при температуре 20±20С.
Определение количества функциональных групп (общая методика). Во взвешенные с точностью до 0,0002 г три конические колбы емкостью 50 мл помещали навеску 0,0025 – 0,25 г с точностью до 0,0002 г испытуемого материала. К навеске приливали 25 мл 0,01 М соответствующего раствора: раствор гидрокарбоната натрия – карбоксильные группы; раствор карбоната натрия – сумма карбоксильных и лактонных групп; раствор гидроксида натрия – сумма гидроксильных, карбоксильных и лактонных групп. Смесь энергично встряхивали на продольном встряхивателе в течение 30 мин и фильтровали через плотный бумажный фильтр для тонких осадков. Из фильтрата отбирали три пробы по 5 мл, переносили в коническую колбу емкостью 50 мл и титровали 0,01 М раствором HCl. Определяли количество (b) HCl, пошедшей на титрование, как среднее из трех испытаний.
Выполняли контрольное титрование трех проб по 5 мл 0,01 М соответствующего раствора 0,01 М раствором HCI и определяли количество (а) HCl, пошедшей на титрование контрольной пробы.
Содержание Ni (i = 1-3) групп рассчитывали по формуле:
![]()
где а – количество 0,01 М раствора HCl, пошедшей на титрование контрольной пробы, мл
b – количество 0,01 М раствора HCl, пошедшей на титрование анализируемой пробы (фильтрата), мл
25 – объем 0,01 М раствора, взятого для обработки, мл
5 – объем фильтрата, взятый для титрования, мл
К – поправочный коэффициент для соляной кислоты
С – навеска образца, г
Содержание лактонных групп рассчитывали по разности N2 – N1, а содержание гидроксильных групп рассчитывали по разности N3 – N2.
Статистическую обработку полученных результатов проводили с помощью компьютерной программы Statistica 6.0 for Windows для доверительной вероятности 0,95.
Результаты и их обсуждение. На рисунке 1 представлены зависимости удельной электропроводности растворов (æ) от объема титранта (Vт) при титровании функциональных групп 0,02 % растворов гуминовых кислот методом Боэма при кондуктометрической фиксации конечной точки титрования.
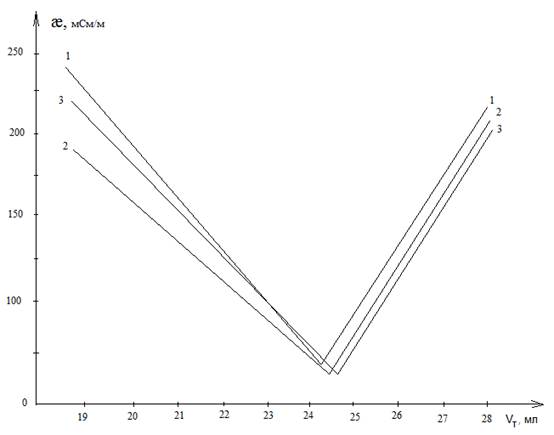
Рисунок 1. Кривые кондуктометрического титрования функциональных групп по методу Боэма:
1 – титрование суммы всех групп кислого характера (в растворе NaOH); 2 – титрование суммы карбоксильных и лактонных групп (в растворе Na2CO3); 3 – титрование карбоксильных групп (в растворе NaHCO3).
Из представленных графиков видно, что кривые титрования имеют изломы, соответствующие конечным точкам титрования карбоксильных групп (кривая 3), суммы карбоксильных и лактонных групп (кривая 2) и суммы всех функциональных групп кислого характера (кривая 1).
Результаты кондуктометрического титрования функциональных групп в сапропеле по методу Боэма представлены в таблице 1.
Таблица 1. Зависимость содержания функциональных групп от концентрации сапропеля (N=30, M±m)
|
Концен-трация сапропе-ля, % |
Карбоксиль-ные группы, мг-экв/г |
Сумма карбоксиль-ных и лактонных групп, мг-экв/г |
Лактонные группы, мг-экв/г |
Сумма карбоксиль-ных, лактонных и гидроксиль-ных групп, мг-экв/г |
Гидроксиль-ные группы, мг-экв/г |
|
0,01 |
0,03 ±0,0007 |
0,055 ± 0,0012 |
0,025 ± 0,0005 |
0,075 ± 0,0017 |
0,02 ± 0,0004 |
|
0,02 |
0,08 ± 0,0018 |
0,125 ± 0,003 |
0,045 ± 0,0018 |
0,163 ± 0,0038 |
0,038 ± 0,0009 |
|
0,05 |
0,17 ± 0,004 |
0,297 ± 0,007 |
0,127 ± 0,0029 |
0,407 ± 0,009 |
0,11 ± 0,0250 |
|
0,10 |
0,30 ± 0,006 |
0,58 ± 0,013 |
0,28 ± 0,0062 |
0,801 ± 0,018 |
0,22 ± 0,0049 |
|
0,25 |
0,73 ± 0,016 |
1,37 ± 0,031 |
0,64 ± 0,0145 |
1,89 ± 0,042 |
0,52 ± 0,0118 |
|
0,50 |
1,48 ± 0,032 |
2,72 ± 0,060 |
1,24 ± 0,027 |
3,70 ± 0,081 |
0,98 ± 0,0216 |
|
1,00 |
2,94 ± 0,065 |
5,37 ± 0,121 |
2,43 ± 0,055 |
7,34 ± 0,162 |
1,97 ± 0,044 |
Анализ таблицы 1 показал, что увеличение концентрации сапропеля от 0,01 до 1,0 % приводит к увеличению количества всех функциональных групп, при этом зависимость их содержания от концентрации сапропеля можно считать прямопропорциональной.
Действительно, авторами работы [6] в сапропеле оз. Горчаково были обнаружены полисахариды, аминокислоты, флавоноиды, дубильные вещества, белки, гуминовые вещества и другие биологически активные вещества, имеющие в своем составе карбоксильные, лактонные и гидроксильные группы, которые определяются методом Боэма.
Исследование содержания функциональных групп кислого характера в зависимости от концентрации ГК (таблица 2) показало, что при изменении концентрации раствора гуминовых кислот от 0,01 до 0,1 % количество карбоксильных и гидроксильных групп снизилось почти в 2 раза, а лактонных – в 1,2 раза. При дальнейшем увеличении концентрации растворов гуминовых кислот от 0,1 до 0,5 % активность карбоксильных групп снижается в 3 раза, лактонных и гидроксильных в 1,3 – 1,4 раза. Увеличение концентрации ГК до 1,0 % приводит к тому, что количество кислых функциональных групп практически не изменяется. Из приведенных данных видно, что зависимость активности функциональных групп от концентрации растворов гуминовых кислот носит нелинейный характер.
Таблица 2. Зависимость содержания функциональных групп от концентрации ГК (N=30, M±m)
|
Концент-рация ГК, % |
Карбоксиль-ные группы, мг-экв/г |
Сумма карбоксиль-ных и лактонных групп, мг-экв/г |
Лактонные группы, мг-экв/г |
Сумма карбоксиль-ных, лактонных и гидроксиль-ных групп, мг-экв/г |
Гидроксиль-ные группы, мг-экв/г |
|
0,01 |
2,90 ± 0,064 |
4,26 ± 0,094 |
1,36 ± 0,030 |
7,94 ± 0,176 |
3,68 ± 0,081 |
|
0,02 |
2,69 ± 0,060 |
4,02 ± 0,089 |
1,33 ± 0,030 |
7,44 ± 0,0165 |
3,42 ± 0,076 |
|
0,05 |
2,14 ± 0,048 |
3,36 ± 0,075 |
1,22 ± 0,027 |
5,75 ± 0,128 |
2,39 ± 0,053 |
|
0,10 |
1,50 ± 0,033 |
2,63 ± 0,060 |
1,13 ± 0,026 |
4,53 ± 0,099 |
1,90 ± 0,043 |
|
0,25 |
0,56 ± 0,012 |
1,47 ± 0,033 |
0,91 ± 0,020 |
3,15 ± 0,070 |
1,68 ± 0,037 |
|
0,50 |
0,50 ± 0,012 |
1,34 ± 0,031 |
0,84 ± 0,019 |
2,91 ± 0,064 |
1,57 ± 0,035 |
|
1,00 |
0,49 ± 0,012 |
1,31 ± 0,031 |
0,82 ± 0,018 |
2,87 ± 0,064 |
1,56 ± 0,035 |
Полученные результаты согласуются с результатами, приведенными в работах [4], и показывают, что при больших концентрациях гуминовых кислот в растворе происходит изменение пространственного расположения атомов и группировок, т.е. изменяется конформация молекул, происходит их укрупнение и деформация структуры, в результате часть активных групп будет заключена внутри "клубка", экранирована фрагментами других молекул и практически недоступна для химического взаимодействия. Кроме того, при увеличении концентрации ГК сокращается расстояние между молекулами, и функциональные группы могут вступать в межмолекулярные взаимодействия, образовывать внутримолекулярные и межмолекулярные водородные связи. А при низких концентрациях гуминовых кислот количество свободных и доступных функциональных групп возрастает.
Заключение. Проведенные исследования показали возможность применения метода Боэма для количественного определения содержания (в мг-экв/г) карбоксильных, лактонных и гидроксильных групп в сапропеле и выделенных из него гуминовых кислотах. Кондуктометрическая фиксация конечной точки титрования позволяет устранить недостатки потенциометрии, при этом относительная ошибка составляет 2,0–2,4 %.
Для включения предложенного метода в нормативную документацию, характеризующую качество исходного сырья и его производных, оптимальная концентрация растворов ГК, необходимая для проведения испытаний, рекомендуется в интервале от 0,01 до 0,05 %.
Рецензенты:
Гришин А. В., д-р фарм. наук, профессор, зав. кафедрой фармации ГБОУ ВПО ОмГМА Минздрава России, г. Омск.
Индутный А. В., д-р мед. наук, доцент, зав. кафедрой Клинической лабораторной диагностики ГБОУ ВПО ОмГМА Минздрава России, г. Омск.
Библиографическая ссылка
Савченко И.А., Корнеева И.Н., Плаксин Г.В., Лукша Е.А., Гончаров Д.С. НОВЫЙ ПОДХОД К РЕШЕНИЮ ПРОБЛЕМЫ СТАНДАРТИЗАЦИИ ГУМИНОВЫХ КИСЛОТ // Современные проблемы науки и образования. – 2013. – № 3. ;URL: https://science-education.ru/ru/article/view?id=9305 (дата обращения: 23.04.2024).



