Рак мочевого пузыря - актуальная проблема современной онкоурологии. По данным общемировой статистики, злокачественные новообразования (ЗНО) мочевого пузыря занимают 9-е место в структуре онкологической заболеваемости и обладают тенденцией к постоянному росту. Рак мочевого пузыря (РМП) составляет 2-5% всех ЗНО и 30-40% опухолей мочеполовой системы [1; 2]. В 80% случаев злокачественные опухоли мочевого пузыря диагностируются на ранней стадии, к которым относят неинвазивные формы РМП: Ta, Tis, T1. Запущенность РМП достигает 40%, что ведет к высокому уровню летальности, составляющему около 6-7% [3].
К факторам риска развития РМП относят:
1. Пол: опухоли мочевого пузыря встречаются до 10 раз чаще у мужчин по сравнению с женщинами той же возрастной группы.
2. Возраст. Установлено, что риск развития ЗНО мочевого пузыря резко повышается после 65 лет.
3. Паразитарные инвазии, такие как шистосамоз, распространенные в странах Африки, резко увеличивают число пациентов с РМП.
4. Риск развития РМП повышен у людей, профессиональная деятельность которых связана с длительным контактом с ароматическими аминами.
5. Курение является значимым фактором развития как РМП, так и ЗНО других локализаций.
6. Носительство вируса папилломы человека, особенно высокоонкогенных серотипов (16 и 18) [1; 4-8].
Наибольшую распространенность среди РМП по классификации ВОЗ составляют переходно-клеточные формы рака, составляющие до 90% всех опухолей. Клинико-анатомически переходно-клеточный рак делится на две большие группы – без инвазии в мышечный слой (Тis, Та и Т1) и инвазивные формы (Т2, Т3,T4). Уровень инвазии определяет прогноз в отношении рецидива заболевания, качества жизни, а также летальности [1; 3; 8; 9].
Несмотря на широкий спектр различных диагностических методов РМП на сегодняшний день основными являются: цитологическое исследование мочи, УЗИ мочевого пузыря, а также цистоскопия с биопсией [2; 4; 6-8].
Рост заболеваемости РМП и высокая частота рецидивов заболевания после комбинированного лечения обуславливают актуальность оптимизации диагностических подходов в условиях современной онкологической практики. Особый интерес представляют новые неинвазивные методы, основанные на исследованиях осадка мочи, которые можно использовать как для раннего выявления РМП, так и диагностики рецидива заболевания [2; 4-9].
Цель работы: разработать алгоритм оптимизации ранней диагностики рака мочевого пузыря на основании результатов анализа осадка мочи, методом проточной цитометрии.
Материалы и методы
В исследование включено 162 пациента с неинвазивным РМП (Tа, Tis, T1), получавших лечение на базе КГБУЗ «Красноярский краевой клинический онкологический диспансер им. А.И. Крыжановского».
Порцию мочи пациентов забирали до проведения им трансуретральной резекции (ТУР). Полученные образцы мочи центрифугировали при 2 000 об/мин в течение 20 мин для осаждения клеточных элементов. После этого супернатант сливали, к осадку добавляли 2 мл забуференного физиологического раствора (PBS), проводили ресуспендирование путем пипетирования на протяжении 1-2 мин и центрифугировали при 2 000 об/мин в течение 10 мин. Описанную процедуру отмывки клеточного осадка проводили дважды. Далее супернатант сливали, к осадку добавляли 0,5 мл PBS, проводили ресуспендирование путем пипетирования на протяжении 1-2 мин. К полученной клеточной взвеси добавляли моноклональные антитела к CD13, меченные фикоэритрином (РЕ – максимум флуоресценции на 578 нм, производитель BD Biosciences, США) в объеме 20 мкл. Перемешивали на персональном вортексе в течение 20 сек. Добавляли моноклональные антитела к CD15, меченные аллофикоцианином (АРС – максимум флуоресценции на 657,5 нм, производитель BD Biosciences, США) в объеме 20 мкл. Перемешивали на персональном вортексе в течение 20 сек. Далее добавляли моноклональные антитела к CD45, меченные флуоресцеин изотиоционатом (ФИТЦ – максимум флуоресценции на 518 нм, производитель BD Biosciences, США) в объеме 20 мкл. Перемешивали на персональном вортексе в течение 20 сек и убирали в темное место. Инкубацию клеточной взвеси проводили при комнатной температуре на протяжении 15 минут. После инкубации проводили измерение флуоресценции на проточном цитофлуорометре BD FACS Canto II (BectonDickinson, США).
Для изучения соотношения в осадке мочи клеточных элементов, находящихся в различных фазах клеточного цикла, брали пробирку № 2, полученную после выделения и отмывки, описанных выше. Изучение клеточного цикла осуществляли с использованием метода флуоресцентного окрашивания ki-67 и йодидом пропидия. К выделенным клеточным элементам из осадка мочи добавляли 3 мл 96%-ного этилового спирта. После этого клеточную взвесь инкубировали на холоде в течение 30 минут, затем дважды отмывали в PBS. В дальнейшем проводили окрашивание моноклональными антителами к ki-67, меченными флуоресцеин изотиоционатом (ФИТЦ - максимум поглощения на 492 нм, максимум флуоресценции на 518 нм, производитель BD Biosciences, США) в объеме 20 мкл. Также добавляли йодид пропидия (фенантридин-3,8-диамино-5-[3-(диэтилметиламмоний) пропил]-6-фенил-дийодид) в концентрации 2 мг/мл (максимум поглощения на 488 нм, максимум флуоресценции на 610 нм, Sigma-Aldrich, США) в объеме 20 мкл, после чего взвесь перемешивали и инкубировали в темноте 15 минут.
Для формирования группы контроля аналогичным способом были исследованы клетки осадка мочи группы здоровых доноров (n=69).
Статистическую обработку полученных данных осуществляли с помощью пакета прикладных программ Statistica 7.0 (StatSoft, Inc., США).
Результаты и обсуждение
При сравнительном анализе установлено статистически значимое увеличение экспрессии CD13 (р<0,01), CD15 (р<0,001), CD45 (р<0,001) антигенов на клетках осадка мочи у пациентов с неинвазивным раком мочевого пузыря по сравнению с контрольной группой, также количество клеток во всех фазах клеточного цикла статистически значимо отличалось у пациентов с НРМП по сравнению с группой контроля (р<0,001) (табл. 1).
Таблица 1
Экспрессия поверхностных антигенов CD13, CD15, CD45 и показателей митотического цикла в клетках осадка мочи
|
Показатель |
Контрольная группа (n=69) |
Больные НРМП (n=162) |
р |
||
|
Ме |
С25 – С75 |
Ме |
С25 – С75 |
||
|
CD13+ |
2,60 |
1,15 - 3,30 |
5,51 |
2,60 - 7,82 |
<0,01 |
|
CD15+ |
3,85 |
1,00 - 4,00 |
9,82 |
4,57 - 13,75 |
<0,01 |
|
CD45+ |
2,04 |
0,50 - 2,45 |
5,44 |
2,07 - 7,50 |
<0,01 |
|
G1-фаза |
7,30 |
3,90 - 9,60 |
9,24 |
6,27 - 11,40 |
<0,01 |
|
S-фаза |
76,32 |
69,50 - 79,85 |
68,48 |
62,77 - 73,75 |
<0,01 |
|
G2-фаза |
14,70 |
11,50 – 18,10 |
20,95 |
14,15 - 25,10 |
<0,01 |
|
Митоз |
1,69 |
0,80 - 1,65 |
1,83 |
1,00 - 2,62 |
<0,01 |
Для определения переменных, позволяющих прогнозировать наличие у пациента рака мочевого пузыря, использован метод дискриминантного анализа. В качестве предикторов заболевания использовались иммунологические показатели CD13, CD15, CD45, а также показатели клеточного цикла: G1 фаза, S фаза, G2 фаза, митоз, G0 фаза.
В анализ был включен 231 случай: 162 (70,1%) пациента, у которых диагностирован рак мочевого пузыря, и 69 (29,9%) здоровых доноров (группа контроля).
Использовался метод принудительного включения информативных признаков.
При проведении процедуры дискриминантного анализа иммунологические признаки рассматривались как классификационные на основании корреляции с канонической дискриминантной функцией. Вклад каждого признака в результат классификации и структурная корреляционная матрица представлены в таблице 2.
Из таблицы 2 видно, что наибольший вклад в результат классификации вносят показатели S-фаза, CD15, CD13. Эти же показатели имеют наибольшую корреляцию с канонической дискриминантной функцией.
Таблица 2
Нормированные коэффициенты канонических дискриминантных функций
|
№ |
Признак |
Функция |
Структурная матрица |
|
1. |
S-фаза |
-0,51 |
-0,68 |
|
2. |
CD15 |
0,42 |
0,66 |
|
3. |
CD13 |
0,32 |
0,62 |
|
4. |
CD45 |
0,13 |
0,52 |
|
5. |
G2-фаза |
0,26 |
0,38 |
|
6. |
G1-фаза |
-0,01 |
0,32 |
|
7. |
G0-фаза |
-0,11 |
-0,19 |
|
8. |
Митоз |
-0,18 |
0,07 |
Мера связи между дискриминирующей функцией и группами наблюдений, описываемая канонической корреляцией, составляет 0,56, что объясняет 56,0% дисперсии исходных переменных. Лямбда Уилкса при оценке канонической дискриминантной функции является статистически значимой и составляет 0,687 (χ2=84,60; р<0,001). При этом по критерию М Бокса имеют место статистически значимые отличия матриц дисперсий в группах наблюдения (р<0,001), что показывает обоснованность применения дискриминантного анализа в данном случае.
Были сформированы линейные дискриминантные модели, позволяющие на основании классификационных признаков распределить пациентов на группы по наличию или отсутствию у них злокачественного образования (табл. 3).
Таблица 3
Линейные модели дискриминантной функции
|
%№ |
Признак |
Наличие рецидива |
|
|
Нет |
Есть |
||
|
1. |
CD13 |
1,29 |
1,14 |
|
2. |
CD15 |
0,28 |
0,18 |
|
3. |
CD45 |
-0,27 |
-0,32 |
|
4. |
G1-фаза |
2,31 |
2,32 |
|
5. |
S-фаза |
2,20 |
2,29 |
|
6. |
G2-фаза |
0,72 |
0,69 |
|
7. |
Митоз |
1,95 |
2,16 |
|
8. |
G0-фаза |
0,56 |
0,59 |
|
9 |
Константа |
-103,72 |
-109,29 |
Исходя из таблицы 3, линейная дискриминантная функция для отсутствия рака мочевого пузыря выглядит следующим образом:
D1 = -103,725+ 1,298x1 + 0,2842 - 0,274x3+ 2,312x4 + 2,197x5+ 0,720x6 + 1,946x7 + 0,562x8.
Линейная дискриминантная функция, моделирующая развитие рака мочевого пузыря:
D2 = -109,288+ 1,141x1 + 0,1822 - 0,318x3+ 2,316x4 + 2,292x5+ 0,686x6 + 2,156x7 + 0,587x8,
где
D1 и D2 – линейные дискриминантные функции, х1 – экспрессия CD13, х2 – экспрессия CD14, х3 – экспрессия CD45, х4 – количество клеток в G1-фазу клеточного цикла, х5 – количество клеток в S-фазу клеточного цикла, х6 – количество клеток в G2-фазу клеточного цикла, х7 – количество клеток, находящихся в митозе, х8 – количество клеток в G0-фазу клеточного цикла.
При D1>D2 – прогнозируется низкий риск наличия РМП, при D1<D2 – прогнозируется высокий риск наличия РМП.
На основании полученных дискриминантных функций произведена итоговая классификация наблюдений, результаты которой представлены в таблице 4.
Таблица 4
Классификация при помощи дискриминантных функций
|
Результаты |
Предсказанная принадлежность |
Итого |
||
|
Нет рака |
Рак мочевого пузыря |
|||
|
Нет рака |
Абс. |
55 |
14 |
69 |
|
Рак мочевого пузыря |
33 |
129 |
162 |
|
|
Нет рака |
% |
79,7 |
20,3 |
100,0 |
|
Рак мочевого пузыря |
20,4 |
79,6 |
100,0 |
|
На основании тестирования данной модели была построена ROC-кривая (рис. 1).
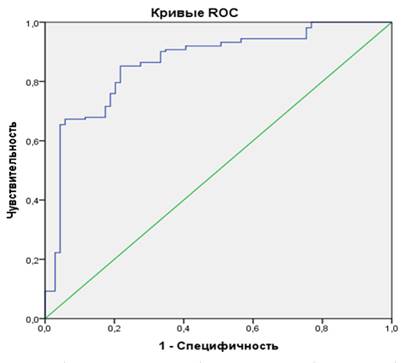
Рис. 1. ROC-кривая прогнозирования наличия рака мочевого пузыря
По результатам построения ROC-кривой показатель AUC составил 0,689±0,040 (ДИ 95% 0,611-0,868; р<0,001), что отражает высокое качество прогностической модели.
Таким образом, получена статистически значимая математическая модель, позволяющая при помощи дискриминантных функций провести классификацию единиц наблюдения по факту наличия или отсутствия рака мочевого пузыря с высокой чувствительностью – 79,6%. При этом специфичность модели - 79,7%. Общая точность модели составила - 79,7%.
На основании полученной математической модели был предложен следующий алгоритм первичной диагностики ЗНО мочевого пузыря (рис. 2).
Примечание: СНМП – симптомы нижних мочеполовых путей
Рис. 2. Алгоритм оптимизации диагностики рака мочевого пузыря
Таким образом, полученный в рамках исследования алгоритм с довольно высокой диагностической точностью предсказывает наличие неинвазивного РМП по данным экспрессии антигенов CD13, CD15, CD45, а также соотношению клеток осадка мочи в различных фазах митотического цикла и может быть использован в клинической практике.
Библиографическая ссылка
Семёнов Э.В., Мазаев А.В. РАЗРАБОТКА АЛГОРИТМА ДИАГНОСТИКИ РАКА МОЧЕВОГО ПУЗЫРЯ НА ОСНОВАНИИ ИССЛЕДОВАНИЯ КЛЕТОК ОСАДКА МОЧИ МЕТОДОМ ПРОТОЧНОЙ ЦИТОМЕТРИИ // Современные проблемы науки и образования. – 2017. – № 4. ;URL: https://science-education.ru/ru/article/view?id=26681 (дата обращения: 19.04.2024).



