Pseudomonas aeruginosa (синегнойная палочка) относится к одному из самых распространенных возбудителей внутрибольничных инфекций, которые создают серьезные проблемы в медицинской практике, и в первую очередь в отделениях реанимации и интенсивной терапии [1].
Высокая метаболическая активность, а также генетическая пластичность позволяют P. aeruginosa занимать большое количество экологических ниш. В больницах выявляются множество экологических резервуаров P. aeruginosa, включая аэрозоли, питьевую воду, смесители/краны, раковины и душевые стоки, респираторное оборудование, увлажнители, эндоскопы, бассейны для гидротерапии, а также бассейны для купания [2]. Проблема дополнительно усугубляется тем, что возбудитель обладает «чувством кворума» и способен к образованию биопленки, которая переносит различные стрессовые факторы, включая антибиотики [3].
Для определения различных уровней устойчивости к антибиотикам (антибиотикорезистентности) используются международные согласительные критерии: мультирезистентность (MDR – multidrug resistance) – резистентность по меньшей мере к одному антибиотику в трех и более категориях антимикробных препаратов, экстремальная резистентность (XDR – extensively drug resistance) – нечувствительность по меньшей мере к одному антибиотику во всех категориях антимикробных препаратов, за исключением 1-2 категорий, панрезистентность (PDR – pandrug resistance) – нечувствительность ко всем антибиотикам во всех категориях антимикробных препаратов (12 категорий) [4].
Распространенность MDR P. аeruginosa за последнее десятилетие увеличилась на 30% в странах Восточной Европы [5]. По данным European Centre for Disease Prevention and Control на 2014 г., MDR–устойчивость характерна для 14,9% изолятов P. аeruginosa, 5,5% устойчивы ко всем пяти группам антибиотиков, которые находятся под регулярным наблюдением EARS-Net (ингибитор–защищенные антисинегнойные пенициллины (пиперациллин/тазобактам), фторхинолоны (левофлоксацин), антисинегнойные цефалоспорины (цефтазидим), аминогликозиды (амикацин, гентамицин) и карбапенемы (имипенем, меропенем)), а 2,0% изолятов P. aeruginosa устойчивы к полимиксинам [6].
В России сведения об уровне антибиотикорезистентности госпитальных штаммов P. аeruginosa получены в рамках многоцентрового эпидемиологического исследования антибиотикорезистентности возбудителей нозокомиальных инфекций (МАРАФОН) в 2013-2014 гг. Доля изолятов P. aeruginosa среди всех бактериальных возбудителей составила 19,6%. Нечувствительность к антисинегнойным цефалоспоринам III и IV поколения – цефепиму и цефтазидиму проявляли 51,9% и 55,9% изолятов, к ингибитор–защищенным антисинегнойным пенициллинам (пиперациллину-тазобактаму) – 57,9%, к карбапенемам: имипенему и меропенему – 65,7% и 59,7% изолятов соответственно. У 21,3% изолятов выявлена продукция металло-β-лактамаз. Большинство изолятов были также нечувствительны к фторхинолонам: ципрофлоксацину (61,1%) и левофлоксацину (62,84%), и аминогликозидам: гентамицину (57,7%), амикацину (50,5%) и тобрамицину (46,4%) [7]. Фенотипом множественной резистентности (MDR–устойчивости) обладали 83,2% изолята, фенотипом экстремальной резистентности (XDR–устойчивости) – 51,4% изолята, включая подавляющее большинство продуцентов MBL. XDR-изоляты, как правило, сохраняли чувствительность только к полимиксинам и фосфомицину [8].
Поскольку в настоящее время наиболее эффективными антибиотиками в отношении P. aeruginosa считаются карбапенемы, то приоритетным является изучение механизмов устойчивости именно к ним [7]. Формирование резистентности к карбапенемам может быть связано с различными механизмами, но наибольшее клиническое и эпидемиологическое значение имеет продукция P. aeruginosa приобретенных металло-β-лактамаз (МБЛ) [4]. МБЛ являются металлосодержащими гидролазами, содержащими в активном центре атом цинка, что делает их недоступными действию ингибиторов сериновых β-лактамаз (клавуланат, сульбактам, тазобактам). МБЛ гидролизуют не только карбапенемы, но и все другие β-лактамные антибиотики за исключением монобактамов (азтреонам). Опасность ферментов данного класса обусловлена их высокой каталитической активностью и способностью к быстрому горизонтальному распространению в бактериальных популяциях [9]. Таким образом, продукция МБЛ делает P. aeruginosa крайне устойчивым бактериальным возбудителем.
Чрезвычайная устойчивость P. aeruginosa к антибиотикам делает ее ключевым возбудителем множества оппортунистических нозокомиальных инфекций. P. aeruginosa является одной из наиболее распространенных бактерий, вызывающих вентилятор-ассоциированную пневмонию, относительная смертность при этом колеблется от 13,5% [10] до 44,4% [11]. P. аeruginosa является одним из основных патогенов, которые инфицируют пациентов с кистозным фиброзом, причем респираторная инфекция P. aeruginosa при кистозном фиброзе является основным предиктором смертности пациентов [12]. Инфекция P. aeruginosa остается распространенным угрожающим жизни осложнением после трансплантации органов (общая смертность среди реципиентов внутренних органов с инфекциями P. aeruginosa варьирует от 28% до 47%) [13].
Таким образом, повышение уровня множественной резистентности (MDR) P. aeruginosa у госпитализированных пациентов представляет собой серьезную угрозу для общественного здравоохранения. Инфекция P. aeruginosa тесно связана с высокой летальностью среди пациентов, длительной госпитализацией, множественными заболеваниями различных органов и систем, повышенной стоимостью лечения из-за ограниченного количества антимикробных терапевтических вариантов для инфицированных пациентов.
Цель работы: изучить распространенность, уровень антибиотикорезистентности и частоту встречаемости МБЛ-продуцирующих штаммов P. aeruginosa в ожоговом (ОЦ) и гнойно–септическом центре (ГСЦ) Краевой клинической больницы (ККБ) г. Красноярска за период с 2012 по 2017 г.
Материалы и методы исследования. 8055 положительных результатов микробиологических исследований раневого отделяемого, полученных в ожоговом и гнойно–септическом центре ККБ за период с 2012 по 2017 г. Продукция МБЛ изучена у 613 штаммов P. aeruginosa с помощью фенотипического метода «двойных дисков с ЭДТА». Повторные изоляты, выделенные от одного пациента, в исследование не включали. Фенотип устойчивости изучен у 84 штаммов P. aeruginosa, выделенных в 2017 году. Оценка антибиотикорезистентности проводилась к 12 противомикробным препаратам из 5 групп (аминогликозиды амикацин, гентамицин, нетилмицин; ингибитор–защищенные антисинегнойные пенициллины пиперациллин/тазобактам, тикарциллин/клавуланат; цефалоспорины цефепим, цефтазидим, цефоперазон, цефоперазон/сульбактам; карбапенемы имипенем, меропенем; фторхинолоны ципрофлоксацин) по МУК 4.2. 1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам» (от 4.03.2004 г.).
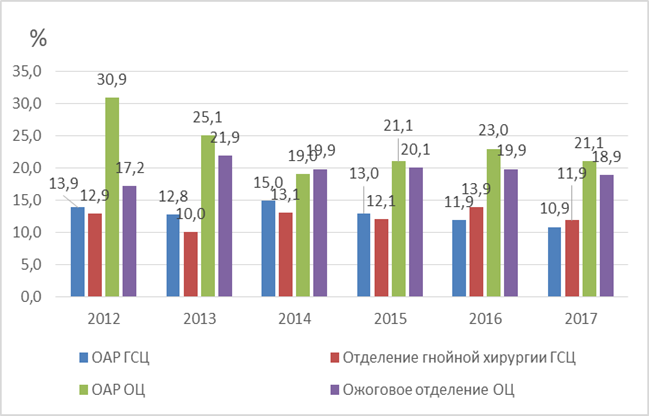
Результаты исследования и их обсуждение. За 2012–2017 гг. в отделениях ОЦ и ГСЦ выделено 1405 штаммов P. aeruginosa, что составляет 17,4%. Наибольшая распространенность P. aeruginosa (около 20%) отмечается в ОЦ, в ГСЦ - в два раза ниже (рисунок 1).
|
|
|
Рис. 1. Распространенность P. aeruginosa в ОЦ и ГСЦ ККБ за 2012–2017 гг. |
Выделенные штаммы P. aeruginosa характеризуются высоким уровнем антибиотикорезистентности, который превышает 20% и определяет возможность проведения эмпирической антибактериальной терапии [14]. Антибиотикорезистентность к аминогликозидам (амикацин, гентамицин, нетилмицин) выше 50% зарегистрирована в отделении анестезиологии и реанимации (ОАР) гнойно-септического центра (ГСЦ) и ОАР ожогового центра (ОЦ), ожоговом отделении (ОО) ОЦ. При этом в ОАР ГСЦ за период 2012-2017 гг. отмечается рост антибиотикорезистентности к амикацину с 46,9% до 51,6%, к гентамицину - с 43,8% до 60,0%, к нетилмицину - с 19,4% до 69,2%. В ОАР ОЦ отмечается рост антибиотикорезистентности к амикацину с 52,5% до 62,4%, к гентамицину - с 56,0% до 62,6%, к нетилмицину - с 50,6% до 64,5% за период 2012–2017 гг. В ОО ОЦ за период 2012–2017 гг. отмечается рост антибиотикорезистентности к амикацину с 36,6% до 50,0%, к гентамицину - с 52,5% до 61,1%, к нетилмицину - с 39,4% до 55,0%. В отделении гнойной хирургии (ГХ) ГСЦ антибиотикорезистентность к амикацину и гентамицину находится на уровне 44-50%, при этом за период 2012–2017 гг. отмечается рост антибиотикорезистентности к амикацину с 43,2% до 44,7%, антибиотикорезистентность к нетилмицину составляет 25% только в 2017 г. В целом за анализируемый период уровень антибиотикорезистентности к аминогликозидам вырос. Антибиотикорезистентность к антисинегнойным ингибитор–защищенным пенициллинам, таким как пиперациллин/тазобактам и тикарциллин/клавуланат, находится на уровне выше 50% в каждом отделении ГСЦ и ОЦ ККБ. За период 2012–2017 гг. в ОАР ГСЦ отмечается рост антибиотикорезистентности к пиперациллину/тазобактаму с 38,7% до 53,8%, в ГХ ГСЦ - с 31,6% до 56,3%, в ОАР ОЦ – с 48,1% до 55,6%, в ОО ОЦ – с 40,5% до 54,2%. В целом за анализируемый период уровень устойчивости к ингибитор–защищенным пенициллинам вырос. Антибиотикорезистентность к антисинегнойным цефалоспоринам III и IV поколений, таким как цефепим, цефтазидим и цефоперазон, превышает 50% во всех анализируемых отделениях. За период 2012–2017 гг. в ОАР ГСЦ отмечается рост антибиотикорезистентности к цефепиму с 54,8% до 65,5%, к цефтазидиму - с 41,7% до 51,9%, уровень устойчивости к цефоперазону 50,0% только в 2017 г. (за период 2012–2015 гг. отмечался рост антибиотикорезистентности к цефоперазону с 69,0 до 93,3%), в ГХ ГСЦ отмечается рост антибиотикорезистентности к цефепиму с 56,4% до 65,8%, к цефтазидиму - с 33,3% до 58,8%, уровень устойчивости к цефоперазону 60,0% только в 2017 г. (за период 2012–2015 гг. отмечался рост антибиотикорезистентности к цефоперазону с 63,2% до 78,7%), в ОАР ОЦ отмечается рост устойчивости к цефтазидиму с 60,6% до 67,0%, в ОО ОЦ отмечается рост устойчивости к цефтазидиму с 43,2% до 56,8%, к цефоперазону - с 57,1% до 58,1%. В целом за анализируемый период уровень устойчивости к антисинегнойным цефалоспоринам III и IV поколений вырос. Антибиотикорезистентность к ингибитор–защищенным цефалоспоринам, таким как цефоперазон/сульбактам, несколько ниже и составила в 2017 г. 33% и 38% в ОАР и ГХ ГСЦ соответственно и 41,7% и 43,2% в ОАР и ОО ОЦ. Уровень антибиотикорезистентности к карбапенемам, таким как имипенем и меропенем, характеризуется одинаково высоким уровнем антибиотикорезистентности P. aeruginosa 55-60% во всех отделениях ГСЦ и ОЦ ККБ. За период 2012–2017 гг. в ОАР ГСЦ уровень антибиотикорезистентности к меропенему увеличился с 56,7% до 63,3%, в ГХ ГСЦ увеличился уровень устойчивости к меропенему с 48,6% до 55,6% и к имипенему с 57,9% до 66,7%, в ОО ОЦ увеличился уровень устойчивости к имипенему с 51,2% до 55,9%. В целом за анализируемый период уровень устойчивости к карбопенемам вырос. Устойчивость к фторхинолонам, таким как ципрофлоксацин, в ГСЦ и ОЦ варьирует от 58% до 68%, что исключает его применение в качестве эмпирической антисинегнойной терапии во всех отделениях ГСЦ и ОЦ ККБ.
Фенотипом MDR-устойчивости (устойчивость не менее чем к 3 антимикробным препаратам из перечисленных: пиперациллин + тазобактам, цефтазидим, фторхинолоны, аминогликозиды и карбапенемы) обладали все 100% штаммов P. aeruginosa. Фенотипом PDR-устойчивости (устойчивость одновременно ко всем перечисленным препаратам: пиперациллин + тазобактам, фторхинолоны, цефтазидим, аминогликозиды и карбапенемы) обладали 32,1% штаммов. Продукция MBL выявлена у 404 из 613 (65,9%) штаммов P. aeruginosa, в ГСЦ продуценты MBL составили 63,5%, в ОЦ 67,1% (таблица).
Доля продуцентов MBL среди штаммов P. aeruginosa, выделенных
в ГСЦ и ОЦ ККБ в 2012–2017 гг.
|
Отделение |
годы |
Всего изучено |
МБЛ + |
Отделение |
годы |
Всего изучено |
МБЛ + |
||
|
на наличие МБЛ |
аб.ч. |
% |
на наличиеМБЛ |
аб.ч. |
% |
||||
|
ГХ ГСЦ |
2012 |
3 |
1 |
33,3 |
ОО ОЦ |
2012 |
18 |
6 |
33,3 |
|
|
2013 |
22 |
14 |
63,6 |
2013 |
42 |
25 |
59,5 |
|
|
|
2014 |
28 |
16 |
57,1 |
2014 |
40 |
27 |
67,5 |
|
|
|
2015 |
22 |
15 |
68,2 |
2015 |
31 |
23 |
74,2 |
|
|
|
2016 |
7 |
4 |
57,1 |
2016 |
1 |
1 |
100,0 |
|
|
|
2017 |
21 |
15 |
71,4 |
2017 |
28 |
15 |
53,6 |
|
|
ОАР ГСЦ |
2012 |
4 |
1 |
25,0 |
ОАР ОЦ |
2012 |
13 |
5 |
38,5 |
|
2013 |
18 |
14 |
77,8 |
2013 |
64 |
53 |
82,8 |
||
|
2014 |
26 |
17 |
65,4 |
2014 |
55 |
38 |
69,1 |
||
|
2015 |
12 |
11 |
91,7 |
2015 |
43 |
32 |
74,4 |
||
|
2016 |
4 |
2 |
50,0 |
2016 |
11 |
9 |
81,8 |
||
|
2017 |
30 |
15 |
50,0 |
2017 |
70 |
45 |
64,3 |
||
|
всего |
|
197 |
125 |
63,5 |
всего |
|
416 |
279 |
67,1 |
При этом доля продуцентов MBL среди штаммов P. aeruginosa за 2012–2017 гг. увеличилась в ГХ ГСЦ с 33,3% до 71,4%, в ОАР ГСЦ – с 25,0% до 50,0%, в ОО ОЦ – с 33,3% до 53,6%, в ОАР ОЦ – с 38,5% до 64,3%.
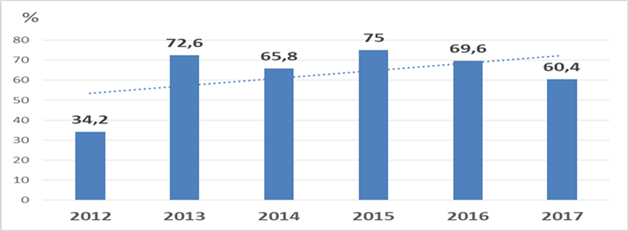
За анализируемый период доля продуцентов MBL среди штаммов P. aeruginosa, выделенных в ГСЦ и ОЦ ККБ, увеличилась практически в два раза: с 34,2% в 2012 году до 60,4% в 2017 году (рисунок 2).
|
|
|
Рис. 2. Доля продуцентов MBL среди штаммов P. aeruginosa, выделенных в ГСЦ и ОЦ ККБ в 2012–2017 гг. |
Выводы
Распространенность P. aeruginosa в ГСЦ и ОЦ ККБ в целом составляет 17,4%, при этом в ОЦ распространенность в 2 раза выше, чем в ГСЦ, и составляет 20,4% и 11,5% соответственно.
Все выделенные штаммы P. aeruginosa характеризуются MDR-фенотипом устойчивости, более 1/3 штаммов – PDR-фенотипом устойчивости. Продуценты MBL среди штаммов P. aeruginosa выявлены как в ГСЦ, так и ОЦ в 63,5% и 67,1% случаев соответственно.
Антибиотикорезистентность P. aeruginosa к антисинегнойным пенициллинам, цефалоспоринам, карбапенемам, аминогликозидам и фторхинолонам существенно превышает уровень 20%, что свидетельствует о необходимости исключения этих противомикробных препаратов из схем эмпирической терапии.
Для разработки локальных протоколов лечения инфекций, вызванных P. aeruginosa, необходимо изучить уровень антибиотикорезистентности к полимиксину, фосфомицину и азтреонаму.
Библиографическая ссылка
Бочанова Е.Н., Бучко Е.О., Головина Н.И., Копытко Л.Н., Курц Е.М., Орлова К.Э., Сарматова Н.И., Торгунакова М.С. АНТИБИОТИКОРЕЗИСТЕНТНОСТЬ PSEUDOMONAS AERUGINOSA В ОЖОГОВОМ И ГНОЙНО-СЕПТИЧЕСКОМ ЦЕНТРАХ КРАСНОЯРСКА // Современные проблемы науки и образования. – 2019. – № 2. ;URL: https://science-education.ru/ru/article/view?id=28676 (дата обращения: 24.04.2024).