Тканевая инженерия – это одно из направлений регенеративной медицины, которое может стать альтернативным способом лечения пациентов, нуждающихся в органной трансплантации. Суть тканевой инженерии заключается в восстановлении структурной и функциональной целостности тканей и органов с помощью биоискусственных конструкций, включающих в себя следующие [3]:
? клетки, способные формировать функционирующий внеклеточный матрикс;
? подходящий биодеградируемый носитель (матрикс) для трансплантации клеток;
? биоактивные молекулы (цитокины, факторы роста), которые оказывают биостимулирующее действие на клетки поврежденной ткани.
В развитии современной тканевой инженерии приоритетным направлением является поиск биоинженерных каркасов и биоматериалов, применение которых позволило бы решать как этические, так и иммунологические проблемы трансплантологии.
Для создания биологических каркасов необходимо децеллюляризировать нативные органы, чтобы сделать их неиммунногенными. Процесс децеллюляризации должен быть нацелен на сохранение биохимического состава, тканевой структуры, а также механических свойств сохранившегося внеклеточного матрикса на оптимальном уровне [4]. В связи с этим требуется разработка и оптимизация процессов децеллюляризации.
Цель децеллюляризации – изоляция компонентов внеклеточного матрикса ткани без каких-либо потерь, повреждения или разрушений, полное удаление клеточного материала. В настоящее время это представляется маловозможным, так как любой процесс, который разрушает клетки, обязательно изменяет внеклеточный матрикс.
Практической целью является максимальное удаление клеточного материала, сведение к минимуму потерь и ущерба для ВКМ. Недавно были предложены объективные критерии децеллюляризации тканей:
1) отсутствие ядер при окрашивании гематоксилином и эозином, флуорофором (4’,6-диамидино-2-фенилиндола) DAPI;
2) количественное содержание ДНК менее 50 нг/мг в сухой ткани;
3) содержание фрагментов ДНК размером не более 200 пар нуклеотидов [6].
В настоящее время существует проблема эксплантации и своевременной доставки органов приматов для проведения децеллюляризации непосредственно перед выполнением самой процедуры. Важную роль играет поиск способа хранения органа, позволяющего максимально возможным образом сохранить его структуру и снизить риск возможной бактериальной контаминации и гниения. Цель данной статьи – сравнение результатов децеллюляризации пищевода Macaca mulatta, проведенной по описанному ранее протоколу [1] с результатами, полученными после длительного хранения органа при температуре ?30 °С.
Материал и методы исследования
Децеллюляризация пищевода
Для создания децеллюляризированного матрикса тканеинженерного пищевода использовали органы 4 самцов макак-резус (Macaca mulatta). Все манипуляции с животными осуществляли с соблюдением правил проведения работ с использованием экспериментальных животных (протокол локального этического комитета № 30/1). Эксплантацию органокомплексов осуществляли в ФГБНУ «Научно-исследовательский институт медицинской приматологии». Далее пищевод транспортировали в лабораторию в охлажденном растворе PBS -/- (Gibco, Англия) при температуре +4 °С. Время доставки составило не более 2 ч. На данном этапе либо приступали к проведению непосредственно децеллюляризации (протокол № 1), либо замораживали орган при температуре –30 °С и сохраняли в морозильной камере для отсроченного выполнения децеллюляризации (протокол № 2).
Для проведения децеллюляризации пищевод Macaca mulatta размораживали (протокол № 2) при +4 °С в течение 16 часов, далее (протокол № 1–№ 2) в стерильных условиях с помощью пинцета и ножниц пищевод отделяли от окружающей его соединительной ткани. Для проведения децеллюляризации краниальную и каудальную части пищевода канюлировали пластиковыми катетерами в соответствии с их диаметром. Орган присоединяли к перистальтическому насосу посредством соединительных трубок и помещали в специализированный биореактор ORCA (Harvard Apparatus, США) (рис. 1).
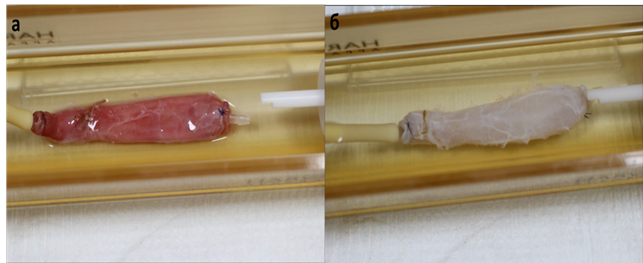
Рис. 1. Пищевод Macaca mulatta в биореакторе ORCA до (а) и после (б) децеллюляризации
Оригинальный протокол децеллюляризации пищевода крысы детергент-энзиматическим методом [8] был модифицирован нами c изменением времени воздействия, состава и порядка перфузии децеллюляризирующими растворами для получения ацеллюлярного матрикса пищевода Macaca mulatta – протокол № 1 [1,2]. Для проведения децеллюляризации пищевода Macaca mulatta, хранившегося при температуре –30 °С, была разработана иная процедура – протокол № 2 (таблица).
Алгоритм проведения децеллюляризации пищевода по различным протоколам
|
Протокол №1 |
Протокол №2 |
|
|
Условия хранения образцов |
Раствор фосфатного буфера при +4°С |
Морозильная камера при -30°С |
|
Последовательность применения детергентов и энзимов в одном цикле |
1. Деионизированная вода – 1 ч; 2. Дезоксихолат натрия 4 % р-р + mM р-р ЭДТА – 1 ч; 3. PBS -/- – 10 мин; 4. Свиная панкреатическая ДНКаза-I 2000 ЕД /200 мл PBS +/+ – 1 ч. |
1. Дезоксихолат натрия 4 % р-р + 2 mM р-р ЭДТА – 1 ч; 2. Деионизированная вода – 1час 3.Свиная панкреатическая ДНКаза-I 2000 ЕД /200 мл PBS +/+ – 1 ч. |
|
Количество циклов |
2 |
4 |
|
Скорость перфузии децеллюляризирующих растворов |
150 мл/мин |
21 мл/мин |
|
Время процедуры (с учетом отмывки органа в растворе фосфатного буфера) |
24 ч |
24 ч |
Полученные образцы нативного и децеллюляризированного пищевода фиксировали в 10 %-ном нейтральном забуференном формалине, дегидратировали и заключали в парафин по стандартной методике. С помощью микротома получали срезы толщиной 5 мкм. Для общегистологической оценки препаратов проводили окраску срезов гематоксилином и эозином (Histolab, Швеция). Для проведения иммуногистохимического анализа в качестве первичных были выбраны поликлональные антитела к коллагену I типа (ab34710, Abcam, Англия), коллагену IV типа (ab6586, Abcam, Англия), ламинину (ab11575, Abcam, Англия), фибронектину (ab2413, Abcam, Англия), тропомиозину (ab133292, Abcam, Англия), панцитокератину (ab7753, Abcam, Англия), VEGF (ab46154, Abcam, Англия). Препараты дополнительно докрашивались гематоксилином. Изучение микропрепаратов проводилось на микроскопе Olympus BX51 (Япония). Для количественного анализа результатов иммуногистохимического окрашивания был применен метод оценки площади позитивно окрашенных участков исследуемых образцов в узкой спектральной области с оптической плотностью выше пороговой на основе принципа цветовой деконволюции [7]. В результате пакетной обработки образцов была получена серия изображений, представляющих собой карту интенсивности распределения DAP хромогена. Для оценки был выбран метод оценки площади структур с интенсивностью окрашивания выше пороговой.
Для количественной оценки содержания ДНК в нативных и децеллюляризированных органах (n=4) на спектрофотометре NanoDrop ND-1000 (Thermo Fisher Scientific Inc., USA) были использованы наборы реактивов (Dneasy Blood and Tissue Kit, Qiagen, Sweden) по стандартным протоколам.
Статистический анализ
Статистическую обработку полученных данных осуществляли методами вариационной статистики на персональном компьютере с использованием программного обеспечения Excel for Office. Полученные результаты выражали в виде средних значений (M) и ошибки среднего (m). При сравнении средних значений изучаемых групп процент возможной ошибки находили по таблице t-критерия Стьюдента для парных сравнений, выражаемый в виде значений достоверности различия – «р», где р<0,05 считалось статистически достоверным.
Результаты и их обсуждение
При проведении децеллюляризации по протоколу № 1 пищевод приобрел молочно-белую окраску, свойственную всем ацеллюлярным матриксам в течение 2 циклов обработки (6 часов активного воздействия детергентами и энзимами). Окрашивание гематоксилином и эозином не выявило клеток и ядер. Сохранялась свойственная нативной ткани пищевода гистоархитектоника. Выявляли эпителий (в клетках отсутствовали ядра), базальную мембрану, подслизистый слой, состоящий из рыхлой волокнистой соединительной ткани. Мышечный слой также оказался ацеллюлярным, сохранялись единичные поврежденные мышечные волокна наружного мышечного слоя, не содержащие ядер (рис. 2).
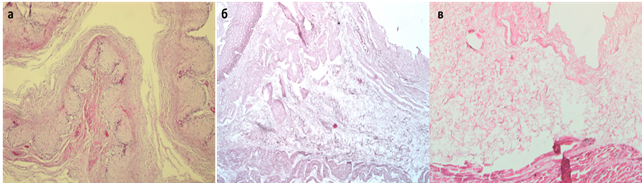
Рис. 2. Нативный пищевод (а). Децеллюляризированный пищевод по протоколу №1 (б) и протоколу №2 (в). Увеличение: об.х10, ок. х10.
Протокол № 2 имел существенные отличия. Необходимо отметить, что цикл заморозки-оттаивания органа сам по себе является одним из этапов получения ацеллюлярного матрикса [5]. В результате происходит лизис клеток, однако, мембранные структуры и внутриклеточное содержимое сохраняются, если их не удаляют путем последующей обработки. Также в этом случае происходит повреждение ультраструктуры внеклеточного матрикса, которое может отразиться на его биомеханических характеристиках [6]. Нами было отмечено, что для эффективной децеллюляризации тканей пищевода, подвергшегося замораживанию-оттаиванию, во-первых, требуется большее количество циклов воздействия детергентами и энзимами – 4 вместо 2, что, соответственно, увеличивает время их активного воздействия (12 часов в сравнение с 6 часами в случае использования протокола № 1). Увеличение времени процедуры приводит к большему повреждению матрикса, и, возможно, ухудшит в дальнейшем его взаимодействие со стволовыми клетками при рецеллюляризации органа. Во-вторых, отличительной особенностью протокола № 2 явилось снижение скорости потока децеллюляризирующих растворов через орган со 150 мл/мин до 21 мл/мин, что было продиктовано снижением механической прочности органа после оттаивания. Во внеклеточном матриксе пищевода Macaca mulatta, полученному по протоколу № 2, неповрежденные клетки и клеточные ядра отсутствовали. В то же время произошло более значительное разволокнение структур внеклеточного матрикса, преимущественно расположенных в подслизистом слое. Наружный продольный мышечный слой пищевода практически полностью был разрушен в результате цикла заморозки-оттаивания органа, во внутреннем циркулярном мышечном слое выявлена более выраженная экспрессия тропомиозина, который удалялся с меньшей эффективностью, чем при использовании протокола № 1.
Проведение иммуногистохимического исследования децеллюляризированных органов показало, что локализация белков внеклеточного матрикса коллагена I и IV типов, ламинина, фибронектина соответствовала таковой в нативном органе. Эндотелиальный фактор роста сосудов – VEGF в нативном пищеводе выявляли как внутри, так и вне мышечных клеток во внеклеточном матриксе. В децеллюляризированных по обоим протоколам органах указанный белок обнаруживали в области подслизистого слоя (данные не представлены).
Особенно важным этапом сравнения протоколов децеллюляризации было подтверждение сохранности компонентов внеклеточного матрикса и отсутствия внутриклеточных белков количественными методами. Сравнительный количественный анализ содержания основных структурных и внутриклеточных белков показал: оба протокола децеллюляризации позволяют сохранить в матриксе такие протеины, как коллаген I и IV типов, ламинин, VEGF. Однако при децеллюляризации по протоколу № 2 содержание фибронектина в матриксе было существенно ниже, что, вероятно, связано с его нестабильностью к замораживанию-оттаиванию. В то же время содержание внутриклеточного сократительного белка тропомиозина, способного вызывать иммунный ответ, в этом случае было выше, чем при децеллюляризации по протоколу № 1 (рис. 3).
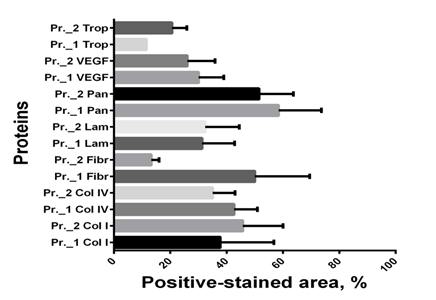
Рис. 3. Количественный анализ содержания белков в децеллюляризированной ткани
Анализ содержания ДНК показал снижение количества ядерного материала в децеллюляризированном пищеводе по протоколу № 1 до 29 % и по протоколу № 2 до 36 % от исходного уровня. Полученные результаты свидетельствовали об эффективности проведенной децеллюляризации, после которой матрикс был в значительной степени (p = 0,0011) очищен от ядерного материала.
Заключение
Заморозка органов в морозильной камере при –30°С для удлинения времени транспортировки и хранения и последующее их оттаивание в целях децеллюляризации требует внесения изменений в протокол проведения данной процедуры. Во-первых, необходимо увеличивать количество циклов воздействия детергентами и энзимами, во-вторых, требуется снижать скорость перфузии матрикса для сохранения его механической целостности. Содержание основных белков внеклеточного матрикса и уровень остаточной ДНК в обоих протоколах децеллюляризации отличается незначительно, однако повреждение структуры после проведения замораживания-оттаивания носит более выраженный характер. Таким образом, прибегать к заморозке и хранению пищевода Macaca mulatta можно лишь в исключительных случаях и с обязательным изменением протокола децеллюляризации. Целью следующего этапа исследований будет являться сравнение цитотоксических свойств децеллюляризированных матриксов пищевода, полученных по обоим протоколам, и оценка способности мультипотентных мезенхимальных стромальных клеток к адгезии и росту на данных каркасах.
Работа выполнена при поддержке государственного задания Министерства здравоохранения Российской Федерации (от 28.01.2015 г. ч. 1, раздел 1) «Разработка экспериментальных образцов тканеинженерных конструкций на основе децеллюляризированных матриксов для применения в регенеративной медицине».



