Первое десятилетие нового, XXI века было объявлено ВОЗ Всемирной декадой костей и суставов. Это обусловлено постоянным увеличением числа больных среди населения ведущих стран мира, у которых регистрируются заболевания и травматические повреждения костно-суставного аппарата. В связи с увеличением случаев травматизма, количества посттравматических и постоперационных осложнений увеличилась и потребность в пластическом материале для замещения различных дефектов [20].
В европейских странах число инфекций, вызванных заражением имплантационного устройства, превышает 100 тыс. случаев в год. В США и Западной Европе каждый год фиксируется до 500 тыс. случаев катетер-ассоциированных инфекций (Бережанский, Жевнерев, 2006) [3]. В целом около 5% имплантируемых фиксирующих устройств заражаются. Частота инфицирования после внутренней фиксации закрытых переломов низкая и составляет 0,5-2%, в то время как инфицирование вследствие фиксации открытых переломов может превышать 30% [32].
С конца прошлого столетия в медицине в многочисленных исследованиях стали появляться сообщения о способности бактерий образовывать пленчатые макроструктуры на поверхностях различных медицинских имплантатов и катетеров. Микроорганизмы, которые образовывали такие структуры, отличались повышенной выживаемостью [4; 21; 26].
Образование биопленок при этом ведет к возникновению тяжелых имплантат-ассоциированных инфекционных осложнений, сепсисов. Это серьезная проблема в медицинской практике, поскольку в хирургических и реанимационных отделениях клиник широко используются различные инвазивные материалы [10].
Накопление микроорганизмов на поверхности имплантатов в виде биопленок и их дальнейшее распространение по организму может служить причиной развития хронического воспаления, имплантат-ассоциированной инфекции, что в свою очередь приводит к необходимости удаления зараженного устройства. С медицинской и экономической точки зрения их постоянная замена является неэффективной и вызывает трудности [30].
Первое свидетельство причастности биопленкообразования на поверхности имплантатов к инфекционным заболеваниям представлено в 1982 году при электронно-микроскопическом исследовании кардиостимуляторов у пациентов с рецидивирующей инфекцией, вызванной Staphylococcus aureus [26]. В своих исследованиях J.W. Costerton с сотрудниками (1999) первыми выявили взаимосвязь между развитием биопленок и хронических инфекций. В последующие десятилетия подтвердили неоспоримое участие биопленок в развитии патологических процессов в инфицированных тканях. Более того, было признано, что использование различных медицинских устройств, имплантируемых в организм человека, благоприятствует развитию инфекций [30].
К настоящему времени доказано, что 72-91% случаев нозокомиальной инфекции ассоциированы с использованием катетеров, имплантов, стентов и т.д., что сопровождается контаминацией поверхности вирулентной флорой с образованием биопленок и L-форм бактерий, которые практически не чувствительны к проводимой антибактериальной терапии [18].
Основные виды имплантатов, заражение которых может привести к имплантат-ассоциированным инфекциям - центральные венозные катетеры, сердечные клапаны, искусственные желудочки сердца, коронарные стенты, имплантируемые нейростимуляторы, желудочковые шунты, суставные протезы, устройства для фиксации переломов, грудные имплантаты, контактные линзы, зубные имплантаты, кохлеарные имплантаты.
Большие ортопедические операции, как правило, связаны с установкой металлоконструкций. Установка постоянного имплантата приводит к возникновению пожизненного риска развития инфекции, которая может привести к хроническому постимплантационному остеомиелиту и инвалидизации больного, а в самых тяжелых случаях при генерализации процесса с развитием синдрома системной воспалительной реакции или сепсиса – к летальному исходу [2].
Биопленка может быть охарактеризована как структурированное скопление микроорганизмов одного или нескольких видов, заключенное в выделенный ими экзополимерный матрикс и прикрепленное к абиотическим или биотическим поверхностям. Матрикс биопленки состоит из экзополисахаридов, белков, тейхоевых кислот, липидов, внеклеточной ДНК [6; 19].
Микроорганизмы в таких конгломератах отмечаются высокой устойчивостью к агрессивным факторам окружающей среды: УФ-облучение, изменение рН среды, высыхание, воздействие антибиотиков [6]. Возможно, антибиотикорезистентность связана с тем, что в составе биопленок имеются покоящиеся клетки с низким метаболическим уровнем и фенотипически устойчивые варианты бактерий, называемые «персистеры». Бактерии, испытывая недостаток питательных веществ, могут переходить в некультивируемое состояние, а медленно растущие клетки обладают низкой чувствительностью ко многим антибактериальным веществам [7]. Они также могут находиться в виде свободноплавающего скопления клеток со свойствами, которые характерны биопленкам, ассоциированным с поверхностью [22].
Биопленкообразование на имплантатах можно разделить на 4 стадии: клеточная адгезия, обратимая стадия, созревание и дисперсия биопленки [24].
Бактериальная адгезия определяется физико-химическими свойствами прикрепляющихся клеток, субстрата и окружающей среды. Большая часть факторов среды, такие как её состав, гидродинамические условия, температура, время контакта, концентрация бактерий или присутствие антибиотиков и дезинфектантов, могут влиять на бактериальную адгезию. К факторам, которые могут влиять на адгезию бактерий к твердой поверхности, можно также отнести химический состав материала, поверхностный заряд, гидрофобность и свободную энергию поверхности, а также шероховатость поверхности [13].
На втором этапе бактериальные клетки начинают пролиферировать и слипаться друг с другом, что приводит к образованию микроколоний. Затем эти организованные структуры погружаются в собственно продуцированный внеклеточный матрикс. Таким образом, биопленки постепенно колонизируют поверхность инвазивного устройства [23].
На стадии созревания микроколонии разрастаются и сливаются, образуя макроколонию. Также формируются специфические структуры биопленки: каналы, полости, поры и выросты. Благодаря данным формированиям осуществляется движение питательных веществ, удаляются метаболические отходы [6]. В основном на данном этапе регуляция осуществляется при помощи системы Quorum sensing [27].
В определенный момент времени биопленка достигает критической массы, возникает динамическое равновесие, при этом от наружных слоев биопленки начинают открепляться клетки, способные покидать биопленку и колонизировать другие поверхности, чтобы повторить цикл. Благодаря этому патогенные бактерии захватывают новые места обитания, приводя к распространению инфекции. Открепление планктонных клеток может происходить как под действием внешних сил (давление жидкости, механическое воздействие), так и из-за внутренних (энзиматическая деградация протеазами, альгинатлиазами и др.) [6; 17].
Считается, что вода является главным компонентом матрикса биопленки, на долю которого приходится до 97%. Тогда как содержание бактерий составляет 10–50% от общего объема биопленки. Количество внеклеточных полимерных веществ колеблется в пределах 50–90% от общего количества органического углерода в биопленках. Кроме полисахаридов, белков, нуклеиновых кислот или фосфолипидов в матриксе биопленок также могут быть обнаружены другие неклеточные материалы, такие как кристаллы минеральных соединений или компоненты крови, присутствие которых зависит от окружающей среды, в которой развивалось это сообщество.
Имплантат-ассоциированные инфекции случаются из-за инфицирования во время операции или сразу после нее благодаря микробному распространению по кровотоку из отдаленного очага инфекции либо из-за прямого или лимфогенного распространения из инфекционного очага или проникающей травмы [28].
Анализ литературных данных позволил выявить микроорганизмы, которые чаще всего образуют биопленки на имплантатах. Почти все виды являются представителями нормальной микрофлоры организма человека. Так, ведущие позиции занимают два вида стафилококков Staphylococcus aureus и S. epidermidis – 49,9%, в том числе и метициллинрезистентные штаммы (MRSE), далее следуют Enterococcus faecalis – 6,4% представители неферментирующих грамотрицательных бактерий (Acinetobacter spp. и P. aeruginosa) – 11% и представители семейства энтеробактерий (E. cloacae, Klebsiella pneumoniae, Escherichia coli) – 4,1% (рисунок) [2].
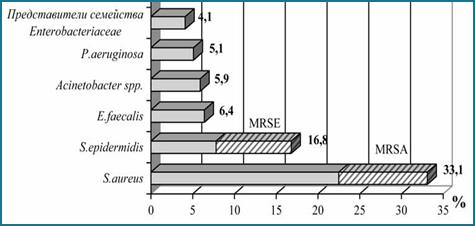
Ведущие виды микроорганизмов, образующих биопленки на имплантатах
Источник [2, с. 7]
Эти и другие биопленкопродуцирующие микроорганизмы проникают в организм в процессе имплантации или еще до операции колонизируют поверхности имплантата. Заражение имплантационных поверхностей может приводить к развитию септического шока, некроза тканей вследствие хронического воспаления вокруг имплантата и дальнейшему распространению инфекции внутри организма. Оксиданты, вырабатываемые иммунными клетками для борьбы с биопленками, не способны проникнуть сквозь экзополимерный матрикс; это приводит к накоплению этих веществ и повреждению собственных клеток [29].
Из-за высокой устойчивости к антибиотикам возникающие хронические инфекции трудно поддаются лечению и подвергают пациента риску рецидива. В течение биопленочной инфекции планктонные формы бактерий могут отделяться от биопленки и распространяться локально вокруг источника заражения или по кровотоку по всему организму. В большинстве случаев удаление зараженного устройства или хирургическое удаление пораженной ткани является единственным эффективным способом борьбы с биопленочными инфекциями [1].
Лечение хронических инфекций в настоящее время уже не может основываться на планктонной концепции микробиологии. Представление о биопленках изменяет подходы к диагностике и лечению инфекционных поражений в самых различных областях медицины. Этому способствует разработка соответствующих методов молекулярной диагностики, а также стратегий лечения, воздействующих на механизмы формирования и функционирования бактериальных сообществ в виде биопленок [25].
Таким образом, на сегодняшний день имплантат-ассоциированные инфекции, чаще всего вызванные образованием микробных биопленок на поверхности имплантатов, являются актуальными. Для борьбы с ними необходимо учитывать материалы, из которых изготовлены имплантаты, а также исследовать особенности образования биопленок всех известных возбудителей с целью их разрушения. Кроме того, необходимо обратить внимание на возбудителей сапрозоонозов, способных вызывать генерализованные инфекции и практически не исследованных в отношении взаимодействия с имплантатами.
Работа выполнена при поддержке Российского научного фонда (№ 14-33-00009) и Правительства РФ (Федерального агентства научных организаций).



