Важным и определяющим звеном в процессе формирования микробиоценоза является первичная колонизация бактериями новорожденного, так как в дальнейшем состояние здоровья индивидуума и резистентность к целому ряду заболеваний во многом зависят от характера кишечной микрофлоры и ее активности.
До недавнего времени считалось, что формирование микробиоценоза начинается в момент рождения и обусловлено видовым составом микрофлоры родовых путей матери. Однако с конца 80-х годов прошлого века в зарубежной литературе стали появляться работы, демонстрирующие контакт микрофлоры матери с плодом in utero. Открытие отечественными учеными [10] «феномена бактериальной транслокации» еще в большей степени подвергло сомнению убеждение о стерильности желудочно-кишечного тракта плода. В работе И.А. Бочкова [5] была установлена идентичность кишечных штаммов новорожденного и материнской микрофлоры. Эти факты свидетельствуют в пользу того, что внутриутробно развивающийся плод не является стерильным, а получает от матери какое-то количество индигенных микроорганизмов.
При проведении совместных исследований с ФГБУ «Нижегородский НИИ детской гастроэнтерологии» было выявлено, что среди беременных с дисбиозом кишечника 70% имели отклонение в течении беременности, родов и послеродового периода. У 50% детей, родившихся от них, отмечались отклонения в состоянии здоровья, причем процент их увеличивался до 78% в зависимости от выраженности изменений и состава биоценоза [7].
В связи с этим следует осознавать важность состояния здоровья матери, параметров биоценоза ее кишечника и родовых путей, поскольку она является первичным источником колонизации, а в ряде случаев и инфицирования ребенка [11].
Цель исследования: установить особенности формирования микрофлоры кишечника человека в онтогенезе, подтвердить зависимость между состоянием микробиоты беременной женщины и состоянием новорожденного, а также разработать тактику коррекции нарушений микрофлоры кишечника с использованием авторских пробиотиков группы «LB-комплекс».
Материалы и методы исследования. Было проведено исследование микрофлоры просвета толстой кишки 3268 «здоровых» и «больных» людей различных возрастных групп. Группы людей были сформированы по критериям здоровья, определенным для каждой возрастной группы в отдельности. Проверка данных на нормальность распределения проводилась с применением статистических критериев Колмогорова-Смирнова и Шапиро-Уилка. Для статистической обработки полученных результатов использовались непараметрические критерии Mann - Whitney и Kruskal - Wallis [1]. Многомерный кластерный анализ данных проведен методом Варда, результаты кластеризации проанализированы с помощью метода К-средних, критический уровень значимости р принимался за 0,05. В случае множественных сравнений производилась корректировка критического уровня значимости с помощью поправки [1].
Изучение микрофлоры толстой кишки проводилось по методу, разработанному Р.В. Эпштейн-Литвак и Ф.Л. Вильшанской и модифицированному в Нижегородском НИИЭМ [8].
Результаты исследования и их обсуждение
Группы «здоровых» детей были сформированы по критериям здоровья, определенным для каждой возрастной группы в отдельности: «здоровые» (0-1 месяц) - дети, рожденные от здоровых матерей, в анамнезе не имеющих вредных привычек, хронических соматических и инфекционных заболеваний, анемий, болезней мочеполовой системы (в том числе кольпитов), без отягощенного акушерско-гинекологического анамнеза (инфекционных осложнений при предыдущих беременностях, привычного невынашивания и т.п.), родоразрешившихся естественным путем, без кровотечений в послеродовом периоде, не получавших антибактериальную терапию в течение всего периода беременности, в родах и послеродовом периоде.
Дети доношенные, рожденные в срок, весом от 2,6 до 4,0 кг, ростом от 46 до 54 см, оценка по шкале Апгар 8-10 баллов, без врожденных аномалий развития, не испытывавшие хроническую внутриутробную гипоксию, асфиксию в родах, не получившие травм в родах, не имевшие синдрома дыхательных расстройств, не получающие антибактериальную терапию, находящиеся на естественном или смешанном вскармливании.
Материал на исследование отбирался в период санитарно-эпидемиологического благополучия в родильных домах.
Другие группы «здоровых» детей (старше 1 месяца) были отобраны соответственно принятым нормативам детского возраста [6]. Это дети, получавшие прикорм согласно возрастным нормам [4], не имевшие на момент обследования проявлений каких-либо заболеваний, в том числе респираторных, и в течение 2 месяцев до обследования не принимавшие антибиотики.
К группе «больных» детей (0-1 месяц) были отнесены доношенные дети без врожденных уродств и выраженной патологии, отнесенные к подгруппе риска по развитию гнойно-воспалительных заболеваний по клиническим показателям состояния здоровья новорожденного по шкале Апгар (менее 8 баллов) и факторам пренатального риска у матери.
Группы «больных» в возрасте от 1 месяца и более были сформированы по следующим критериям: «больные» – пациенты, в анамнезе которых на момент обследования отмечались хронические заболевания в стадии обострения или клинические проявления острой формы, на фоне применения антибактериальных и/или других лекарственных средств, так и при первичном обращении до назначения этиотропной терапии, а также все не вошедшие в группу «здоровые».
Обобщив данные, полученные по каждой возрастной группе, можно представить процесс формирования микрофлоры у здоровых и больных людей в течение жизни (рис. 1).
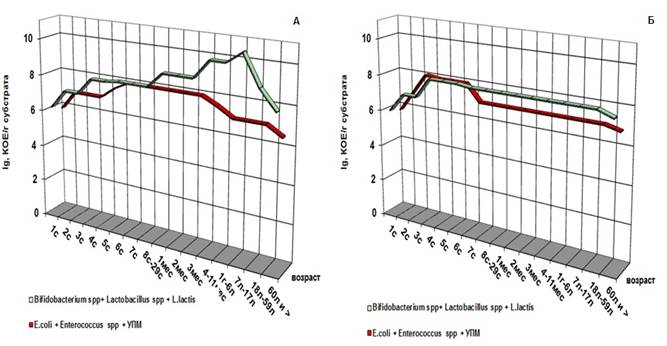
Рис. 1. Характеристика численности аэробной и анаэробной симбионтной микрофлоры толстой кишки «здоровых» (А) и «больных» (Б) людей разных возрастных групп (количество микроорганизмов приведено в усредненных значениях)
На рисунке видно, что в первые сутки жизни в процессе формирования микрофлоры кишечника как у здоровых, так и у больных младенцев участвуют как аэробные, так и анаэробные микроорганизмы, причем в равных соотношениях с первого часа жизни, процесс нарастания анаэробной компоненты (представители родов Lactobacillus, Lactococcus и Bifidobacterium) идет параллельно с ростом условно-патогенных микроорганизмов, E.coli и бактерий рода Enterococcus до уровня 105-107 КОЕ/мл.
Начиная с шестых суток жизни у детей обеих групп анаэробная флора начинает преобладать. Но у здоровых детей она выделяется в количестве 109-1010 КОЕ/мл, а у больных - 106-107КОЕ/мл, причем если преобладание количества лакто- и бифидобактерий над УПМ и кишечной палочкой у здоровых детей идет на 2-3 порядка, то у больных детей эта разница наблюдается в пределах одного порядка.
Также было отмечено, что общее количество микроорганизмов, выделяемых из просвета толстой кишки «больных» людей, на два порядка ниже, чем у «здоровых». В пожилом и старческом возрасте таких различий не обнаруживается (группа 60 лет и более) (рис. 2).
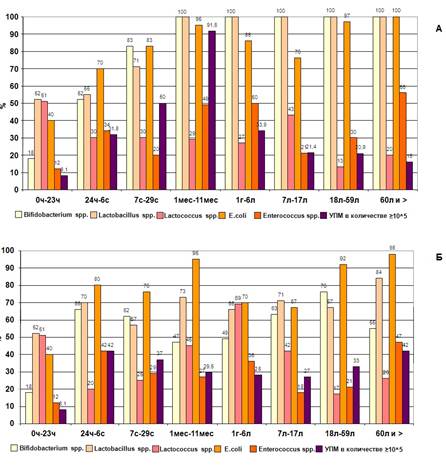
Рис. 2. Частота выделения представителей кишечной микрофлоры и УПМ из кишечника «здоровых» (А) и «больных» (Б) людей разных возрастных групп
Проанализировав данные о частоте встречаемости отдельных представителей микробиоценоза просвета толстой кишки в микрофлоре «здоровых» людей различных возрастных групп, следует отметить, что в 94% дети рождаются с бактериальной флорой ЖКТ, причем в первые 24 часа жизни преобладающей флорой являются микроаэрофильные микроорганизмы родов Lactobacillus и Lactococcus, а также факультативно-анаэробные микроорганизмы родов Staphylococcus и Escherichia. Условно-патогенные микроорганизмы уже присутствуют в микрофлоре здоровых новорожденных в 8,1% случаев. Далее во время пребывания в родильном доме (1-7 сутки) и в домашних условиях (от 7 суток до 1 года) происходит нарастание количества как лакто-, лактококков и бифидобактерий, так и E.coli, энтерококков, УПМ. Установлено, что с наибольшей частотой – в 92% случаев – УПМ в значимых количествах выделяются в группе здоровых детей в возрасте от 1 месяца до 1 года. Высокий уровень обсемененности условно-патогенной флорой можно объяснить тем, что этот период жизни ребенка отмечен самыми активными изменениями в структуре питания, развития организма и др. До года проходят все четыре стадии сукцессии: первая стадия - грудное вскармливание, вторая стадия - начало дачи прикорма, третья стадия - начало дачи твердой пищи, четвертая - отмена грудного вскармливания. В данном конкретном случае под сукцессией понимается изменение качественного и количественного состава микроорганизмов у детей в соответствии с изменениями факторов внешней среды: питания, режима, развития организма и др. и функционального состояния иммунной системы. Частота обнаружения УПМ в микрофлоре толстой кишки здорового человека начинает снижаться после первого года жизни и составляет 21,4% в возрастной группе 7-17 лет.
Проанализировав данные о частоте встречаемости отдельных представителей микробиоценоза просвета толстой кишки в микрофлоре «больных» людей различных возрастных групп, следует отметить, что у детей в возрасте до 1 года наблюдается резкое снижение частоты выделения представителей анаэробной части флоры (лактобацилл и бифидобактерий), а также условно-патогенных видов в значимых количествах (105 КОЕ/г и более) по сравнению с детьми из подгруппы «здоровых». Особенно это заметно в возрастных группах 7 с. – 29 с. и 1 мес. – 11 мес. (37 и 50%, 29,5 и 91,6% соответственно). В более старших возрастных группах частота обнаружения УПМ в группе «больных» достоверно выше, чем у «здоровых», частота выделения анаэробов снижена.
В ассоциациях УПМ выделялись чаще у «больных» детей, чем у «здоровых», во всех возрастных группах, кроме группы детей от 1 месяца до 1 года (рис. 3).
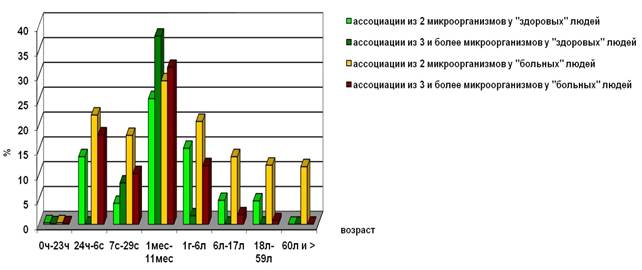
Рис. 3. Частота обнаружения ассоциаций УПМ у «здоровых» и «больных» людей разного возраста
Полученные результаты можно объяснить с точки зрения процесса формирования местной толерантности к резидентной микрофлоре и существующей теорией эндогенного инфицирования, описанных в трудах зарубежных и отечественных ученых, когда своя микрофлора воспринимаются организмом человека как чужеродная. В связи с этим возникновение патологического процесса можно объяснить не количеством выделяемых УПМ, а их измененными свойствами и подавлением лакто- и бифидобактерий [2].
Ввиду того что бактерии рода Lactobacillus и Bifidobacterium являются симбионтами кишечника человека с периода новорожденности, для восстановления нарушенной микроэкологии и иммунных реакций целесообразно использовать пробиотические препараты, содержащие именно этих представителей микрофлоры.
В настоящее время на рынке представлены как пробиотики в лиофильно высушенном виде, так и препараты в жидкой форме. Препараты в сухой форме имеют ряд положительных черт, например длительный срок годности, удобство хранения и реализации. Но процесс лиофилизации бактерий оказывает негативное влияние на структуру их поверхностных белков, активность адгезии, а также приводит к разрушению ценных бактериальных метаболитов. В сухих препаратах бактерии находятся в неактивном состоянии, для восстановления свойств необходим период времени от 8 до 10 часов, в то время как у младенцев и детей раннего возраста процесс пищеварения занимает 4-6 часов. Жидкая форма пробиотиков, напротив, способствует реализации положительных свойств штаммов-продуцентов в полной мере, так как бактерии находятся в активном физиологическом состоянии и способны эффективно колонизировать слизистую кишечника. Кроме того, в жидкой среде сохраняются все бактериальные метаболиты [3].
Основной недостаток жидких форм – короткий срок хранения, необходимость учета вкусовых характеристик и относительное неудобство применения. Тем не менее их преимущества вполне компенсируют перечисленные недостатки. На сегодняшний день на рынке представлено достаточное количество пробиотиков в жидкой форме: «Наринэ» (Армения), «Биовестин-лакто» (Россия, Новосибирск), «Нормофлорин Л» (Россия, Москва) и др.
В Нижегородском НИИЭМ им. академика И.Н Блохиной Роспотребнадзора разработана линия жидких пробиотиков «LB-комплекс». Это бактериальные концентраты, содержащие симбиотические штаммы лактобацилл видов L. plantarum, L. fermentum (пробиотик «LL-комплекс»), а также лактобацилл L. plantarum, L. fermentum и бифидобактерий видов B. bifidum, B. longum («LB-комплекс»). В качестве основы пробиотиков использован гидролизат молока, представляющий собой гипоаллергенный раствор аминокислот и простейших пептидов. Штаммы лактобацилл, входящие в состав БАД, обладают высоким уровнем β–галактозидазной активности, что позволяет использовать пробиотики при лактазной недостаточности. Штаммы-продуценты образуют устойчивую систему, обладающую высоким уровнем антагонистической активности по отношению к патогенным и условно-патогенным микроорганизмам и высоким уровнем антибиотикорезистентности не трансмиссивного типа. В 1 мл пробиотиков содержится 109-1011 КОЕ/мл живых микробных клеток. Штаммы, входящие в их состав, всесторонне изучены и отвечают требованиям, регламентированным современными нормативными документами - МУК 4.2.2602.-10.4.2. и МУ 2.3.2.2789-10 [9].
Пробиотики группы «LB-комплекс» использовались в 22 лечебно-профилактических учреждениях в качестве пробиотической составляющей диетотерапии в программах комплексного лечения больных с различными нозологическими формами заболеваний, осложненных дисбиозом.
Пробиотик был использован в качестве диетотерапии в комплексном лечении акушерской и сопутствующей патологии 30 женщин (гестационный срок 28-30 недель), находящихся на стационарном лечении в отделении патологии беременных. Группу сравнения составили 30 женщин, получавших базовую терапию и плацебо. Основная группа и группа сравнения были сопоставимы по возрасту и форме патологии (акушерско-гинекологические нарушения в сочетании с сопутствующей патологией и дисбиозом кишечника и влагалища).
Эффективность включения «LB-комплекса» в диетотерапию беременных для профилактики формирования ранних дисбиотических состояний у новорожденных
|
Показатели |
Частота выявления признака, % |
||
|
Основная группа |
Группа сравнения |
||
|
женщины |
Слабая родовая деятельность |
8,4% |
18,3% |
|
Инфицирование околоплодных вод |
0% |
12,6% |
|
|
Инфекция в родах |
7,1% |
17,8% |
|
|
новорожденные |
Гнойный конъюнктивит новорожденных |
0% |
11% |
|
Клинические признаки ВУИ |
0% |
11% |
|
|
Апгар 8-9 |
92% |
73% |
|
|
Апгар 7 |
8% |
27% |
|
|
Выписка из роддома клинически здоровыми |
76% |
54% |
|
Установлено, что у родильниц основной группы отмечается более гладкое течение родов и послеродового периода, в то время как в группе сравнения слабость родовой деятельности наблюдалась в 18,3% случаев (в основной – в 8,4%); инфицирование околоплодных вод – в 12,6% случаев было только у рожениц этой группы. Также в группе сравнения в 2,5 раза чаще наблюдали инфекцию в родах и раннем послеродовом периоде (7,1% и 17,8% соответственно). Новорожденных наблюдали с момента рождения и в раннем неонатальном периоде. У 11% детей группы сравнения был диагностирован конъюнктивит, наблюдалась клиника внутриутробной инфекции (ВУИ). Клинически здоровыми из роддома вышли 76% новорожденных основной группы и только 54% из группы сравнения (таблица).
Таким образом, включение пробиотика «LB-комплекс» в диетотерапию при комплексной терапии акушерской патологии улучшает показатели здоровья матери и ребенка.
В отделении патологии новорожденных и недоношенных детей детской городской клинической больницы № 27 «Айболит» г. Нижнего Новгорода в течение 10 лет «LB-комплекс» включен в программу комплексного лечения и выхаживания недоношенных новорожденных (всего пробиотик получили 3 574 ребенка).
Ранее нами были проведены исследования, показывающие эффективность использования пробиотика: «LB-комплекс» получали дети, поступающие в отделение (30 детей) в течение всего срока пребывания в стационаре (от 20 до 45 дней). Для оценки эффективности была выделена группа сравнения, получавшая плацебо (30 детей).
У всех детей на момент поступления имелись нарушения процесса формирования микробиоты II и III степени. Микрофлора характеризовалась отсутствием или сниженным содержанием анаэробного компонента на фоне значительного обсеменения условно-патогенными микроорганизмами. После курса лечения пробиотиком в основной группе ни у одного ребенка не было выявлено нарушений формирования микрофлоры III степени, в то время как в группе сравнения у части детей продолжали выявляться выраженные нарушения в микробном пейзаже (рис. 4).
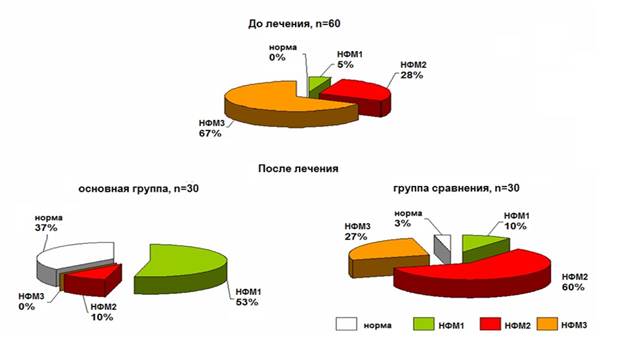
Рис. 4. Состояние микрофлоры кишечника недоношенных новорожденных при поступлении и после курса лечения: базовая терапия с плацебо и базовая терапия с пробиотиком «LB-комплекс»
У детей основной группы после лечения титр лакто- и бифидобактерий составил 108 – 1011 КОЕ/мл, в то время как в группе сравнения наблюдается их выраженное снижение (рис. 5).
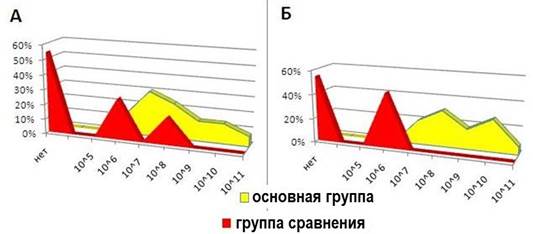
Рис. 5. Количество бифидобактерий (А) и лактобацилл (Б) после курса лечения в основной группе и группе сравнения
Опыт использования «LB-комплекса» в отделении патологии новорожденных и недоношенных детей показал его выраженную клиническую эффективность: улучшалось общее состояние детей, повышалась двигательная активность, ежесуточная прибавка массы тела возросла с 10,0-20,0 до 30,0-40,0 г. За период введения пробиотика в комплексную терапию в отделении в два раза снизилось количество детей с гнойно-септическими проявлениями (конъюнктивит, пиодермия, отит), ни у одного ребенка не наблюдали диарейный синдром.
В последние годы в педиатрической практике увеличилась частота дисбиозов с избыточным ростом грибов рода Candida, причем у 10,4% больных выявляются признаки микогенной сенсибилизации. Реализация патологического процесса при неинвазивном кандидозе кишечника происходит за счет интенсивного размножения Candida spp. в просвете пищеварительной трубки, при этом индуцируется ступенчатое углубление дефицита облигатной микробиоты и присоединение микст-инфекции (при этом угнетается анаэробная флора на фоне выделения ассоциации УПМ). В гастроэнтерологическом отделении этого же стационара пробиотик был включен в диетотерапию при комплексном лечении детей с гастроэнтерологической патологией и атопическими дерматитами. Поскольку у 77,3% детей был выявлен дисбиоз, ассоциированный с C. albicans, в алгоритм лечения детей с данной патологией был включен авторский препарат «LL-комплекс» с антимикотической активностью. Были выделены: основная группа - 33 ребенка на фоне базовой терапии, получавшие «LL-комплекс» по 5 мл в сутки, и группа сравнения - 33 человека, на фоне базовой терапии получавших плацебо.
Необходимо отметить, что в данном случае часто встречались ассоциации грибов рода Candida с представителями семейства Enterobacteriaceae, Staphilococcaceae, Pseudomonadaceae, Bacillaceae (Clostridium spp.).
В результате проведенного исследования установлено, что после курса лечения в основной группе в 4,2 раза снизилась частота выделения C. albicans - с 77,3% (в количестве более 104 КОЕ/мл) до 54,5% (в количествах 102 и менее КОЕ/мл), тогда как в группе сравнения частота выделения грибов осталась на том же уровне (рис. 6).
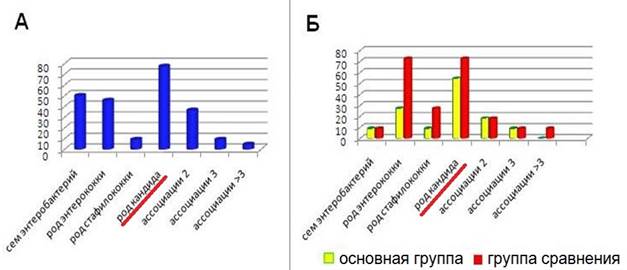
Рис. 6. Частота выделения УПМ до лечения (А) и после курса проведенного лечения в основной и контрольной группах (Б)
Количество лакто- и бифидобактерий в основной группе по сравнению с контрольной значительно выросло (рис. 7).
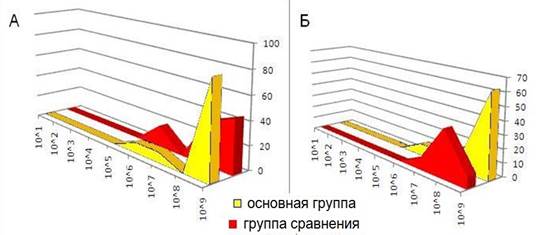
Рис. 7. Количество бифидобактерий (А) и лактобацилл (Б) после курса лечения
Таким образом, в ходе работы подтверждена эффективность включения пробиотика «LL-комплекс» в алгоритм лечения детей с дисбиозами, ассоцированными с C. albicans.
Таким образом, в ходе работы установлены закономерности формирования микробиоты кишечника детей в онтогенезе. Показано, что в 94% дети рождаются с бактериальной флорой ЖКТ, причем в первые 24 часа жизни преобладающей флорой являются микроаэрофильные микроорганизмы родов Lactobacillus и Lactococcus, а также факультативно-анаэробные микроорганизмы родов Staphylococcus и Escherichia. Условно-патогенные микроорганизмы уже присутствуют в микрофлоре здоровых новорожденных в 8,1% случаев. Далее во время пребывания в родильном доме (1-7-е сутки) и в домашних условиях (от 7 суток до 1 года) происходит нарастание количества как лакто-, лактококков и бифидобактерий, так и E. coli, энтерококков, УПМ. Установлено, что с наибольшей частотой – в 92% случаев – УПМ в значимых количествах выделяются в группе здоровых детей в возрасте от 1 месяца до 1 года.
В результате проведенных исследований доказано, что наиболее рациональной и эффективной профилактикой нарушений формирования микрофлоры у новорожденных является своевременная профилактика и лечение дисбиоза влагалища и кишечника у женщин в период беременности.
Полученные результаты доказывают эффективность применения пробиотиков группы «LB-комплекс» в качестве средств коррекции дисбиоза кишечника.
Необходимо отметить важность грамотного включения пробиотиков в комплекс базовой терапии в качестве пробиотической составляющей диеты с учетом фармакокинетики применяющихся препаратов. Необходимо назначать пробиотики в промежутке между приемом антибактериальных средств и других химиопрепаратов, причем разница по времени должна быть не менее 2 часов.



