Асептический некроз головки бедренной кости (АНГБК) – тяжелое дегенеративно-дистрофическое заболевание, характеризующееся нарушением процессов остеогенеза и резорбции, нарушением кровоснабжения и постепенной деформацией головки бедренной кости в местах приложения на нее наибольшей нагрузки, чаще всего – в верхненаружнем сегменте головки бедренной кости. Также АНГБК называют аваскулярным некрозом, A vascular necrosis of femoral head (ANFHN), A vascular necrosis (AVN). Остеонекроз головки бедренной кости впервые был описан в 1738 г. Munro. В 1835 г. Cruveilhier описал морфологические изменения в бедренной кости, связанные с нарушением кровоснабжения головки бедренной кости. Термин «асептический некроз» предложен Axhausen в 1907 г. В нашей стране первые сообщения об АНГБК у взрослых были опубликованы в 1950 г. В.Я. Фридкиным и И.Н. Лагуновой.
Асептический некроз головки бедренной кости относится к числу тяжелых дегенеративно-дистрофических заболеваний, имеющих медико-социальное значение, и составляет 1,5–4,7 % от всей ортопедической патологии. По данным отечественных и зарубежных исследователей, чаще всего данной патологией страдают молодые мужчины от 30 до 50 лет (соотношение мужчин и женщин, пораженных данным заболеванием, составляет 8:1) трудоспособного возраста (средний возраст заболевания в среднем 38 лет) [1, 2,3]. Данное заболевание приводит к коллапсу головки бедренной кости в течение 2–4 лет [4]. Асептический некроз головки бедренной кости является причиной инвалидизации у 7 % от всего числа ортопедических больных с нарушением функции нижних конечностей. В нашей стране распространенность данного заболевания, к сожалению, на данный момент недостаточно изучена. По данным зарубежных авторов, частота выявляемости в США составляет 10000–20000 новых случаев в год. Согласно зарубежным данным, в США от 5 до 18 % первичного тотального эндопротезирования проводится по поводу асептического некроза головки бедренной кости [5,6]. Асептический некроз головки бедренной кости является полиэтиологическм заболеванием. Причиной нарушения кровоснабжения головки могут быть травмы, причем необязательно переломы проксимального отдела бедренной кости, зачастую причиной может стать гемартроз тазобедренного сустава [7]. Провоцируют развитие АНГБК также перенесенные воспалительные, системные заболевания, такие, как серповидноклеточная анемия, системная красная волчанка, коагулопатии – тромбофилия, синдром диссеминированного сосудистого свертывания, ВИЧ – инфекция, жировая эмболия и прочее. Факторами, провоцирующими развитие аваскулярного некроза, по данным отечественных и зарубежных исследований, чаще всего выступают злоупотребление алкоголем, длительный прием кортикостероидных препаратов.
Физикальное обследование на ранних стадиях малоинформативное, так как не выявляется выраженных изменений ортопедического статуса. Методы лабораторной диагностики также не являются достоверными, по уровню кальция крови и мочи возможно определение течения процесса гомеостаза кальция. Косвенными признаками развития асептического некроза могут служить маркеры резорбции в крови и моче. Наиболее часто используемыми маркерами костной резорбции являются дезоксипиридинолин (ДПИД) и С-концевой телопептид коллагена костного матрикса (СТХ). Рентгенологическая картина ранних стадий АНГБК малоинформативна. При появлении болей и отсутствии рентгенологической картины, обязательным методом обследования становится МРТ.
Согласно исследованиям Montet.al. 85,4 % авторов пользуются всего четырьмя классификациями [8]. В азиатско-тихоокеанском регионе наиболее распространена классификация China-Japan Friendship Hospital classification. Данная классификация основана на локализации очага остеонекроза, исходя из концепции трех опорных колонн головки бедренной кости – медиальной, центральной и латеральной (рис. 1).
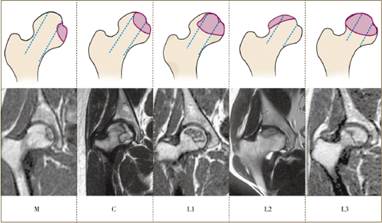
Рис. 1. Классификация China-Japan Friendship Hospital
В нашей стране чаще всего используют систему Ficat and Arlet (1980) – таблица 1 – и классификацию ARCO (1993) – таблица 2.
Таблица 1
Классификация Ficat и Arlet (1980)
|
Стадия |
Рентгенологические изменения |
|
1 |
Нет изменений |
|
2 |
Диффузный склероз, кисты |
|
3 |
Субхондральная импресионная деформация головки бедренной кости |
|
4 |
Коллапс головки, изменения в вертлужной впадине |
Таблица 2
Классификация ARCO (Association Research Circulation Osseuos)
|
Стадия |
Изменения |
Метод диагностики |
Локализация поражения |
Объем поражения |
|
0 |
Нет |
Rg, КТ, МРТ, сцинтиография |
Нет |
нет |
|
I |
Изменения только на МРТ и сцинтиографии |
МРТ, сцинтиография |
Медиальная Центральная Латеральная |
Также как в Steinberg |
|
II |
Сочетание остеосклероза и остеопороза |
Rg, КТ, МРТ, сцинтиография |
Медиальная Центральная Латеральная |
Так же как в Steinberg |
|
III |
Коллапс головки |
Rg, КТ |
Медиальная Центральная Латеральная |
Так же как в Steinberg |
|
IV |
Коксартроз, изменения в ацетабулярной впадине |
Rg |
Нет |
Нет |
Несмотря на достаточное большое количество публикаций, посвященных диагностике, лечению и профилактике АНГБК, не существует единого реестра распространенности данного заболевания в РФ и странах СНГ, а также нет единой концепции хирургического лечения данной патологии, особенно на ранних стадиях развития заболевания.
Цель исследования – провести анализ литературы, посвященной хирургическим методам лечения ранних стадий асептического некроза головки бедренной кости.
Материал и методы. Проведен поиск в PubMed, MedLine, базе Cohrane, материалах издательства Elsevier и в отечественных журналах по травматологии и ортопедии, рекомендованных ВАК. Глубина поиска составила 30 лет. Всего публикаций с упоминанием терминов АНГБК, AVN, AVNFH найдено 3715. Публикаций, посвященных хирургическому лечению асептического некроза головки бедренной кости, выявлено 464, из них в последние 15 лет – 254. 64 публикации были окончательно отобраны для анализа – это систематические обзоры, метаанализы, оригинальные работы, клинические исследования. При анализе публикаций выявлено, что большая часть публикаций издана до середины 90-х годов двадцатого века, либо – в середине нулевых двадцать первого. Такое распределение по датам публикаций связано с тем, что в определенный период развития современной травматологии и ортопедии превалировало мнение, что тотальное и однополюсное эндопротезирование тазобедренного сустава является методом выбора при АНГБК. Однако по мере накопления опыта эндопротезирования исследователи заметили, что данный метод сопряжен с большим количеством рисков, таких, как постгеморрагическая анемия, тромбоэмболические осложнения, септические осложнения различной степени тяжести, парапротезные переломы, вывихи и нестабильность компонентов эндопротеза. Общее количество осложнений при тотальном эндопротезировании составляет до 42и% [9]. Кроме того, АНГБК поражает преимущественно людей молодого возраста, а в возрасте моложе 50 лет через 10 месяцев после имплантации сохраняется не более 80 % искусственных суставов. Проведению ревизионных вмешательств через 20 лет подвергается 50 % и более [10].
Таким образом, все большее внимание отечественных и зарубежных исследователей направлено на поиск и усовершенствование органосохраняющих методов хирургического лечения.
Хирургическое лечение ранних стадий АНГБК, то есть стадий, предшествующих коллапсу головки, можно разделить на декомпрессивные, костно-пластичекие, а также на комбинированные.
К декомпрессивным операциям относят открытую и транскутанную остеоперфорацию головки бедренной кости сверлом большого диаметра (8–10 мм) или множественную остеоперфорацию спицами Киршнера и различными пинами. Достоинством данной методики является ее техническая простота, минимальная затратность и малотравматичность. В исследовании Montet.al. получено 71 % успешных результатов на протяжении 2 лет наблюдения. Осложнений, связанных с хирургическим вмешательством, выявлено не было ни в одном случае. К недостаткам остеоперфорации можно отнести ослабление головки и диафиза бедренной кости и риск их послеоперационных переломов, в случае, если остеоперфорация и декомпрессия осуществляется с помощью сверла диаметром 9 мм. При использовании остеоперфорации спицами или пинами сохраняется риск недостаточного вскрытия очага остеонекроза, либо проведения спиц мимо очага – 3,1 % по данным Р.М. Тихилова [11].
Важными моментами проведения данного вмешательства являются размер и локализация участка остеонекроза: декомпрессивная остеоперфорация эффективна на стадиях I–II по классификации ARCO, если область некроза медиальна, центральна или занимает менее 30 % головки бедренной кости. В исследовании ShahS была оценена эффективность проведения декомпрессионных операций на различных стадиях развития – на I стадии она составила 93,3 %, на IIa – 100 %, на IIв стадии – только 50 % [12]. Использование декомпрессивных остеоперфоративных вмешательств возможно использовать в качестве вспомогательного метода при проведении костно-пластических методов и корригирующих остеотомий, и позволяет улучшить результаты лечения [13-16].
К костно-пластическим методам можно отнести способы свободной и несвободной остеопластики. Возможно использование как кортикальных, так и губчатых трансплантатов. Кортикальные трансплантаты (чаще всего из малоберцовой кости) позволяют создать лучшую механическую опору, а губчатые (из гребня подвздошной кости) создают наиболее благоприятные условия для ремоделирования костной ткани. Однако использование только свободных трансплантатов не обеспечивает дополнительное кровоснабжение головки бедренной кости. Возможно использование как костных ауто-, аллотрансплантатов, так и использование биокомпозитных и металлических трансплантатов. Впервые о применении пористых танталовых стержней в качестве трансплантата ГБК сообщил Schnieders et al. в 1997 г. В дальнейших исследованиях зарубежные авторы указывают на то, что использование танталовых стержней является малоинвазивным, технически простым методом, позволяющим остановить прогрессирование асептического некроза и сохранить плотность головки бедренной кости и ее устойчивость к нагрузке. Однако использование биокомпозитных и металлических трансплантатов создает трудности для дальнейших возможных оперативных вмешательств, а танталовые импланты в настоящее время не рекомендованы к применению, так как в литературе нет достаточных указаний на эффективность [17].
Использование костно-пластических методов позволяет сохранить геометрию головки бедренной кости, в отличие от корригирующих остеотомий и эндопротезирования. По данным отечественных исследователей, характер материала, используемого для костной пластики, не влияет на частоту развития коксартроза, в отличие от полноты заполнения очага. Так, по данным Р.М. Тихилова, при заполнении очага на 50 % функциональные результаты хуже на 7,7 баллов по шкале Oxford Hip Score, чем при заполнении очага на 90 % [11]. Yu и соавторы провели исследование, проводя остеопластику с использованием синтетической аллокости (фосфат кальция) только на поздних стадиях развития АНГБК, в результате в 89,5 % пациентам через 24 месяца после операции потребовалось проведение тотального эндопротезирования тазобедренного сустава [18].
Использование несвободных аутотрансплантатов подразумевает реваскуляризацию головки бедренной кости с помощью питающей мышечно-сосудистой ножки. Возможны следующие варианты реваскуляризирующей остеопластики: трансплантат выкраивается из вертела бедренной кости [19] или из гребня подвздошной кости [11] и прочее. Мышечная питающая ножка выкраивается из средней ягодичной, портняжной мышц. Vaishyaet.al. в 2016 г. представили результаты несвободной реваскуляризирующей остеопластики с забором трансплантата из передне-верхней ости подвздошной кости на питающей мышечной ножке из m.Sartorius – среднее время операции составило 85 минут (от 55 до 130 минут), было получено 33,96 % отличных, 45,28 % хороших, 17 % удовлетворительных и 3,7 % неудовлетворительных результатов. Авторы получили прогрессирование асептического некроза у 2 пациентов, инфекционных осложнений не было выявлено ни в одном случае.
Достоинством данного способа является осуществление вскрытия, остеопластики, реваскуляризации очага остеонекроза без потери костной массы. Однако существенным недостатком является травматичность методики, ее хирургическая сложность, что не позволяет использовать этот метод в качестве рутинного. Данный способ показан при IIb-IIIA стадиях развития АНГБК.
В отечественной литературе встречаются различные способы костной аутопластики, однако, на данный момент не опубликовано рандомизированных проспективных исследований с большой выборкой [20].
При использовании декомпрессии и неваскуляризированной костной аутоостеопластики, по данным Федорова В.Г., получено 50 % хороших результатов, удалось замедлить прогрессирование АНГБК в течение 3 лет после оперативного вмешательства [21].
При анализе зарубежной литературы встречаются различные сравнительные исследования методов остеопластики. Aliet. al. сравнили 15 исследований, посвященных методикам васкуляризированных и неваскуляризированных костных аутопластик. Три исследования доказывали несомненное преимущество васкуляризированной пластики, два – сравнивали с декомпрессией. Получили результат, что васкуляризированная пластика статистически лучше, чем неваскуляризированная [22]. Зарубежными исследователями доказано, что лечение асептического некроза на ранних стадиях с помощью васкуляризированной аутоостеопластики экономически эффективнее, чем тотальное эндопротезирование, так как пациенты после аутоостеопластики возвращаются к труду в три раза быстрее [23].
К хирургическим методам лечения также относят различные виды корригирующих остеотомий. Основной задачей при проведении этих вмешательств является разгрузка пораженной части сустава путем выведения ее из зоны нагрузки, а также снижение внутрикостного давления. Корригирующие остеотомии различают на межвертельные угловые (варизирующие, вальгизируюшие), чрезвертельные, ротационные. При выборе метода корригирующей остеотомии необходимо учитывать этнические особенности – так, людям монголоидной расы благоприятнее проводить ротационную остеотомию, поскольку анатомически у них задняя часть капсулы тазобедренного сустава более рыхлая, что позволяет лучше ротировать переднюю часть головки бедренной кости. У уроженцев Кавказа диаметрально противоположная ситуация, которая требует проведения межвертельной угловой остеотомии [23]. Существенным недостатком методов корригирующих остеотомий является возможность развития последующей деформации, несращения зоны остеотомии и развития вторичного остеонекроза, в случае некорректной или недостаточной фиксации. Также использование корригирующих остеотомий осложняет дальнейшие возможные хирургические вмешательства, особенно – эндопротезирование. Использование остеотомий показано у пациентов молодого возраста (младше 45 лет), которым не проводилось длительного лечения стероидными препаратами, с незначительными проявлениями остеоартроза, и без вовлечения в некротический процесс вертлужной впадины. Вследствие узких показаний и большого количества возможных осложнений (риск развития ложного сустава, септических, тромбоэмболических осложнений), в настоящее время изолированно корригирующие остеотомии широко не используются [24,25].
Результаты и обсуждение. На основании полученных из литературных источников данных нами была составлена сравнительная таблица различных методов, показаний к их применению, а также возможные осложнения при лечении ранних стадий АНГБК (табл. 3).
Таблица 3
Сравнительная таблица различных методов лечения АНГБК, показаний к их применению, а также возможные осложнения
|
Способ лечения |
Вид вмешательства |
Критерии |
Достоинства |
Недостатки |
|
Декомпрессивные операции |
Рассверливание |
1. Стадия развития остеонекроза II по Ficatand Arlet 2. Невыраженный периодический болевой синдром |
1. Снижение внутрикостного давления 2. Снижение болевого синдрома 3. Стимуляция остеогенеза и роста новых сосудов 4. Малоинвазивность 5. Доступность широкому кругу хирургов |
1.Потеря костного вещества 2. Риск последующего перелома |
|
Остеоперфорация |
Стадия развития некроза до III по Ficat and Arlet |
|||
|
Костно-пластические методы лечения |
Свободная неваскуляризированная остеопластика |
Стадия развития некроза II–III по Ficat and Arlet |
1. Снижение болевого синдрома 2. Восстановление плотности костной ткани |
1. Риск инфекционных осложнений 2. Сложность хирургического вмешательства |
|
Реваскуляризированная остеопластика на питающей мышечной ножке |
Стадия развития некроза I–III по Ficat and Arlet |
1. Снижение болевого синдрома 2. Восстановление плотности костной ткани 3. Стимуляция остеогенеза и роста новых сосудов |
||
|
Остеопластика металлическими, биокомпозитными трансплантатами |
Стадия развития некроза II–III по Ficat and Arlet |
1. Восстановление плотности костной ткани 2. Снижение болевого синдрома |
1. Риск повторного коллапса 2. Риск инфицирования 3. Риск смещения металлического импланта, деформации и переломов 4. Проблематичность последующих хирургических вмешательств 5. Отсутствие стимуляции остеогенеза и роста новых сосудов |
|
|
Корригирующие остеотомии |
Чрезвертельные ротационные остеотомии Межвертельные угловые остеотомии |
Стадия развития некроза II–III по Ficat and Arlet Малая область некроза Выраженный болевой синдром Отсутствие приема кортикостероидов в анамнезе Молодой возраст пациентов (младше 45 лет) |
1. Изменение зоны нагрузки 2. Снижение внутрикостного давления 3. Снижение болевого синдрома |
1. Необходимость индивидуального подхода с учетом этнических и возрастных особенностей 2. Риск повторного коллапса 3. Риск инфицирования 4. Риск смещения металлического импланта, деформации и переломов 5. Проблематичность последующих хирургических вмешательств 6. Сложность хирургического вмешательства |
Заключение. На основании анализа зарубежной и отечественной литературы, посвященной хирургическому лечению асептического некроза головки бедренной кости можно сделать некоторые заключения.
- Все методы лечения, используемые в настоящее время, направлены на механическую поддержку предотвращения коллапса головки, и улучшение скорости и качества восстановления структуры кости, повышение апоптоза остеокластов, и угнетение апоптоза остеобластов и остеоцитов.
- Оперативное органосохраняющее лечение показано при стадиях ARCOI-III.
- На данный момент не существует общепринятого научно доказанного метода, превосходящего все остальные.
- Использование декомпрессивных оперативных вмешательств позволяет снизить болевой синдром без изменения рентгенологической картины.
- Корригирующие остеотомии и реваскуляризированные несвободные костно-мышечные пластики технически сложны и их применение рассматривается индивидуально для каждого пациента.
- На стадиях IIIс и тяжелее методом выбора является тотальное эндопротезирование.
Таким образом, органосохраняющие оперативные вмешательства являются эффективными методами лечения ранних стадий асептического некроза головки бедренной кости, однако каждый метод имеет свои показания, достоинства и недостатки. На данный момент не существует единого мнения и концепции об алгоритме лечения, поэтому необходимо проведение проспективных рандомизированных исследований, сравнивающих эффективность различных методов лечения.



