Современная вакцинопрофилактика ориентирована на создание субъединичных вакцин на основе рекомбинатных и химически очищенных высокоиммуногенных протективных антигенов. Особо актуальными являются разработки высокоэффективных препаратов специфической профилактики против особо опасных инфекций и социально значимых заболеваний, вызываемых внутриклеточными патогенами. Трудности формирования иммунитета к данной группе заболеваний связаны с особенностями взаимодействия микроба с клетками организма хозяина, что препятствует образованию адекватного стойкого клеточного и гуморального иммунного ответа.
Для стимуляции иммунного ответа в настоящее время предложена группа адьювантов - неспецифических стимуляторов иммунитета, применение которых в составе субъединичных вакцин позволяет значительно усилить гуморальный и клеточный ответ, а также снизить антигенную нагрузку на макроорганизм. Однако большинство классических адъювантов, демонстрирующих значительное усиление клеточного и гуморального звеньев иммунитета при иммунизации биомоделей, не могут быть использованы для человека ввиду токсичности компонентов, входящих в их состав. Синтезированный российскими учеными препарат полиоксидоний, производное полиэтиленпиперазина [5], демонстрирует хорошие иммуномодулирующие свойства и на протяжении многих лет используется при лечении острых и хронических заболеваний, сопровождающихся снижением иммунитета, таких как сахарный диабет, ожоговая болезнь, детские патологии с иммуносупрессией [1-3; 5]. Важно отметить, что полиоксидоний (ПО) был одобрен и включен в качестве адъюванта в состав противогриппозной вакцины «Гриппол» Российского производства [4; 7].
Таким образом, ПО представляется перспективным кандидатом как иммуномодулятор для создания субъединичных вакцинных препаратов на основе бактериальных антигенов.
Целью настоящей работы было изучение способности ПО стимулировать выработку специфических антител к антигенам внутриклеточных патогенов, возбудителей хламидиоза и чумы, в сравнении с другими известными современными иммуностимуляторами - адъювантом Фрейнда (ПАФ) и TiterMax (ТМС).
Материалы и методы
В работе были использованы высокоочищенные рекомбинатные антигены Pla, LcrV и YopM чумного микроба, эксперессированные в E. coli [8], а также химически очищенный специфический антиген Chlamydia trachomatis гликопептидной природы - С-аг, охарактеризованный ранее [6].
Указанные антигены в концентрациях 5-10 мкг/особь применяли для четырехкратной иммунизации отдельных групп (n=3) мышей BALB/c (ГУ НЦБМТ РАМН, лицензированный питомник филиала «Андреевка», Солнечногорский р-н, п. Андреевка) возрастом 6-8 недель по трем схемам: короткой (А), средней (В) и длинной (С). Каждую группу разделили на подгруппы в зависимости от иммуностимуляторов, использованных при первой иммунизации - ПО (НПО «Петровакс Фарм», Россия), ТМС (Sigma, США) или ПАФ (Sigma, США). Адъюванты смешивали в равных объемах (1:1) с каждым из антигенов и вводили внутрибрюшинно. Все последующие инъекции антигенов проводили без адъювантов, за исключением группы животных, иммунизированных с ПАФ, - данную группу при второй иммунизации обрабатывали неполным адъювантом Фрейнда (НАФ). Временные интервалы между введением антигенов составляли 3 дня (схема А), 14 дней (схема В) и 21 день (схема С) (Федорова В.А., 2004).
Титры специфических антител в крови иммунизированных животных определяли на четвертый день после последней иммунизации в непрямом твердофазном иммуноферментном анализе (ТИФА). Сенситины в фосфатно-солевом буфере в концентрации 1-10 мкг/мл сорбировали на 96-луночный планшет («Медполимер», Россия). Для проявления реакции использовали конъюгат антимышиных иммуноглобулинов с пероксидазой хрена («Медгамал», Россия). В качестве хромогенного субстрата служил ABTS - 2,2`-azinobis (3-ethilbenzthiazoline sulfonisacid) (Sigma, США), результаты учитывали на ИФА-ридере StatFax 2100 (Awareness Technology, США) при длине волны 405 нм, с использованием отсекающего фильтра на 630 нм. Титр специфических антител определяли как превышающий в 2 раза значение оптической плотности в контрольных лунках ряда.
Результаты и обсуждение
На первом этапе исследования проводили сравнение эффективности использования ПО и ПАФ для стимуляции гуморального иммунного ответа к С-аг у мышей в зависимости от схемы иммунизации. В нашем эксперименте показано, что наибольшие титры антител были получены при иммунизации животных по короткой схеме (A). При этом титры антихламидийных антител в группе мышей, обработанных ПО, в 8-16 раз превышали таковые в группе животных, обработанных С-аг совместно с ПАФ. При использовании средней схемы (В) для иммунизации биомоделей титры анти-С-аг-антител у них были ниже, чем у животных, обработанных по схеме А, однако в группе, обработанной С-аг с ПО, титры антител превышали таковые в группе ПАФ в 4-5 раз. При сравнении результатов, полученных в группе животных, иммунизированных по длинной схеме (С), не было обнаружено значимых отличий в титрах антител, полученных с помощью ПО и ПАФ (рис. 1).
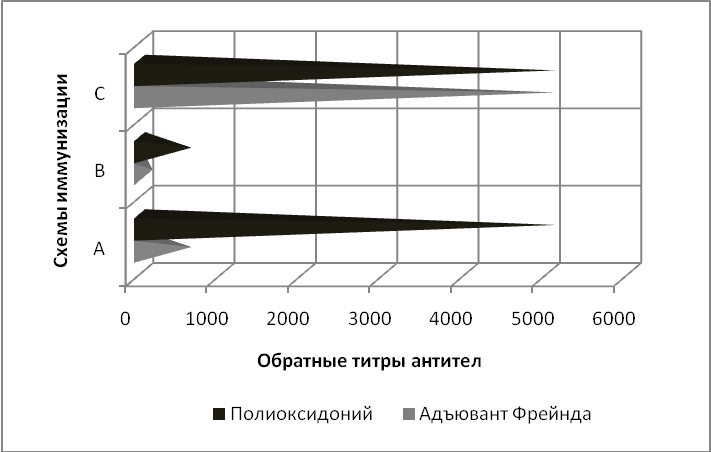
Рис. 1. Сравнительные титры антител к C-аг у мышей BALB/c, иммунизированных по короткой (A), средней (В) и длинной (С) схемам иммунизации.
На следующем этапе проводили сравнение титров антител к одному из рекомбинатных антигенов чумного микроба - Pla у животных, иммунизированных по схеме A с использованием трех адъювантов (табл. 1).
Таблица 1 - Определение в ТИФА титров антител к Pla у BALB/c мышей, иммунизированных с использованием различных адъювантов
|
Адъювант |
Титры антител в ТИФА |
|
ПО |
1:12 800 |
|
TMC |
1:6 400 - 1:12 800 |
|
ПАФ |
1:200 - 1:400 |
При оценке результатов ТИФА было отмечено, что по сравнению с другими адъювантами применение ПО стимулировало выработку наиболее высоких титров антител при использовании предложенной схемы, на уровне или даже превышающих таковые, полученные с использованием ТМС. При этом различие в титрах анти-Pla-антител в группах, обработанных ПО и ПАФ, составило 32-64 раза.
Еще более значимые титры антител были получены при использовании ПО при иммунизации мышей по схеме А другими антигенами Y. pestis - Lcr V и Yop M, которые составили 1:51 200 - 1:102 400 и 1:6 400 - 1:12 800 соответственно.
Сравнимо высокие титры антител в наших экспериментах были получены в группе животных, обработанных ПАФ, только при использовании длинной схемы иммунизации (С) (табл. 2).
Таблица 2 - Сравнительные титры антител к рекомбинатным антигенам чумного микроба у мышей BALB/c, иммунизированных по схеме С
|
Адъювант |
Титры антител к рекомбинатным антигенам Y. pestis |
||
|
Pla |
LcrV |
YopM |
|
|
ПАФ
|
1:25 600 - 1: 102 400 |
1:102 400 - 1:409 600 |
1:51 200 - 1:409 600 |
Следует отметить, что использование адъювантов на основе минеральных и синтетических масел (ПАФ, ТМС) было сопряжено с определенными трудностями, более выраженными у адъюванта Фрейнда: плохое смешивание антигена с масляной эмульсией, образование пены при смешивании и в связи с этим потеря некоторого количества антигена, оседающего на стенках инъектора и пробирок для смешивания; образование гранулем у биомоделей на месте введения препаратов, а также угнетение общего состояния здоровья лабораторных животных. Применение водорастворимого иммуномодулятора ПО позволяло избежать описанных негативных моментов и побочных эффектов.
Таким образом, в наших экспериментах ПО продемонстрировал высокую эффективность в качестве адъюванта при иммунизации BALB/c мышей рекомбинатными и химически очищенными антигенами бактериальной природы.
Выводы
- Применение ПО позволяет получить в короткие сроки высокие титры специфических антител, и по этому показателю превосходит классические адъюванты на основе масел - ПАФ и TMC.
- ПО легко смешивается с растворами антигенов и не вызывает побочных сайд-эффектов у биомоделей.
- Перспективным является дальнейшее изучение влияния ПО на изменения иммунного ответа у иммунизируемых биомоделей и определение возможности его использования для создания высокоэффективных субъединичных вакцин против заболеваний, вызываемых внутриклеточными бактериями, в частности патогенными иерсиниями и хламидиями.
Работа выполнена при частичной поддержке грантов NIH/BTEP/ISTC Проект #3846 и HDTRA 1-11-1-0032, Subaward No. 11-082.
Рецензенты:
- Назарова Л.С., д.м.н., профессор кафедры микробиологии, вирусологии и иммунологии ФГБОУ ВПО «Саратовский ГАУ», г. Саратов.
- Шульдяков А.А., д.м.н., профессор, зав. кафедрой инфекционных болезней ГБОУ ВПО «Саратовский государственный медицинский университет имени В.И. Разумовского» Минздравсоцразвития России, г. Саратов.



