На стабильность образующихся соединений будет значительно влиять делокализованная p-электронная система амидов, способная перераспределять заряд на карбонильную группу молекулы. В настоящее время многочисленными исследованиями доказано, что если в молекуле амида отсутствуют другие координационно-активные заместители, то в качестве акцептора кислотного протона при образовании комплексов выступает карбонильный кислород [1-4].
Целью настоящей работы явилось определение центра протонирования модельных молекул карбамида, сукцинамида, трихлорацетамида, фторацетамида, цианацетамида, бензамида, салициламида с помощью квантово-химического расчета электронных и энергетических параметров амидов.
Для реализации поставленной цели необходимо решение задачи, которая предусматривает анализ полученных квантово-химическим методом величин, характеризующих электронное строение исследуемых молекул амидов - эффективных зарядов и электронных плотностей на гетероатомах амидов, дипольных моментов и потенциалов ионизации, а также энтальпий образования исследуемых моделей.
Кроме этого, интересно было проследить изменение перечисленных характеристик, а, следовательно, и протоноакцепторной способности потенциального реакционного центра в молекулах амидов в зависимости от электронной природы заместителя.
Квантово-химические расчеты выполнены по программам MOPAC, HyperChem 8.03 методом РМ3. Использованный полуэмпирический метод является методом валентного приближения, т.е. учитывает валентные электроны и атомные орбитали (АО) валентных оболочек.
Полученные квантово-химическим методом данные по электронным характеристикам и энтальпиям образования исследуемых амидов представлены в таблице 1.
Таблица 1. Электронные характеристики амидов
|
Параметр
Соединение |
-ΔfН, кДж/моль |
ПИ,эВ |
μ, D
|
Зарядовые характеристики, q, е.з. |
Электронная плотность |
||||
|
O |
N |
Hal |
O |
N |
Hal |
||||
|
Карбамид |
196,56 |
10,29 |
3,04 |
-0,39 |
0,005 0,001 |
- |
6,39 |
5,00 5,00 |
- |
|
Сукцинамид |
387,06 |
10,17 |
0,30 |
-0,37 |
-0,006 |
- |
6,37 |
5,01 |
- |
|
Ацетамид |
197,15 |
10,54 |
3,51 |
-0,37 |
-0,44 |
- |
6,34 |
5,34 |
- |
|
Трихлорацетамид |
240,21 |
10,57 |
2,64 |
-0,32 |
0,02 |
0,09 0,06 0,02 |
6,32 |
4,98 |
6,91 6,94 6,98 |
|
Фторацетамид |
373,45 |
10,41 |
4,05 |
-0,33 |
-0,002 |
-0,13 |
6,33 |
5,00 |
7,13 |
|
Цианацетамид |
41,92 |
10,54 |
5,31 |
-0,33 |
-0,01 -0,03 (СºN) |
- |
6,33 |
5,01 5,03 (СºN) |
- |
|
Бензамид |
66,55 |
10,04 |
3,32 |
-0,37 |
-0,007 |
- |
6,37 |
5,01 |
- |
|
Салициламид |
270,70 |
9,29 |
3,62 |
-0,42 |
0,02 |
- |
6,42 |
4,98 |
- |
Замещение атомов водорода в метильной группе ацетамида на более электроотрицательные атомы хлора и фтора, на цианогруппу, появление бензольного кольца приводит, в первую очередь, к перераспределению электронной плотности в молекулах амидов. Наибольший интерес представляет сопоставление значений данной электронной характеристики для гетероатомов - азота, кислорода, а также хлора (фтора), которые являются потенциальными реакционными центрами молекул амидов (таблица 1).
Сравнительный анализ значений электронной плотности на гетероатомах в молекулах производных ацетамида позволяет сделать следующие выводы.
Наиболее высокая электронная плотность наблюдается на атоме карбонильного кислорода во всех амидах, кроме трихлорацетамида и фторацетамида, в которых наибольшая электронная плотность сконцентрирована на атомах галогенов, что вполне объяснимо наличием у этих атомов большего числа неподелённых пар электронов, чем у атомов кислорода и азота. Величины электронной плотности на атомах карбонильного кислорода в моделях амидов примерно одинаковы, только в молекуле салициламида более высокое значение данной электронной характеристики - 6,42, а электронная плотность на атомах аминного азота имеет более высокое значение для молекулы ацетамида и меньшее в молекуле салициламида. Сопоставление же величин электронной плотности на атомах кислорода карбонильной группы и азота аминогруппы, а также азота цианогруппы показывает, что в целом она больше на атоме кислорода. Последнее указывает на более высокую электронодонорную, а, следовательно, и реакционную способность атома кислорода.
Изменение электронного перераспределения в молекулах амидов по сравнению с молекулой ацетамида сказывается и на зарядовых характеристиках гетероатомов.
Сравнение зарядовых характеристик показывает, что наибольший полный отрицательный заряд в молекулах амидов концентрируется на атоме кислорода, в то время как в молекуле ацетамида более электроотрицателен атом азота аминогруппы. При этом абсолютное значение этой характеристики для атома кислорода в молекуле трихлорацетамида, фторацетамида и цианацетамида несколько ниже, чем на аналогичном атоме в молекуле ацетамида [1].
В молекулах карбамида и салициламида величина отрицательного заряда атома карбонильного кислорода выше по абсолютной величине, чем в молекуле ацетамида. Атом азота аминной группы в молекуле трихлорацетамида и салициламида по сравнению с аналогичным атомом в молекуле ацетамида положительно заряжен. Отсюда следует, что замена атомов водорода в метильной группе ацетамида на атомы хлора в трихлорацетамиде, а также появление бензольного кольца, один из атомов водорода которого замещён на гидроксильную группу в молекуле салициламида приводит к заметному гашению электроотрицательного заряда на атоме азота аминогруппы.
При замещении одного атома водорода ацетамида на атом фтора или цианогруппу происходит уменьшение отрицательного заряда на атоме азота, но он остаётся отрицательнозаряжен, хотя эта величина намного меньше, чем в молекуле ацетамида. Отрицательный эффективный заряд на атоме азота цианогруппы незначительно больше по величине, чем на атоме аминного азота молекулы цианацетамида, но намного меньше, по сравнению с данной электронной характеристикой для атома карбонильного кислорода молекулы цианацетамида.
На рисунке 1 представлена карта распределения зарядов в молекуле амида, по данным РМ3 расчёта на примере одной из исследуемых моделей амидов - молекулы цианацетамида (CNCH2CONH2).
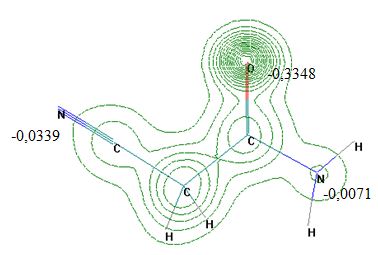
Рисунок 1. Карта распределения зарядов в молекуле CNCH2CONH2
Происходящее протонирование молекулы цианацетамида по атому карбонильного кислорода вполне объяснимо принципом Пирсона теории «жестких и мягких» кислот и оснований, согласно которому: «жесткая кислота предпочтительно координируется с жестким основанием, и мягкая кислота предпочтительно координируется с мягким основанием» [5]. По этому принципу Н+ является жесткой кислотой, а CN- - мягким основанием (RO- и RNH2 - жесткие основания). Однако это не означает, что комплексы мягкой кислоты с жестким основанием или жесткой кислоты с мягким основанием не могут существовать вообще. Скорее это вопрос их относительной устойчивости, т.е., например, комплекс жесткой кислоты с мягким основанием может существовать, но будет менее устойчив, чем комплекс той же кислоты с жестким основанием.
Хорошей иллюстрацией этому служит сравнение энтальпий образования О- и N-протонированных моделей цианацетамида различного состава: ΔfH (CNCH2CONH2·HCl) = -100,29 и +51,02 кДж/моль соответственно (1:1); ΔfH (2CNCH2CONH2·HCl) = -112,84 и +4,50 кДж/моль соответственно (2:1). Кроме того, согласно Клопману [6], к акцептору, являющемуся жесткой льюисовой кислотой, лиганд будет координироваться атомом, имеющим в молекуле наибольший отрицательный заряд, а в данном случае наибольший отрицательный заряд сконцентрирован на атоме карбонильного кислорода (q О =-0,3348; q N =-0,0071; q NCN =-0,0339 ед. заряда), т.е. имеет место зарядово-контролируемая реакция (рисунок 1).
Как видно на рисунке 1, а также из вышесказанного следует, что, т.к. на атоме кислорода карбонильной группы сконцентрирован наибольший по абсолютной величине отрицательный заряд, следовательно, атом кислорода обладает большей электронодонорной, соответственно и протоноакцепторной способностью. Таким образом, можно сделать вывод, что потенциальным реакционным центром в исследуемых молекулах амидов является атом кислорода карбонильной группы.
Подтверждением вышесказанного вывода о реакционном центре молекул амидов, может явиться и анализ заселенности атомных орбиталей (АО) (таблица 2).
Наибольшей заселенностью характеризуются s-орбитали атома кислорода карбонильной группы молекул амидов. Среди р-орбиталей в исследуемых амидах наиболее заселены рхО-АО. Исключение составляет молекула ацетамида, у которой максимальной заселенностью характеризуется руО-АО. Заселенности атомных s-, p-орбитали атома азота аминогруппы молекул амидов сравнимы между собой, при этом рzN-АО этого атома заселена в большей степени. Сравнение заселенности АО атомов кислорода и азота показывает, что в наибольшей степени заселены sО-АО и рхО-АО, даже по сравнению с рzN-АО атома аминного азота. Это указывает на большую электронодонорную способность атома кислорода карбонильной группы амида и говорит в пользу данного атома как центра протонирования.
Таблица 2. Электронная заселенность орбиталей атомов кислорода и азота
|
Амиды |
SO |
PxO |
PyO |
PzO |
SN |
PxN |
PyN |
PzN |
|
Карбамид |
1,87 |
1,70 |
1,36 |
1,46 |
1,38 1,39 |
0,98 1,00 |
1,01 1,01 |
1,61 1,59 |
|
Сукцинамид |
1,87 1,87 |
1,75 1,75 |
1,35 1,34 |
1,40 1,41 |
1,38 1,37 |
1,00 0,98 |
1,11 1,08 |
1,52 1,56 |
|
Ацетамид |
0,93 |
0,72 |
0,84 |
0,68 |
0,69 |
0,68 |
0,52 |
0,72 |
|
Трихлорацетамид |
1,87 |
1,66 |
1,41 |
1,38 |
1,36 |
1,00 |
1,00 |
1,61 |
|
Фторацетамид |
1,87 |
1,65 |
1,43 |
1,38 |
1,38 |
1,00 |
1,01 |
1,61 |
|
Цианацетамид |
1,87 |
1,71 |
1,35 |
1,41 |
1,37 |
1,00 |
1,31 |
1,32 |
|
|
|
|
|
C≡N |
1,74 |
1,19 |
1,05 |
1,05 |
|
Бензамид |
1,87 |
1,67 |
1,42 |
1,41 |
1,38 |
0,99 |
1,00 |
1,63 |
|
Салициламид |
1,87 |
1,92 |
1,88 |
1,48 |
1,35 |
0,99 |
0,98 |
1,66 |
Заселенность атомных орбиталей определяется как суммы вкладов (квадраты коэффициентов) атомных орбиталей для ВЗМО (высшая занятая молекулярная орбиталь) молекул амидов.
Анализ квантово-химического расчета показал, что наибольший энергетический вклад в ВЗМО (ВЗМО описывает не поделенную пару электронов) с энергией -10,408 эВ молекулы фторацетамида принадлежит рz- орбитали атома азота аминогруппы (коэффициент АО =-0,7881) и рz-орбитали атома кислорода, коэффициент которой равен 0,3914. Наибольший вклад атомных орбиталей гетероатомов в НСМО молекулы фторацетамида, с энергией +0,585 эВ, принадлежит рz-орбитали атома кислорода (коэффициент АО = -0,5380), и меньше рz- орбитали атома азота (-0,1658). Наименьший вклад в ВЗМО принадлежит s-орбитали кислорода (0,0009), а для НСМО - px-орбитали азота (0,0004). Сравнение вкладов в ВЗМО атомных орбиталей с не поделенными парами электронов для атомов кислорода и азота, отвечающими за реакционную способность, т.е. способность образовывать связь с протоном неорганической кислоты, показывает следующее.
Коэффициенты АО кислорода равны 0,0009 (s) и -0,2158 (px), атома азота -0,2158 (s). Отсюда следует, что коэффициенты атомной орбитали азота (s) и кислорода (px) имеют одинаковую величину. Как известно, s-электроны располагаются ближе к ядру атома, т.е. в большей степени испытывают притяжение к ядру, чем р-электроны. Поэтому, а также в связи с тем, что р-орбиталь выше по энергии чем s-орбиталь, для перехода одного р-электрона с px-орбитали атома кислорода на образование связи с протоном неорганической кислоты необходимо меньше затратить энергии, чем для перехода с s-орбитали атома азота (при «возбуждении» данных атомов).
Таким образом, пиктографическим анализом подтверждается наибольшая реакционная способность атома кислорода по сравнению с атомом азота.
Развитие расчетных методов позволило с достаточной корректностью вычислять изменение электронного состояния реакционного центра под воздействием заместителя. Ясно, что само изменение заряда на реакционном центре уже может служить характеристикой влияния заместителя.
Сравнение электронных характеристик для гетероатомов кислорода и азота различных исследуемых молекул амидов показывает их зависимость от электронной природы вводимого в молекулу ацетамида заместителей.
Атомы хлора, входящие в трихлорметильную группу трихлорацетамида, как показывает расчет, положительно заряжены. Этот факт находится в противоречии с выявленным выше фактом о наибольшей сконцентрированности электронной плотности на атомах хлора в молекуле трихлорацетамида.
Анализ величин ПИ, дипольных моментов и энтальпий образования исследуемых амидов показывает следующее. Замещение атома водорода метильной группы ацетамида на атомы хлора, фтора и цианогруппу приводит к меньшим изменениям величины ПИ, по сравнению с молекулами бензамида и салициламида, ПИ которых уменьшается в большей степени. Сравнение рассчитанных величин дипольных моментов исследуемых амидов между собой показывает, что более высоким дипольным моментом обладает молекула цианацетамида, т.е. замещение атома водорода в метильной группе ацетамида на цианогруппу увеличивает дипольный момент. Разница в значениях дипольных моментов рассматриваемых моделей амидов связана с различиями в их электронной природе, обусловленными присутствием в метильной группе ацетамида атомов хлора, атома фтора, обладающих значительной величиной электроотрицательности, цианогруппы или бензольного кольца. Из таблицы 1 следует, что значение энтальпий образования этих амидов имеют отрицательное, достаточно большое по абсолютной величине, значение, что указывает на их высокую стабильность. При этом наименее устойчивой является молекула цианацетамида (ΔfН = -41,92 кДж/моль), а наиболее - молекула сукцинамида (-ΔfН = -387,06 кДж/моль).
Таким образом, анализ зарядовых характеристик и электронной плотности на гетероатомах исследуемых амидов позволяет сделать вывод, что большей электронодонорной способностью обладает атом кислорода карбонильной группы по сравнению с другими гетероатомами молекул амидов.
Рецензенты:
- Ю Валентина Константиновна, д.х.н., профессор. Главный научный сотрудник лаборатории химии синтетических и природных лекарственных веществ, АО «Институт химических наук им. А. Б. Бектурова», г. Алматы.
- Чалов Тулеген Каменович, д.х.н., профессор. Главный научный сотрудник лаборатории ионообменных смол и мембран, АО «Институт химических наук им. А. Б. Бектурова», г. Алматы.



