В последнее время все чаще появляются работы, в которых активные формы кислорода (АФК) рассматриваются в качестве регуляторов внутриклеточных процессов. АФК либо сами выступают в роли вторичных посредников [1], либо модулируют действие известных регуляторных каскадов клетки [9]. Ряд регуляторных путей связан с влиянием АФК на ионтранспортные системы клеток.
Мембрана эритроцитов содержит только один тип каналов, а именно Са2+-активируемые К+-каналы (К+(Са2+)-каналы) средней проводимости, или Gardos-каналы. В связи с этим эритроциты служат естественной моделью для изучения каналов этого типа. Кроме того, данное обстоятельство позволяет проводить исследования на суспензии интактных клеток. Со времени своего обнаружения К+(Са2+)-каналы эритроцитов достаточно интенсивно изучаются, но только недавно была установлена их физиологическая роль. К+(Са2+)-каналы вносят определенный вклад в эриптоз - программируемую гибель клеток [10], изменение объема клеток [4]. Доказано их участие в деформируемости клеток: Са2+-индуцируемое снижение деформируемости эритроцитов устраняется при выравнивании градиента ионов калия или при применении блокатора каналов клотримазола [4].
Регуляция К+(Са2+)-каналов эритроцитов осуществляется несколькими путями. Один из них связан с вторичными посредниками, эффект которых реализуется через воздействие на протеинкиназу А или С [8].
В эритроцитах постоянно происходит образование АФК, которые влияют на регуляторные пути этих клеток [5]. Кроме того, в процессе своего функционирования эритроциты подвергаются действию АФК, продуцируемых другими клетками: эндотелиоцитами, иммунокомпетентными клетками во время так называемого кислородного взрыва. Однако данные об участии перекиси водорода в регуляции Са2+-активируемых калиевых каналов эритроцитов человека немногочисленны.
В связи с вышесказанным представляется весьма актуальным изучение роли АФК в регуляции К+(Са2+)-каналов эритроцитов. Цель исследования - оценить влияние и механизм действия перекиси водорода на регуляцию Са2+-зависимой калиевой проницаемости мембраны эритроцитов здоровых доноров в условиях стимуляции α1-адренергических рецепторов.
Материал и методы
В работе использовалась кровь здоровых доноров (27 человек). Кровь забиралась из локтевой вены утром натощак в пробирки с гепарином (25 ед/мл крови). После центрифугирования (1000 g, 5 мин, 4 °С) плазму и клетки белой крови удаляли, а эритроциты дважды промывали 3 частями изоосмотического раствора NaCl (150 мМ), содержащего 5 мМ Na-фосфатный буфер (рН 7,4) при тех же условиях центрифугирования.
Для исследования К+(Са2+)-каналов был применен метод регистрации мембранного потенциала в суспензии эритроцитов по изменениям рН среды инкубации в присутствии протонофора, основанный на том, что в этих условиях распределение протонов зависит от мембранного потенциала [2]. Эксперименты проводились по следующему плану. Для получения гиперполяризационного ответа к 4,75 мл среды инкубации (среда N), содержащей 150 мМ NaCl, 1 мМ KCl, 1 мM MgCl2, 10 мM глюкозы и 10 мкМ СаСl2, добавляли 0,25 мл упакованных эритроцитов. Через 5 мин инкубации при 37 °С и постоянном перемешивании добавляли протонофор СlССР до конечной концентрации 20 мкМ и спустя 2 мин 0,5 мкМ Са2+-ионофора А23187. Добавление кальциевого ионофора А23187 к суспензии клеток, содержащей хлорид кальция, приводило к выходу ионов калия и развитию гиперполяризационного ответа (ГО) мембраны эритроцитов, что находило свое отражение в изменении рН суспензии. Защелачивание среды инкубации соответствовало гиперполяризации мембраны, а восстановление рН - возвращению мембранного потенциала (МП) к исходному значению. Амплитуда ГО и скорость его развития (V1) характеризуют Са2+-активируемые калиевые каналы, а скорость восстановления МП (V2) - активность Са2+-АТФазы [2].
В ряде экспериментов среда инкубации клеток содержала 5∙10-8 М, 10-7 М и 10-6 М перекиси водорода (Н2О2) либо 0,026 М ингибитора каталазы аминотразола в присутствии соответствующих концентраций Н2О2. Стимуляцию α1-адренергических рецепторов эритроцитов проводили добавлением L-фенилэфрина гидрохлорида (10-8 М). Для активации протеинкиназы С был использован форболовый эфир (phorbol 12-myristate-13-acetate) в концентрации 10-7 М, который добавлялся в среду инкубации эритроцитов. В качестве ингибитора протеинкизазы С использовался стауроспорин в концентрации 10-6 М.
Исследование деформируемости эритроцитов проводили методом лазерной эктацитометрии, основанной на явлении дифракции световых лучей при прохождении через тонкий слой жидкости с взвешенными в ней клетками [7]. Для количественной оценки рассчитывался индекс деформируемости эритроцитов (ИДЭ): ИДЭ=(L-Н)/(L+Н), где L - больший диаметр эллипса; Н - меньший диаметр эллипса. Значения ИДЭ, полученные для клеток, предынкубированных в среде N без добавления агентов, принимали за 100%.
Анализ данных проводили при помощи программы Statistica 6.0 for Windows фирмы Statsoft. Фактические данные представлены в виде «среднее ± ошибка среднего» (X±m). Для определения характера распределения полученных данных использовали критерий нормальности Колмогорова-Смирнова. Сформированные выборки не подчинялись закону нормального распределения, поэтому для проверки статистических гипотез были использованы непараметрические критерии. Для проверки гипотезы об однородности двух независимых выборок использовался U-критерий Манна-Уитни (Mann-Whitney U-test). Для проверки однородности парных или зависимых выборок был использован Т-критерий Вилкоксона (Wilcoxon mached pairs test). Различия считали достоверными при уровне значимости р<0,05.
Результаты и обсуждение
Добавление в среду инкубации эритроцитов 5∙10-8 М,10-7 М и 10-6 М перекиси водорода не приводило к изменению параметров гиперполяризационного ответа мембраны. Обработка эритроцитов ингибитором каталазы аминотриазолом в присутствии выбранных концентраций перекиси водорода вызывала снижение амплитуды и скорости развития ГО, но при этом увеличивалась скорость восстановления мембранного потенциала.
Полученные данные свидетельствовали о снижении Са2+-зависимой калиевой проницаемости и, напротив, об увеличении активности Са2+-насоса мембраны эритроцитов в условиях повышения внутриклеточной концентрации Н2О2. Показано, что в формировании Са2+-индуцированного ГО эритроцитов участвуют не только К+(Са2+)-каналы, но и Са2+-АТФаза: увеличение ее активности снижает амплитуду ГО эритроцитов [2]. Не исключено, что увеличение активности Са2+-АТФазы под действием Н2О2 приводило к описанному эффекту.
Известно, что активность ряда ферментов, являющихся участниками внутриклеточных регуляторных каскадов, таких как протеинкиназа С (ПК С), NO-синтаза, гуанилатциклаза и др., модулируются АФК [9]. Установлено, что внутриклеточные сигнальные системы участвуют в регуляции К+(Са2+)-каналов эритроцитов [3; 8].
В связи с вышесказанным исследовалось влияние повышенной внутриклеточной концентрации перекиси водорода в условиях стимуляции α1-адренергических рецепторов, которые присутствуют в мембране эритроцитов, на параметры ГО.
Ингибирование каталазы аминотриазолом в присутствии Н2О2 и обработка эритроцитов L-фенилэфрином значительно увеличивало амплитуду ГО эритроцитов, которая составила 181,85±7,04% (n=7, р<0,05) (рис. 1). В этих условиях существенно увеличивалась и скорость гиперполяризации, и скорость восстановления мембранного потенциала эритроцитов. Эти параметры составили, соответственно, 290,45±20,46 % (n=7, р<0,05) и 440,28±0,56 % (n=7, p<0,05) по сравнению с контролем (рис. 1).
Стимуляция L-ФЭ α1-адренергических рецепторов приводит к активации фосфолипазы С через G-белок. В результате этого образуются инозитол-1,4,5-трифосфат и диацилглицерол, который в присутствии фосфатидилсерина и Са2+ активирует протеинкиназу С. Значительное увеличение параметров ГО в условиях ингибирования каталазы может быть связано с влиянием перекиси водорода на ключевой фермент регуляторного каскада, опосредованного α1-адренергическими рецепторами, протеинкиназу С.
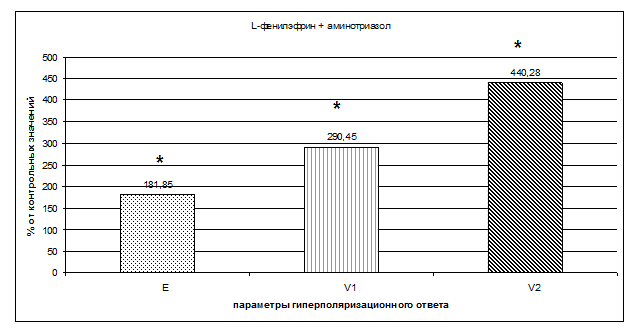
Рис. 1. Влияние L-фенилэфрина (10-8 М) в присутствии перекиси водорода (10-6 М) и аминотриазола (0,026 М) на параметры гиперполяризационного ответа мембраны эритроцитов.
Здесь и на рис. 2: Е - амплитуда гиперполяризационного ответа; V1 - скорость развития гиперполяризационного ответа; V2 - скорость восстановления гиперполяризационного ответа. За 100% принимались значения гиперполяризационного ответа без добавления агентов.
* - обозначены параметры, достоверно отличающиеся от контрольных с р<0,05.
В следующей серии экспериментов изучено влияние форбол-миристат-ацетата (ФМА) - активатора протеинкиназы С на параметры ГО эритроцитов в условиях ингибирования каталазы в присутствии Н2О2. В этих условиях достоверно повышались амплитуда ГО и скорость развития гиперполяризации мембраны эритроцитов до 141,01±12,37% (n=8, р<0,05) и до 125,31±0,41% (n=8 р<0,05) соответственно, по сравнению с контролем (рис. 2). Скорость восстановления мембранного потенциала эритроцитов достоверно не изменялась в присутствии использованных агентов. Обработка эритроцитов ингибитором протеинкиназы С стауроспорином устраняла полученные эффекты.
Таким образом, полученные данные позволяют предположить, что увеличение внутриклеточной концентрации перекиси водорода оказывает воздействие на компоненты регуляторного каскада, опосредованного α1-адренергическими рецепторами. Известно, что в эритроцитах стимуляция ПК С вызывает увеличение входа ионов кальция, что ведет к активации K+(Ca2+)-каналов [6]. Возможно, в условиях повышения внутриклеточной концентрации Н2О2, увеличивается активность ПК С, стимулированной через α1-адренергические рецепторы либо ФМА, что ведет к повышенному входу ионов Са2+ и, соответственно, к увеличению Са2+-зависимой К+- проницаемости мембраны эритроцитов, а также возрастанию активности Са2+-насоса.
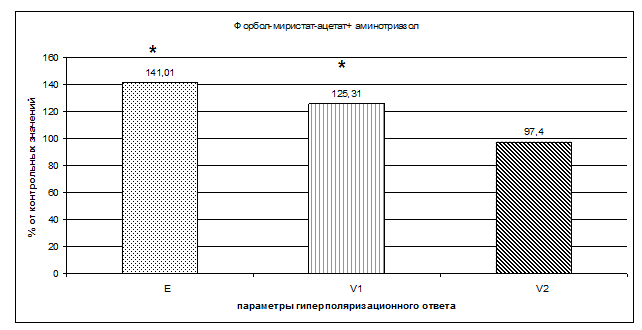
Рис. 2. Влияние форбол-миристат-ацетата (10-7 М) в присутствии перекиси водорода (10-6 М) и аминотриазола (0,026 М) на параметры гиперполяризационного ответа мембраны эритроцитов.
За 100% принимались значения гиперполяризационного ответа без добавления агентов.
* - обозначены параметры, достоверно отличающиеся от контрольных с р<0,05.
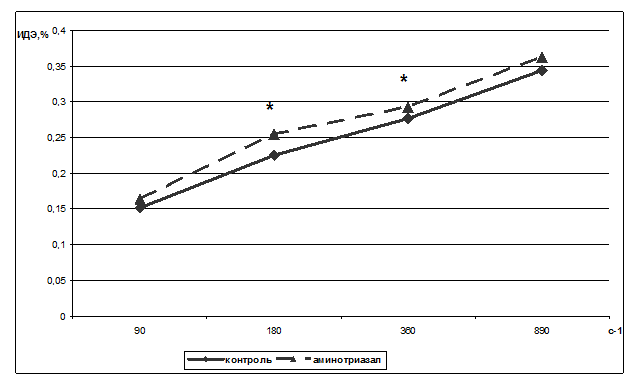
Рис. 3. Влияние аминотриазола (0,026 М) на индекс деформируемости эритроцитов.
За 100% принимались значения без добавления агента.
* - обозначены параметры, достоверно отличающиеся от контрольных с р<0,05.
Ранее в наших исследованиях было показано влияние повышенной Са2+-зависимой К+-проницаемости мембраны на деформируемость эритроцитов [4]. Поскольку в настоящем исследовании установлена регуляторная роль перекиси водорода на K+(Ca2+)-каналы, было изучено влияние этого агента на деформируемость эритроцитов.
С этой целью исследовано изменение деформируемости эритроцитов в присутствии аминотриазола при скоростях сдвига 90, 180, 360 и 890 с-1. Добавление аминотриазола в среду инкубации эритроцитов повышало индекс деформируемости эритроцитов относительно контрольных значений при всех выбранных скоростях сдвига до 0,164±0,077% (n=8), 0,2545±0,097% (n=8, р<0,05), 0,2929±0,033% (n=8, р<0,05) и 5,40±2,85% (n=8) соответственно. Достоверно параметр увеличился при скорости сдвига 180 и 360 с-1 (рис. 3).
Не исключено, что полученные данные можно объяснить снижением Са2+-зависимой К+-проницаемости мембраны в условиях ингибирования каталазы.
Заключение
Таким образом, в настоящем исследовании установлено, что ингибирование каталазы в присутствии перекиси водорода снижает Са2+-зависимую К+-проницаемость мембраны эритроцитов здоровых доноров. Это может быть одной из причин повышения способности эритроцитов деформироваться при ингибировании каталазы. В то же время стимуляция α1-адренергических рецепторов L-фенилэфрином либо активация протеинкиназы С посредством форболового эфира в присутствии ингибитора каталазы и перекиси водорода значительно увеличивают Са2+-зависимую К+-проницаемость мембраны эритроцитов. Обнаруженный эффект, возможно, обусловлен влиянием перекиси водорода на протеинкиназу С либо другие звенья регуляторного каскада, опосредованного α1-адренергическими рецепторами.
Рецензенты
- Степовая Е.А., д-р мед. наук, профессор кафедры биохимии и молекулярной биологии ГБОУ ВПО «СибГМУ» Минздравсоцразвития России, г. Томск.
- Ласукова Т.В., д-р биол. наук, профессор кафедры медико-биологических дисциплин ГБОУ ВПО «Томский государственный педагогический университет», г. Томск.



