Координационные соединения d-металлов с аминосахарами являются перспективными объектами изучения теоретической и прикладной химии. Особый интерес представляют координационные соединения глюкозамина. Глюкозамин остается одним из наиболее эффективных лекарственных препаратов, используемых для лечения заболеваний суставов, а в виде пищевых добавок – как профилактическое средство. Для количественного определения глюкозамина используют различные физико-химические методы – спектрофотометрию, жидкостную и газожидкостную хроматографии [1]. Наиболее перспективным является фотометрический метод. Однако практически все методики, предложенные на его основе, имеют ряд недостатков – длительность анализа, использование дорогостоящих и малодоступных реактивов, плохая воспроизводимость. Поэтому изучение координационных соединений глюкозамина и разработка на их основе быстрых и простых в выполнении методик спектрофотометрического определения глюкозамина в лекарственных формах является актуальным.
Целью данного исследования явилось изучение комплексообразования глюкозамина гидрохлорида с ионами d-элементов четвертого периода: кобальта(II), никеля(II), меди(II) и цинка. Будучи аминосахаром, глюкозамин способен образовывать донорно-акцепторные связи за счет атома азота аминогруппы и атома кислорода гидроксидной группы.
В работе ряда авторов методом кондуктометрии было изучено взаимодействие гидрохлорида глюкозамина с вышеуказанными катионами металлов в нейтральной среде. При этом было установлено, что гидрохлорида глюкозамин в нейтральной среде взаимодействует только с ионами цинка и меди (II). Для остальных металлов кривые титрования идентичны кривым титрования исходных реагентов. На отсутствие взаимодействия между компонентами в растворе указывают и данные электронной спектроскопии. Спектры смеси солей Co(II) и Ni(II) с гидрохлорида глюкозамином совпадают со спектрами ионов указанных металлов [2, 3].
Из литературных источников известно, что глюкозамин в виде основания имеет максимум поглощения при 273 нм [1]. Глюкозамина гидрохлорид, в связи с протонированием азота аминогруппы в кислой и нейтральной средах, спектра поглощения не имеет. Максимумом поглощения при 273 нм характеризуется только депротонированная форма глюкозамина.
Нами было установлено, что в отличии от нейтральной среды в щелочной среде (рН 10-11) глюкозамин образует хелатный комплекс с ионами кобальта(II) и никеля(II). В случае кобальта(II) изменений в спектре поглощения не происходит, только возрастает величина оптической плотности. Комплексообразование никеля(II) с глюкозамином, как видно из рисунка 1, сопровождается ростом максимума поглощения при длине волны 300 нм и исчезновением максимума поглощения глюкозамина. Это объясняется включением донорной электронной пары аминогруппы глюкозамина в хромофорную систему никеля(II). Процесс комплексообразования стабилизирует глюкозамин в щелочной среде, препятствуя его деструкции. Косвенным доказательством образования хелатного комплекса может служить переход зеленой окраски исследуемого раствора в голубовато-зеленую с легкой флуоресценцией и появлением малоинтенсивного максимума поглощения при длине волны 680 нм. Определение состава хелатного соединения никеля(II) проводили методом изомолярных серий и прямой линии Асмуса при длине волны 300 нм и рН 10,5. Соотношение компонентов глюкозамин : никель(II) в обоих случаях оказалось равным 2 : 1.
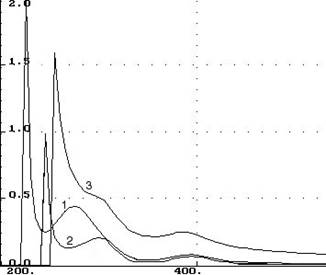
Рис. 1. Абсорбционные спектры
1 – раствор глюкозамина [C] = 4,96×10-2 мг/мл-1, 2 – раствор никеля(II) сульфата [C] (Ni2+) =5,0×10-1 мг/мл-1, 3 – комплекс глюкозамина с ионами никеля(II).
Далее было установлено, что между оптической плотностью и концентрацией глюкозамина в растворе существует линейная зависимость в пределах концентрации глюкозамина 0,02-0,20 мг∙мл-1. На основании этого можно сделать вывод о возможности разработки методики количественного определения глюкозамина гидрохлорида спектрофотометрическим методом с использованием реакции комплексообразования с никелем(II).
Следующим этапом исследований явилось изучение взаимодействия глюкозамина с ионами меди(II) при рН 10-11. Однако в этих условиях происходит быстрое восстановление ионов меди(II), что сопровождается образованием розового осадка металлической меди. Этот процесс идет очень быстро, в течение 3-4 минут. Продуктом окисления глюкозамина, согласно литературным данным, является 5-гидроксиметилфурфурол [4].
Изучение реакции комплексообразования глюкозамина с ионами цинка спектрофотометрическим методом не возможно, т.к. ион цинка, имея электронную конфигурацию 3d10, хромоформными свойствами не обладает. Поэтому изучение реакции комплексообразования проводили косвенным путем. Работой ряда авторов было установлено, что оптическая плотность окрашенного комплекса о-гидроксигидрохинонфталеина с ионами палладия(II) уменьшается пропорционально возрастанию концентрации глюкозамина гидрохлорида [5]. Учитывая отсутствие о-гидроксигидрохинонфталеина в розничной продаже России и дороговизну солей палладия, эти реактивы были заменены эриохромом черным Т и сульфатом цинка, который образует комплексное соединение в интервале рН 9,5-11 с максимум поглощения при 542 нм. Отношение между цинком и реагентом в этих условиях соответствует 1:1. Спектры поглощения эриохрома черного Т и его комплекса с цинком приведены на рисунке 2.
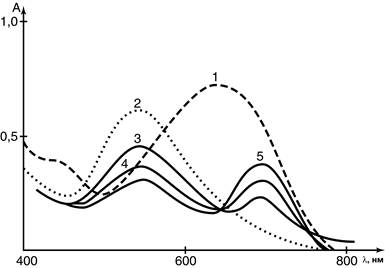
Рис. 2. Абсорбционные спектры:
1 – раствор эриохрома черного Т, 2 – комплекс эриохрома черного Т с ионами цинка, 3-5 – после добавления глюкозамина гидрохлорида к комплексу
При введении в раствор комплексного соединения раствора глюкозамина гидрохлорида наблюдается уменьшение оптической плотности комплекса, подчиняющееся линейной зависимости в пределах концентраций глюкозамина гидрохлорида 0,04–0,25 мг×мл-1. Объясняется уменьшение оптической плотности образованием более прочного хелатного соединения цинка с глюкозамином с соотношением цинк : глюкозамин 1 : 2, предположительно следующей структуры (рисунок 3).
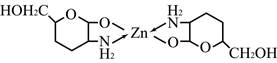
Рис. 3. Формула хелатного соединения цинка с глюкозамином
Полученные результаты могут быть использованы, после соответствующей доработки, для разработки спектрофотометрической методики количественного определения глюкозамина гидрохлорида в субстанции и лекарственных формах.
Рецензенты:
Лазарян Д.С., д.фарм.н., профессор, заведующий кафедрой фармацевтической и токсикологической химии Пятигорского медико-фармацевтического института – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Оганесян Э.Т., д.фарм.н., профессор, заведующий кафедрой органической химии Пятигорского медико-фармацевтического института – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Библиографическая ссылка
Щербакова Л.И., Гокжаева Л.П., Зяблицева Н.С. ИЗУЧЕНИЕ ВЗАИМОДЕЙСТВИЯ НЕКОТОРЫХ D-МЕТАЛЛОВ С ГЛЮКОЗАМИНОМ // Современные проблемы науки и образования. – 2014. – № 6. ;URL: https://science-education.ru/ru/article/view?id=15894 (дата обращения: 19.04.2024).



