В роде Iris наиболее неоднородным по составу считается подрод Limniris (Tausch) Spach», насчитывающий более 45 видов [2, 10]. Общим характерным признаком этих видов является отсутствие бородки на наружных долях околоцветника, поэтому за видами этого подрода закрепилось название «безбородые ирисы».
Некоторые виды подрода Limniris активно изучаются в систематическом отношении, однако репродуктивные системы безбородых ирисов остаются малоизученными или они не изучены совсем [8]. Между тем известно, что данные о развитии репродуктивных органов важны как при выяснении дискуссионных вопросов систематики, филогении и эволюции цветковых растений [7, 9], так и для интродукции, часто сопряженной с селекцией.
Ранее нами дана эмбриологическая характеристика четырех видов ирисов из подрода Limniris [3, 4]. В данном сообщении изложены результаты эмбриологического изучения ириса рогозолистного (I. typhifolia Kitag.).
Материал и методы
Материал для исследования был собран в иридарии Ботанического института РАН им. В.Л. Комарова в 2011 – 2012 г.г., его обработка сделана в соответствии с существующими методами [6]. Для изучения развития семязачатков фиксировались бутоны разных стадий развития и раскрытые цветки, с использованием фиксаторов Кларка и Навашина.
Последующая обработка материала и изготовление препаратов проводились в лаборатории цитогенетики и генетических ресурсов Пермского государственного национального исследовательского университета. Изучение качества пыльцы проводилось ацетокарминовым методом по З.П. Паушевой [6]. Парафинирование велось с помощью автоматической системы Leica TP 1020 карусельного типа. Срезы толщиной 7–10 мкм готовились с помощью ротационного микротома Leica RM и окрашивались галлоцианин-хромовыми квасцами [1]. При тройном окрашивании (реактив Шиффа, алциановый синий и гематоксилин Эрлиха) [5] использовали универсальный мультистейнер Leica ST 2020. Срезы заключались в синтетическую монтирующую среду БиоМаунт. Фотографии сделаны с помощью микроскопа Оlympus BX-51 c цифровой видеокамерой Olympus Camedia C-300Zoom c системой визуализации изображений и программы CELL B при увеличении 100 – 1500.
Результаты
Цветки I. typhifolia темно-фиолетовые; наружные доли обратнояйцевидные, внутренние доли прямые, обратно-ланцетные. Коробочка эллипсоидная, трехгранная. Фертильность пыльцевых зерен высокая, она составила 90,42±2,41 %, при Сv=5,96%. Гинецей синкарпный, завязь нижняя. Семязачатки расположены в два ряда, попарно, в шахматном порядке в каждом из трех гнезд коробочки и имеют центрально-угловую плацентацию. На ранних стадиях развития в семязачатках после периклинального деления археспориальной клетки образуется париетальная клетка и мегаспороцит. Семязачаток к стадии мегаспорогенеза полностью сформирован. После первого мейотического деления мегаспороцита образуется диада клеток. После второго деления мейоза образуется линейная тетрада мегаспор. Микропилярные мегаспоры дегенерируют и отмирают, а затем сдавливаются развивающимся зародышевым мешком и резорбируются. Халазальная мегаспора имеет густо окрашенную цитоплазму и крупное ядро, она быстро увеличивается, формируя зародышевый мешок.
Париетальная клетка делится антиклинально, образуя слой париетальной ткани, затем париетальные клетки делятся периклинально, образуя два ряда (рис. 1).
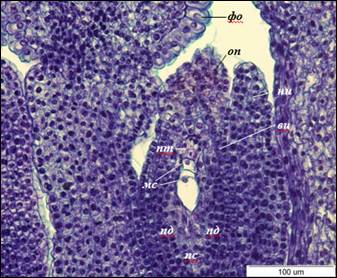
Рис 1. Анатропный семязачаток I. typhifolia (×400).
вн – внутренний интегумент, мс – мегаспора, ни – наружный интегумент, пд – подиум, пс – постамент, пт – париетальная ткань, оп – оперкулюм, фо – фуникулярный обтуратор
Поворот семязачатка составляет 180°, так что микропиле обращено к плаценте, а халаза и микропиле находятся на одной оси. Это характеризует семязачаток как анатропный. Интегументы полностью сформированы. Наружный интегумент 6-8-слойный, короче внутреннего. Внутренний интегумент двухслойный, в области микропиле расширяется до четырех слоев, формируя оперкулюм. Микропиле образовано внутренним интегументом, плотно сомкнуто. В основании фуникулуса эпидермальные клетки крупные, радиально вытянутые, образуют обтуратор. Клетки обтуратора вакуолизированные, с плотной цитоплазмой, утолщенными наружными стенками. В нуцеллусе дифференцируется постамент и подиум. Клетки постамента вытянутые, их длина в 3–4 раза превышает ширину. Клетки подиума изодиаметрические.
Размеры длины семязачатков достигают 442±9 мкм, ширины – 175±7 мкм. Размеры длины одноядерных зародышевых мешков достигают 50±2 мкм, ширины – 13±0,7 мкм. В результате разрастания зародышевого мешка слои париетальных клеток начинают сдавливаться. Наружный интегумент удлиняется. Длина микропилярного канала достигает 54±2 мкм.
После первого митотического деления формируется двуядерный ценоцит, ядра занимают полярное положение в зародышевом мешке, что сопровождается образованием центральной вакуоли. Длина двуядерных зародышевых мешков достигает – 81±3 мкм, ширина – 17±1 мкм. Клетки нуцеллуса, непосредственно прилегающие к зародышевому мешку, сдавливаются и разрушаются (рис. 2). В результате второго митотического деления образуется четырехъядерный зародышевый мешок, деление ядер асинхронно. После третьего митотического деления образуется 8-ядерный ценоцит.
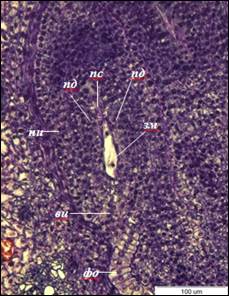
Рис. 2. Двуядерный зародышевый мешок I. typhifolia (×400).
ви – внутренний интегумент, зм – зародышевый мешок, ни – наружный интегумент,
пд – подиум, пс – постамент, фо – фуникулярный обтуратор
По завершению процесса клеткообразования в семязачатках можно наблюдать сформированные 8-ядерные 7-клеточные зародышевые мешки Polygonum-типа. Яйцевой аппарат состоит из яйцеклетки и двух синергид. Синергиды плотно прилегают друг к другу, яйцеклетка располагается за ними. Ядра синергид располагаются в центральной части клеток, вакуоли – в апикальной. В базальной части синергид различим нитчатый аппарат. В яйцеклетке ядро находится в апикальной части, вакуоль – в базальной (рис. 3). В халазальной части зародышевого мешка находятся три антиподы треугольной формы. Центральная клетка пронизана тяжами цитоплазмы, между которыми располагаются вакуоли. После завершения клеткообразования полярные ядра сближаются, и формируется ядро центральной клетки, которое смещено в антиподальный конец зародышевого мешка (рис. 4).
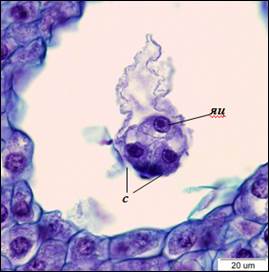
Рис. 3. Яйцевой аппарат (×1500). с – синергиды, яц – яйцеклетка
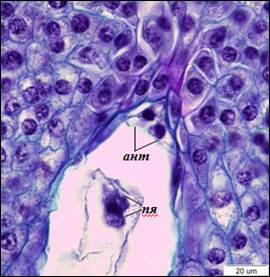
Рис. 4. Слияние полярных ядер (×1500). ант – антиподы, пя – полярные ядра
К моменту раскрытия цветка в завязи наблюдаются семязачатки овальной формы с 7-ядерными 7-клеточными зародышевыми мешками. Средние размеры длины семязачатков достигают 919±39 мкм, ширины – 464±48 мкм. Длина зрелых зародышевых мешков – 124±7 мкм, ширина – 84±9 мкм. Проводящий пучок состоит из слоев удлиненных густоплазменных клеток, часть которых трансформируется в сосуды. Наружный интегумент разрастается до девяти слоев и по длине становится равным внутреннему. Слои париетальной ткани к этому времени полностью дегенерируют. Клетки паренхимы наружного интегумента вакуолизованы, крупнее клеток эпидермы в 2–3 раза (рис. 5).
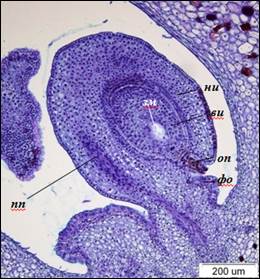
Рис. 5. Анатропный семязачаток I. typhifolia (×100).
ви – внутренний интегумент, зм – зародышевый мешок, ни – наружный интегумент,
оп – оперкулюм, пп – проводящий пучок, фо – фуникулярный обтуратор
В некоторых полноценно сформированных семязачатках наблюдается отсутствие зародышевых мешков. Нуцеллус в этих семязачатках дифференцирован на постамент и подиум, имеются слои париетальной ткани. Вместо зародышевого мешка наблюдаются сдавленные дегенерирующие клетки нуцеллуса.
Заключение
Репродуктивная сфера I. typhifolia впервые стала объектом исследования. Сравнение ранее полученных нами эмбриологических данных для четырех видов подрода Limniris [3, 4] с I. typhifolia показало, что в целом характеристика развития семязачатков и зародышевых мешков у видов, включенных в подрод Limniris, совпадает. Более того, такие характеристики, как анатропный двупокровный крассинуцеллятный семязачаток, одноклеточный археспорий, линейная тетрада мегаспор, зародышевый мешок Polygonum-типа, типичны для семейства Iridaceae в целом.
Рецензенты:
Колясникова Н.Л., д.б.н., профессор, заведующая кафедрой ботаники, генетики, физиологии растений и биотехнологий ФГБОУ ВПО «Пермская государственная сельскохозяйственная академия имени академика Д.Н. Прянишникова», г. Пермь;
Круглова Н.Н., д.б.н., профессор, заведующая лабораторией экспериментальной эмбриологии растений, заместитель директора по научной работе ФГБУН «Институт биологии Уфимского научного центра РАН», г. Уфа.
Библиографическая ссылка
Дорофеева М.М., Верещагина В.А., Новоселова Л.В. ЭМБРИОЛОГИЧЕСКОЕ ИЗУЧЕНИЕ ИРИСА РОГОЗОЛИСТНОГО (IRIS TYPHIFOLIA KITAG) // Современные проблемы науки и образования. – 2014. – № 6. ;URL: https://science-education.ru/ru/article/view?id=17069 (дата обращения: 18.04.2024).



