В настоящее время актуально получение таких коммерчески значимых продуктов, как органические кислоты, востребованные в процессах получения биодеградируемых пластиков [1].
Так, биодеградируемые материалы на основе молочной кислоты нашли применение в производстве пищевой упаковки одноразового пользования, медицине (получение шовных материалов) и др. [8]. Полимеры на основе фумаровой и янтарной кислот способны заменить традиционно используемые пластики, применяемые, например, для получения одноразовой посуды, поскольку обладают необходимыми механическими и физико-химическими характеристиками и при этом подвергаются микробиологическому разложению [6].
Среди продуцентов молочной и фумаровой кислот наиболее эффективными являются клетки мицелиальных грибов рода Rhizopus [1, 2, 9]. Причём осуществлять секрецию фумаровой кислоты в культуральную жидкость способны только мицелиальные грибы рода Rhizopus [7].
При этом необходимо отметить, что мицелиальные грибы рассматриваются сегодня в качестве весьма перспективных продуцентов различных метаболитов, так как они обладают одновременно способностью к гидролитическому воздействию на субстраты, сложные по химическому составу, благодаря своим экзоферментам [1, 3–5]. Кроме того, они способны осуществлять конверсию в целевые продукты не только гексоз, но и пентоз [10].
Целью данной работы являлось исследование процесса получения фумаровой кислоты под действием клеток мицелиальных грибов.
Материалы и методы исследования
В работе использовались штаммы мицелиальных грибов, полученные из Всероссийской коллекции промышленных микроорганизмов (ВКПМ) и Всероссийской коллекции микроорганизмов (ВКМ). Штаммы не патогенны, хранятся и поддерживаются на картофельно-глюкозном агаре при температуре +5°C.
Концентрация фумаровой кислоты определялась спектрофотометрически с использованием ферментативного диагностического набора («Abcam», Великобритания).
Результаты исследования и их обсуждение
Был проведен скрининг среди штаммов мицелиальных грибов, имеющихся в распоряжении ВКМ и ВКПМ, по способности трансформировать различные моносахара в фумаровую кислоту (табл.1).
Таблица 1
Концентрация фумаровой кислоты (г/л), накапливающейся за 48ч в культуральной жидкости под действием свободных клеток различных штаммов мицелиальных грибов рода Rhizopus, и продуктивность процесса (г/(л×ч)) при использовании различных источников углерода (исходная концентрация – 50 г/л) и одинаковой исходной концентрацией спор (107 спор/мл)
|
Штамм |
Концентрация фумаровой кислоты, г/л Источник углерода: |
Продуктивность процесса, г/(л×ч) Источник углерода: |
||||||||
|
Глюкоза |
Фруктоза |
Ксилоза |
Арабиноза |
Фруктоза: Глюкоза (3:1) |
Глюкоза |
Фруктоза |
Ксилоза |
Арабиноза |
Фруктоза: |
|
|
R. oryzae F1032 |
19,6±1,0 |
18,1±0,9 |
8,0±0,4 |
7,2±0,4 |
19,0±1,0 |
0,41±0,02 |
0,38±0,02 |
0,17±0,01 |
0,15±0,01 |
0,40±0,02 |
|
R. delemar F1146 |
16,2±0,8 |
14,7±0,7 |
7,5±0,4 |
5,4±0,3 |
15,9±0,8 |
0,34±0,02 |
0,31±0,01 |
0,16±0,01 |
0,11±0,01 |
0,33±0,02 |
|
R. oryzae F1026 |
16,9±0,8 |
14,5±0,7 |
7,8±0,4 |
6,9±0,3 |
16,6±0,8 |
0,35±0,02 |
0,30±0,01 |
0,16±0,01 |
0,14±0,01 |
0,35±0,02 |
|
R. oryzae F1127 |
17,6±0,9 |
15,4±0,8 |
7,6±0,4 |
6,2±0,3 |
16,8±0,8 |
0,37±0,02 |
0,32±0,02 |
0,16±0,01 |
0,13±0,01 |
0,35±0,02 |
|
R. oryzae F829 |
17,3±0,9 |
16,2±0,8 |
7,4±0,4 |
6,3±0,3 |
17,0±0,9 |
0,36±0,02 |
0,34±0,02 |
0,15±0,01 |
0,13±0,01 |
0,35±0,02 |
|
R. oryzae F814 |
3,0±0,2 |
3,5±0,2 |
1,2±0,1 |
1,7±0,1 |
3,3±0,2 |
0,06±0,00 |
0,07±0,00 |
0,03±0,00 |
0,04±0,00 |
0,07±0,00 |
|
R. oryzae F841 |
5,4±0,3 |
4,7±0,2 |
2,6±0,1 |
1,8±0,1 |
5,3±0,3 |
0,11±0,01 |
0,10±0,00 |
0,05±0,00 |
0,04±0,00 |
0,11±0,01 |
Известно, что для получения фумаровой кислоты используется двустадийный процесс: 1 – накопление жизнеспособной грибной биомассы, продуцирующей фумаровую кислоту, на богатой питательной среде; 2 – накопление фумаровой кислоты в питательных средах, лимитированных по источнику азота и фосфора, в результате культивирования накопленной биомассы продуцента [7].
На первой стадии для накопления биомассы исследованных продуцентов использовалась богатая питательная среда на основе солода [1], позволяющая накопить максимальное количество биомассы продуцента за 24 часа (табл. 1).
Далее равное количество биомассы каждого продуцента – 300 г/л вносилось в питательные среды различного состава, содержащие стандартный набор солей [1] и по 50 г/л соответствующего источника углерода. При этом помимо различных моносахаридов с шестью и пятью атомами углерода, для проведения скрининга в качестве источника углерода также использовалась смесь фруктозы и глюкозы, взятых в соотношении 3:1.
На основании полученных результатов для дальнейших экспериментов был выбран штамм R. oryzae F1032, показавший максимальный результат при трансформации моносахаридов в фумаровую кислоту.
Необходимо было подобрать оптимальную исходную концентрацию углевода в питательной среде, которая, с одной стороны, позволит накопить максимальное количество фумаровой кислоты в культуральной жидкости, а с другой – будет приближена к концентрации углеводов, характерной для ферментативных гидролизатов непищевого возобновляемого сырья.
Для исследования влияния исходной концентрации субстрата на продуктивность периодического процесса получения фумаровой кислоты использовались синтетические питательные среды, содержащие необходимый набор солей и глюкозу или фруктозу, а также их смесь «фруктоза: глюкоза» = 3:1, соответственно в различной исходной концентрации в среде - от 50 до 120 г/л (рис. 1). Процесс проводился в течение 48 часов.
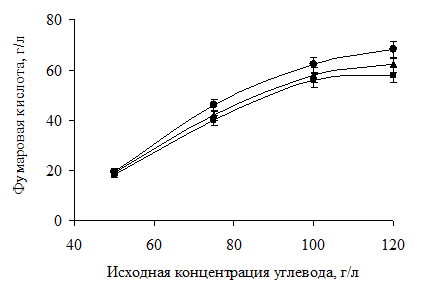
Рис. 1. Влияние исходной концентрации углеводов (● – глюкозы, ■ – фруктозы, ▲ – смеси «фруктоза: глюкоза» в соотношении 3:1) в среде на накопление фумаровой кислоты в культуральной жидкости под действием клеток мицелиального гриба R. oryzae F1032 (300 г/л)
Очевидно, что увеличение исходной концентрации источника углевода от 50 до 120 г/л в питательной среде приводит к увеличению конечной концентрации фумаровой кислоты в культуральной жидкости (рис. 1). Однако данная тенденция не имеет линейного характера во всём исследованном диапазоне концентраций сахаров. Максимальное накопление фумаровой кислоты наблюдается в диапазоне исходных концентраций углеводов 75–100 г/л и составляет 38÷62 %. В этом же диапазоне концентраций наблюдается минимальное снижение выхода фумаровой кислоты. Вероятно, использование концентрации источника углевода в среде ниже 75 г/л приводило к недостатку питательных веществ для клеток, а увеличение концентрации свыше 100 г/л – к ингибированию субстратом или продуктом.
Из всего вышесказанного следует вывод о том, что наиболее предпочтительным для предлагаемого биотехнологического подхода к получению фумаровой кислоты является использование сред, содержащих моносахариды в концентрации 100 г/л.
Было необходимо установить продолжительность процесса получения фумаровой кислоты. В этой связи была исследована кинетика этого процесса с использованием различных моносахаридов (рис. 2, табл. 2).

Рис. 2. Кинетика накопления фумаровой кислоты при трансформации различных углеводов (● – глюкозы, ■ – фруктозы, ▲ – смеси фруктоза: глюкоза в соотношении 3:1) под действием клеток мицелиального гриба R. oryzae F1032 (300 г/л)
Таблица 2
Характеристики процесса получения фумаровой кислоты под действием клеток гриба R. oryzae при варьировании исходной концентрации углеводов в питательной среде
|
Исходная концентрация углевода, г/л |
Глюкоза |
Фруктоза |
Фруктоза: |
|||
|
Выход, % |
Продуктивность |
Выход, % |
Продуктивность |
Выход, % |
Продуктивность |
|
|
50 |
60,9±3,0 |
0,41±0,02 |
56,2±2,8 |
0,38±0,02 |
59,0±3,0 |
0,40±0,02 |
|
75 |
95,2±4,8 |
0,96±0,05 |
82,8±4,1 |
0,83±0,04 |
87,0±4,3 |
0,88±0,04 |
|
100 |
96,3±4,8 |
1,29±0,06 |
87,0±4,3 |
1,17±0,06 |
90,1±4,5 |
1,21±0,06 |
|
120 |
88,0±4,4 |
1,42±0,07 |
75,1±3,8 |
1,21±0,06 |
80,2±4,0 |
1,29±0,06 |
Из полученных данных стало очевидным то, что процесс получения фумаровой кислоты из всех исследованных моносахаридов необходимо проводить в течение, как минимум, 48 часов при исходной концентрации клеток в среде 300 г/л.
Таким образом, в результате проведенных исследований можно сделать следующие основные выводы:
- для проведения селективного отбора продуктивного штамма-продуцента фумаровой кислоты концентрация источника углеводов должна составлять 100 г/л;
- в качестве источников углерода для проведения селективного отбора продуктивного штамма-продуцента фумаровой кислоты необходимо использовать те моносахариды и их смеси, которые характерны для гидролизатов предполагаемого к использованию полисахаридсодержащего возобновляемого сырья;
- для проведения селективного отбора продуктивного штамма-продуцента фумаровой кислоты процесс накопления фумаровой кислоты должен проводиться в течение 48 часов при введении в среду биомассы клеток исследуемой культуры в концентрации 300 г/л;
- для получения фумаровой кислоты необходима определённая концентрация биомассы клеток, которая должна накапливаться за максимально короткий промежуток времени, поэтому необходима оценка кинетики роста, максимальный выход биомассы, понимание её продуктивности по фумаровой кислоте, а не продуктивность процесса;
- на данном этапе проведенный скрининг выявил в качестве наиболее продуктивной культуры – продуцента фумаровой кислоты штамм R. oryzae F1032.
Работа выполнена при финансовой поддержке Минобрнауки РФ в рамках ФЦП «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014–2020 годы» (уникальный идентификационный номер проекта RFMEFI60714X0050) по результатам исследований с использованием оборудования ЦКП «Прикладные биотехнологии» и УНУ «ВКМ» и «ВКПМ».
Рецензенты:
Еремеев Н.Л., д.х.н., профессор, ФГОУ ВПО Московский государственный университет имени М.В. Ломоносова, химический факультет, г. Москва;
Попов В.О., д.х.н., ФГБУН Институт биохимии им. А.Н. Баха Российской академии наук, г. Москва.
Библиографическая ссылка
Ефременко Е.Н., Ефременко Е.Н., Сенько О.В., Сенько О.В., Маслова О.В., Степанов Н.А., Степанов Н.А., Лягин И.В., Лягин И.В., Ефременко Е.Н., Сенько О.В., Маслова О.В., Степанов Н.А., Лягин И.В., Илушка И.В. ИССЛЕДОВАНИЕ ПРОЦЕССА ПОЛУЧЕНИЯ ФУМАРОВОЙ КИСЛОТЫ ПОД ДЕЙСТВИЕМ КЛЕТОК МИЦЕЛИАЛЬНОГО ГРИБА RHIZOPUS ORYZAE // Современные проблемы науки и образования. – 2015. – № 2-1. ;URL: https://science-education.ru/ru/article/view?id=17155 (дата обращения: 19.04.2024).



