Искусственные гипотермические состояния широко используются в клинической практике. Наиболее часто гипотермию применяют для защиты мозга и сердца от последствий ишемии и инсульта [11]. В этом плане наиболее эффективной оказалась умеренная (30-34ºС) гипотермия. Наши исследования показали, что у крыс кратковременная умеренная гипотермия (30ºС) без анестезии (аналог непреднамеренной гипотермии) способствует развитию холодового стресса и активации свободнорадикальных процессов в крови [5]. В условиях in vivo циркулирующие эритроциты постоянно испытывают влияние активных форм кислорода (АФК), образующихся как в самой клетке, так и в плазме крови [10]. Внутри эритроцитов аутоокисление гемоглобина в метгемоглобин приводит к образованию супероксидного анион-радикала. Источниками внеклеточных АФК служат гранулоциты, макрофаги, другие метаболически активные клетки крови, клетки эндотелия сосудов, которые образуют пероксид водорода и супероксид анион-радикал. Окислительные модификации белков и липидов мембраны могут привести к существенному изменению структурно-функциональных свойств эритроцитов.
Недавно показано [2], что независимо от глубины (ректальную температуру снижали до 32,5°С, 27,5°С и 16,5°С) и способа достижения гипотермии (краниоцеребральная, общая и общая в условиях гипоксии-гиперкапнии) у крыс наблюдается повышение осмотической хрупкости эритроцитов и усиливается их гемолиз. В то же время неизвестно, как изменяется осмотическая стойкость эритроцитов от длительности умеренной гипотермии. Данные научной литературы свидетельствуют о том, что степень осмотической резистентности эритроцитов зависит от концентрации тиоловых групп в белках мембран, особенно, белке полосы 3 [15]. Целью данной работы явилось изучение зависимости осмотической резистентности эритроцитов крыс и концентрации SH-групп белков их мембраны от длительности умеренной гипотермии.
Методы исследования
Опыты проведены на половозрелых лабораторных белых крысах-самцах массой 180-200 г. Для снижения температуры тела крыс помещали в пеналы из плексигласа, в рубашке которых циркулировала холодная вода. Температуру тела крыс снижали в течение 30 мин. до 30°С (кратковременная умеренная гипотермия), а в следующих сериях экспериментов эту температуру тела поддерживали в течение 90 и 180 мин. (пролонгированная умеренная гипотермия). После декапитации животного собирали кровь в пробирку с гепарином (50 ед/мл). Эритроциты осаждали центрифугированием при 2000 об/мин в течение 10 мин., а затем трижды промывали физиологическим раствором при 4°С. Отмытые эритроциты гемолизировали в 10 мМ трис-HCl буфере рН 7,4, содержащем 1,5 мМ ЭДТА [1]. Тени эритроцитов осаждали при 20000 g в течение 20 мин при 4°С, а затем пятикратно отмывали 10 мМ трис-HCl буфером рН 8,2. Белые тени эритроцитов хранили при -70°С до использования.
Белок полосы 3 из теней эритроцитов экстрагировали 9 объемами 0,1 моль/л NaOH в течение 30 мин при 4°С [15]. Нерастворимую фракцию, содержащую белок полосы 3, собирали путем центрифугирования при 56000g в течение 30 мин при 4°С.
Содержание SH-групп в общих белках мембран эритроцитов и в белке полосы 3 измеряли колориметрическим методом как описано [8]. К 1,5 мл буфера рН 8,0 (0,08 моль/л фосфата натрия, 0,5 мг/мл Na2-ЭДТА и 2% додецилсульфата натрия) добавляли 0,2 мл суспензии мембран, содержащей 120 мкг белка. После перемешивания добавляли 0,1 мл 5,5'-дитио-бис (2-нитробензойной кислоты) (DTNB; 20 мг в 10 мл 0,1 моль/л натрий-фосфатного буфера рН 8,0). Через 15 мин измеряли поглощение при 412 нм, используя эквивалентную концентрацию белка в качестве контроля. Концентрацию SH-групп рассчитывали, используя молярный коэффициент поглощения, равный 13600 (моль/л)-1 см-1. Белок в мембранах определяли методом Лоури.
Осмотическую резистентность эритроцитов определяли по устойчивости клеток к гипотоническим растворам натрия хлорида. 25 мкл эритроцитов добавляли в серии пробирок, содержащих 2,5 мл растворов с различными концентрациями NaCl (от нуля до 0,9 г/100 мл в 5 ммоль/л фосфатного буфера, рН 7,4) с шагом 0,05 г/100 мл. Пробы инкубировали при 37°C в течение 30 минут. Гемолиз останавливали путем добавления равного объема растворов соответствующих концентраций хлорида натрия, необходимых для восстановления изотоничности. Пробы центрифугировали при 3000 g в течение 10 минут. Оптическую плотность супернатанта определяли при 540 нм (максимум поглощения гемоглобина) против дистиллированной воды при толщине слоя раствора 1 см, используя спектрофотометр СФ-46. Процент гемолиза эритроцитов (X) рассчитывали относительно первой пробы, где отсутствовал NaCl (100% гемолиз) по формуле:
X=(Eо/Emax)·100,
где Ео – экстинкция исследуемой пробы, Еmax – экстинкция, соответствующая 100% гемолизу, X – процент гемолиза.
Для количественной оценки осмотической резистентности эритроцитов использовали величину осмотичности, соответствующую гемолизу 50% клеток (С50), – центр распределения эритроцитов по осмотической резистентности.
Данные в таблице приведены в виде среднее ± ошибка среднего. Достоверность различий определяли с помощью t-критерия Стьюдента.
Результаты и их обсуждение
Результаты наших исследований показали, что при гипотермии осмотическая резистентность эритроцитов изменяется. При этом степень изменений зависела от длительности гипотермии. При кратковременной гипотермии осмотическая хрупкость эритроцитов возрастает (рисунок). При этом наблюдается не только сдвиг эритрограммы вправо, но даже в изотонических условиях происходит 10% гемолиз эритроцитов. Наибольшее и достоверное снижение осмотической резистентности эритроцитов происходит через 90 мин гипотермии. Об этом свидетельствует не только правый сдвиг кривой гемолиза на эритрограмме, но и достоверное повышение значения осмотичности, соответствующее лизису 50% клеток С50 (табл. 1). Как видно (рисунок, табл. 1), через 180 мин гипотермии осмотическая резистентность эритроцитов повышается до уровня контроля.
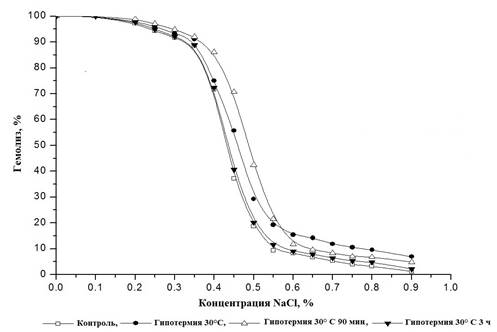
Осмотическая резистентность эритроцитов крыс при гипотермии
Таблица 1
Величина осмотичности, соответствующая гемолизу 50% клеток (С50) при гипотермии (M±m; n = 8)
|
Состояние животного |
С50, % |
|
Контроль |
0,431±0,091 |
|
Гипотермия 30 мин сразу |
0,460±0,018 |
|
Гипотермия 30°С через 90 мин |
0,481±0,012 Р<0.001 |
|
Гипотермия 30°С через 180 мин |
0,436±0,024 |
Здесь и на табл. 2 Р – достоверное различие относительно контроля
Таким образом, пролонгирование умеренной гипотермии в течение 90 мин. приводит к повышению осмотической хрупкости эритроцитов, а пролонгирование до 180 мин. способствует снижению их осмотической хрупкости. Известно, что осмотическая хрупкость эритроцитов зависит от их формы и отношения площади поверхности к объему клетки. Повышение осмотической хрупкости эритроцитов после 90 мин. гипотермии, видимо, связано с существенным снижением доли дискоцитов и ростом количества измененных форм эритроцитов (стомато- и сфероцитов) [4], которые обладают наименьшей осмотической стойкостью [2]. Снижение осмотической хрупкости после 3-х ч гипотермии, вероятно, связано с увеличением в периферической крови дискоцитов, особенно за счет уплощенных форм, являющихся более стойкими к факторам гемолиза [2]. Форма эритроцитов зависит от структурно-функциональных свойств мембраны и их проницаемости для ионов. В исследованиях in vitro показано, что инкубация эритроцитов с оксидантами (Н2О2, аскорбат/Fe2+) приводит к окислительной модификации липидов и белков мембран, трансформации клеток в эхиноциты и повышению их осмотической хрупкости [13]. Эти данные позволяют предположить, что активация процессов окислительных повреждений мембраны эритроцитов может быть ведущей причиной повышения осмотической хрупкости эритроцитов после 90 мин. пролонгирования гипотермии. Ранее нами было установлено, что после 180 мин гипотермии существенно снижается степень окислительной модификации липидов и белков мембраны эритроцитов, а также значительно возрастает в эритроцитах уровень восстановленного глутатиона и активность ключевого антиоксидантного фермента – супероксиддисмутазы [3]. Очевидно, повышение клеточной антиоксидантной защиты после 180 мин. гипотермии способствует снижению осмотической хрупкости эритроцитов.
Одним из важных интегральных белков мембраны эритроцитов является белок полосы 3, на долю которого приходится 25% от общего количества мембранных белков. Он занимает до 10% поверхности клеточной мембраны. Этот анионный транспортер связывает белки цитоскелета с мембраной эритроцитов, а также является основным местом, где гемоглобин и гликолитические ферменты связываются с мембраной эритроцитов [6]. Как показали Ксай и сотр. [15], редокс-состояние тиоловых групп белков мембран, в том числе и белка полосы 3, оказывает существенное влияние на осмотическую хрупкость эритроцитов. Существует ли такая связь при гипотермии?
Анализ содержания SH-групп показал, что при кратковременной гипотермии их концентрация, как в общих белках, так и в белке полосы 3, снижается (табл. 2). Через 90 мин. гипотермии количество SH-групп в общих белках мембраны эритроцитов снижается на 16,4%, а в белке полосы 3 – на 28,8% относительно контроля. После пролонгированной в течение 180 мин. гипотермии содержание тиоловых групп, как в общих белках мембраны эритроцитов, так и в белке полосы 3, повышается до контрольного уровня.
Таблица 2
Содержание тиоловых групп (нмоль/мг белка) в белках мембран эритроцитов
при гипотермии (M±m; n = 8)
|
Состояние животного |
Содержание SH-групп в общих белках мембран |
Содержание SH-групп в белке полосы 3 |
|
Контроль |
79,16±4,34 |
54,82±3,77 |
|
Кратковременная гипотермия |
69,19±3,12 |
46,68±2,03 |
|
Пролонгированная 90 мин гипотермия |
66,19±1,69 Р<0,02 |
39,01±1,89 Р<0,02 |
|
Пролонгированная 180 мин гипотермия |
76,23±0,56 |
53,13±0,43 |
Оксиданты и алкилирующие агенты способны модифицировать тиоловые группы белков мембран. In vivo окисление тиловых групп мембранных белков происходит, в основном, под действием пероксида водорода [9]. В условиях окислительного стресса уменьшение доступных SH-групп и образование дисульфидных мостиков может привести к повышению доли агрегированных мембранных белков эритроцитов, что снижает упруго-эластические свойства мембраны и общей деформируемости эритроцитов [14]. Показано [7], что окисление тиоловых групп белков эритроцитарных мембран может увеличить их проницаемость для таких ионов, как К+, Na+ и Ca2+. Белок полосы 3 является анионным переносчиком, но может регулировать поступление воды и, следовательно, осмотический баланс эритроцитов. Конформационные изменения белка полосы 3 могут вызывать значительные изменения формы эритроцита, а также их осмотической хрупкости [12].
Следует отметить, что изменение содержания тиоловых групп в белках мембраны эритроцитов в динамике умеренной гипотермии полностью коррелирует с изменением осмотической хрупкости эритроцитов (r = – 0,950). Это свидетельствует о том, что изменение осмотической хрупкости эритроцитов в динамике гипотермии прямо зависит от состояния тиоловых групп белков мембраны эритроцита. Важным результатом работы является тот факт, что пролонгирование гипотермии в течение 3-х ч. способствует нормализации как осмотической стойкости эритроцитов, так и количества тиоловых групп в белках мембраны эритроцитов. Это свидетельствует о том, что у гомойотермных организмов при пролонгировании гипотермии могут включиться механизмы адаптивных перестроек метаболических процессов на уровне отдельных клеток.
Рецензенты:
Омаров К.З., д.б.н., зав. лаб. зоологии животных, ФГБУН «Прикаспийский институт биологических ресурсов Дагестанского научного центра Российской академии наук», г. Махачкала;
Габибов М.М., д.б.н., профессор, зав. каф. анатомии, физиологии, гистологии ДГУ, ФГБОУ ВПО «Дагестанский государственный университет», г. Махачкала.
Библиографическая ссылка
Аль-Рабии М.А.М., Чалабов Ш.И., Астаева М.Д., Кличханов Н.К. ОСМОТИЧЕСКАЯ РЕЗИСТЕНТНОСТЬ ЭРИТРОЦИТОВ КРЫС И КОНЦЕНТРАЦИЯ ТИОЛОВЫХ ГРУПП БЕЛКОВ ИХ МЕМБРАНЫ ЗАВИСЯТ ОТ ДЛИТЕЛЬНОСТИ УМЕРЕННОЙ ГИПОТЕРМИИ // Современные проблемы науки и образования. – 2015. – № 3. ;URL: https://science-education.ru/ru/article/view?id=17364 (дата обращения: 19.04.2024).



