Нестероидные противовоспалительные препараты (НПВП) относятся к числу наиболее распространенных лекарственных средств, часто назначаемых врачами для лечения различных заболеваний у пациентов всех возрастных групп [14]. Также нестероидные противовоспалительные препараты относятся к числу наиболее распространенных лекарственных средств, назначаемых ветеринарными врачами для лечения различных заболеваний домашних и сельскохозяйственных животных [12, 19].
Вопрос обезболивания домашних животных возникает перед врачом не только во время оперативного вмешательства, но и в послеоперационный период, при травмах и заболеваниях, сопровождающихся болью. Эффективное устранение острой боли у животных в домашних условиях чрезвычайно затруднено из-за невозможности назначать и применять животным наркотические анальгетики (морфин, фентанил, промедол и др.), являющиеся наиболее мощными препаратами для купирования боли.
В настоящее время в РФ для применения животным доступно несколько препаратов из группы НПВП. Большая часть этих лекарственных средств предназначена для лечения людей. Традиционно назначаемыми медикаментами из этой группы являются: метамизол натрий (Metamizole sodium) – анальгин, Баралгин, Максиган; ацетилсалициловая кислота (Acetylsalicylic acid) – Аспирин; ацетаминофен (Панадол, Парацетамол); индометацин (Indometacin) – Метиндол; диклофенак (Diclofenac) – Вольтарен, Диклонат П, Ортофен; кеторолак (Ketorolac) – Кеторол, Кетродол; кетопрофен (Ketoprofen) – Кетонал; ведапрофен – Квадрисол; карпрофен – Римадил. К специальным НПВП, предназначенныем эксклюзивно для мелких домашних животных, относится ведапрофен (квадрисол), кетопрофен (кетофен) и карпрофен (римадил) [1].
Все перечисленные препараты обладают анальгетическим эффектом различной силы [1 , 9]. К побочным эффектам НПВП относятся нарушения функции печени, почек, гематологические реакции, НПВН-ассоциированные патологии ЦНС [8, 6, 3].
Общеизвестно, что прием НПВП приводит к развитию патологии желудочно-кишечного тракта через неделю после начала лечения практически в 100% случаев [2]. НПВП–гастропатия является важнейшей патологией, ассоциированной с НПВП [5].
Вместе с тем, не менее важна другая НПВП-ассоциированная патология пищеварительной системы – поражение печени в форме НПВП-ассоциированного гепатита – и поражение поджелудочной железы – в форме НПВП-ассоциированного панкреатита – у людей и животных.
В последнее время в специальной литературе появляется все больше работ, посвященных вопросам гепатотоксичности НПВП [16, 18, 20]. При этом разные исследователи пришли к неоднозначным выводам: так, некоторые авторы утверждают, что взаимосвязь между применением НПВП и заболеваниями печени еще недостаточно документирована; частота поражения печени при этом очень низка и относительно незначительна по сравнению с риском возникновения НПВП-гастропатий [3].
Тем не менее, на сегодняшний день все больше специалистов приходят к выводу о несомненной взаимосвязи НПВН и гепатотоксичности; в литературе чаще стали появляться сообщения о поражениях печени на фоне приема препаратов данной группы, которые колеблются от бессимптомных форм, склонных к спонтанному разрешению, до фульминантного гепатита, который без экстренной трансплантации печени приводит к гибели больного [4].
В настоящее время большое внимание уделяется вопросу гепатотоксичности нимесулида [20], ибупрофена [18], диклофенака натрия (вольтарена) [6, 13], рофекоксиба [16], сулиндака и индометацина [17].
В патогенезе НПВП-ассоциированного поражения печени обсуждается роль блокады ферментных систем цикла Кребса и разобщения окислительного фосфорилирования (по типу синдрома Рейе) в митохондриях гепатоцитов [7], блокады фосфодиэстеразы IV, нарушения экскреции желчи вследствие образования объемных комплексов метаболитов НПВП с желчными кислотами, энтеропеченочной рециркуляции НПВП, а также иммунологических нарушений [11, 10].
Клинические и экспериментальные исследования показывают, что как иммунологические, так и идиосинкратические реакции могут участвовать в патогенезе вызываемых селективными НПВП поражений печени [15]. Возможно, что в процессе дезорганизации цитолемма гепатоцита приобретает антигенные свойства, что приводит к индукции аутоиммунного ответа и морфологически проявляется как перипортальный отек и мононуклеарная инфильтрация [4].
Недавние лабораторные исследования на животных способствовали определенному прогрессу в понимании механизмов НПВП-гепатотоксичности, но в настоящее время требуется проведение дальнейших исследований для полного представления патогенеза этого явления, что обеспечит лучшее понимание факторов риска и патофизиологии этого явления [15], а, следовательно, будет способствовать разработке путей направленной патогенетической коррекции НПВП-ассоциированного гепатита.
Материалы и методы. Моделирование НПВП-индуцированного поражения печени у нелинейных белых крыс осуществлялось пероральным введением нимесулида (Найз®) в течение 21 дня на фоне обычного пищевого режима за 1 час до кормления в следующих дозировках: 0,5 мг/кг (терапевтическая доза, n=10), 2,5 мг/кг (n=10) и 5 мг/кг (n=10). Контрольную группу составили 10 интактных животных.
Все эксперименты выполнены в соответствии с «Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях» от 18.III.1986 (Текст изменен в соответствии с положениями Протокола (ETS № 170), после его вступления в силу 2 декабря 2005 года; Лиссабонский договор о внесении изменений в Договор о Европейском союзе и Договор об учреждении Европейского сообщества вступили в силу 1 декабря 2009 года) и «Правилами проведения работ с использованием экспериментальных животных» [Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 г. N 755].
В течение эксперимента осуществляли ежедневное наблюдение за животными – оценка активности, внешнего вида, аппетита, физиологических функций. По окончании эксперимента проводили забор образцов ткани печени под эфирным наркозом с соблюдением правил эвтаназии. Гистологическое исследование выполнено стандартными методиками [8]. Результаты, полученные при проведении гистологического исследования образцов тканей, полученных от животных экспериментальных групп, сравнивали с результатами, полученными при исследовании биоматериала, полученного от животных контрольной группы, используя критерий х2. Критический уровень значимости при проверке статистических гипотез принимали равным p<0,05.
Результаты и их обсуждение. При гистологическом исследовании печени животных контрольной группы (n=10) ткань печени представлена дольками, имеющими правильную гексагональную форму. В центре долек визуализируются центральные вены, часть которых заполнена кровью. Дольки печени состоят из радиально расположенных печеночных балок, представляющих собой анастомозирующие тяжи печеночных клеток. В печени крысы междольковая соединительная ткань развита слабо, границы между дольками прослеживаются нечетко. Между печеночными балками видны синусоидные капилляры печени, выстланные эндотелиальными клетками. Большинство гепатоцитов одноядерные. В них четко выявляется однородно окрашенное ядро и гомогенная цитоплазма розового цвета. При микроскопии препаратов обнаруживаются и двуядерные гепатоциты – в небольшом количестве. Между дольками выявляются типичного строения триады и собирательные вены.
При гистологическом исследовании ткани печени крыс, которым вводили перорально нимесулид в терапевтической дозе – 0,5 мг/кг (I экспериментальная группа, n=10), у всех животных отмечалось полнокровие центральных вен и расширение синусоидных капилляров (рис. 1). У части животных (60%) наблюдались ограниченные участки зернистой дистрофии гепатоцитов в паренхиме органа, у одного животного (20%) – ограниченные участки вакуольной дистрофии гепатоцитов. Некрозы и очаги регенерации в паренхиме печени выявлены у двух животных (40%); инфильтрация портальных трактов клетками крови – у одного животного (20%).
В группе у крыс, получавших нимесулид в дозировке 2,5 мг/кг, превышающей терапевтическую дозу в 5 раз (II экспериментальная группа, n=10), во всех случаях (100%) в паренхиме печени выявлено полнокровие центральных вен, расширение и полнокровие синусоидных капилляров, очаги зернистой дистрофии разного размера выявлялись также у всех животных группы, у 50% – вакуольная дистрофия гепатоцитов. У 50% животных этой группы выявлены обширные очаги некроза с регенерацией, сопровождающиеся появлением большого количества двуядерных и гипертрофированных гепатоцитов, у 25% – очаги инфильтрации портальных трактов клетками крови.
У крыс, получавших нимесулид в дозе 5 мг/кг и превышающей терапевтическую в 10 раз (III экспериментальная группа, n=12) при микроскопии препаратов в 100% случаев отмечалось полнокровие центральных вен, сосудов триад и расширение и полнокровие синусоидных капилляров. В большинстве гепатоцитов выявлялись морфологические признаки белковой (зернистой – у 100% животных, и вакуольной – у 83,33% животных группы) дистрофии, отмечались также некрозы паренхимы печени и появление большого количества двуядерных клеток – в основном, по периферии зон некроза. В ряде случаев (58,33%) в паренхиме печени визуализировались междольковые и перипортальные инфильтаты, представленные клетками крови, в основном, идентифицируемыми при световой микроскопии как лимфоциты (рис. 1). Выявленные изменения требуют дальнейшего изучения с применением современных методов гистологической диагностики.
В целом, изменения в ткани печени у животных опытных групп выглядели следующим образом (табл. 1; рис. 2).
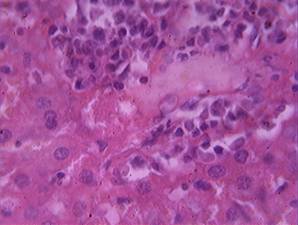
Рис. 1. Перипортальная инфильтрация в ткани печени крысы, вакуольная дистрофия и некрозы гепатоцитов, двуядерные клетки.
Окраска гематоксилином и эозином х 600
Таблица 1
Патоморфологические изменения в паренхиме печени у животных экспериментальных групп при приеме нимесулида
|
Признак |
Доза 0,5 мг/кг, % животных в группе |
Доза 2,5 мг/кг, % животных в группе |
Доза 5,0 мг/кг, % животных в группе |
|
Полнокровие центральных вен |
100 |
100 |
100 |
|
Расширение синусоидных капилляров |
100 |
100 |
100 |
|
Зернистая дистрофия |
60 |
100* |
100* |
|
Вакуольная дистрофия |
20 |
50* |
83,33* |
|
Некрозы |
40 |
50 |
100* |
|
Двуядерные клетки |
40 |
50 |
100* |
|
Инфильтрация паренхимы печени |
20 |
25 |
58,33* |
*p<0,05 по отношению к терапевтической дозе (0,5 мг/кг)
Метод статистического анализа – критерий х2

Рис. 2. Патоморфологические изменения в паренхиме печени у животных экспериментальных групп при приеме нимесулида
Выводы:
1. При пероральном приеме нимесулида в течение 21 дня в ткани печени экспериментальных животных отмечались патоморфологические изменения, характерные для токсического поражения органа: расширение синусоидных капилляров, очаги дистрофии и некрозов; при этом отмечался дозозависмый эффект.
2. У животных, получавших перорально нимесулид в течение 21 дня, в ткани печени выявлены лимфоцитарные инфильтраты; частота их обнаружения также возрастала по мере увеличения дозы препарата; выявленные изменения требуют дальнейшего изучения и трактовки.
Рецензенты:
Аксенова В.М., д.б.н., профессор, «Пермская Государственная сельскохозяйственная академия им. Д.Н. Прянишникова», г. Пермь;
Татарникова Н.А., д.в.н., профессор, «Пермская Государственная сельскохозяйственная академия им. Д.Н. Прянишникова», г. Пермь.
Библиографическая ссылка
Лазаренко л.в., Косарева П.В., Самоделкин Е.И., Хоринко В.П. ПАТОМОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ ТКАНИ ПЕЧЕНИ КРЫСЫ ПРИ ДЛИТЕЛЬНОМ ПРИЕМЕ НИМЕСУЛИДА // Современные проблемы науки и образования. – 2015. – № 3. ;URL: https://science-education.ru/ru/article/view?id=19580 (дата обращения: 17.04.2024).



