Актуальность изучения преэклампсии (ПЭ) определяется высокой частотой данного осложнения беременности. Ежегодно в мире регистрируется 8,5 млн случаев ПЭ [7,9]. ПЭ развивается у 6-12% здоровых беременных и у 20-40% женщин, имеющих экстрагенитальную патологию [1]. По данным Министерства здравоохранения Российской Федерации, ПЭ занимает 3 место в структуре причин материнской смертности. Ежегодно в мире от ПЭ и эклампсии погибает 50 000 женщин [8]. Перинатальные потери при ПЭ в 4 раза превышают таковые у женщин с неосложненным течением беременности [6]. Перинатальная заболеваемость при данном осложнении беременности также не имеет стойкой тенденции к снижению. После перенесенной ПЭ увеличивается риск развития отслойки плаценты, массивных кровотечений, плацентарной недостаточности и задержки роста плода [2].
В настоящее время существует множество теорий, объясняющих причины возникновения преэклампсии: эндотелиальная, нейрогенная, гормональная, иммунологическая, плацентарная, генетическая и др. [3]. Установлено, что основа для развития ПЭ закладывается на ранних стадиях беременности и характеризуется системной дисфункцией эндотелия. Следовательно, развитие гестационного эндотелиоза является ведущим звеном патогенеза преэклампсии.
Ряд авторов указывает на дисбаланс ангиогенных факторов, как возможную причину ПЭ. Исследователями было доказано, что нарушения ангиогенеза, сопровождающиеся неполноценностью первой и второй волн инвазии цитотрофобласта, приводят к формированию плацентарной недостаточности и развитию преэклампсии [8, 10].
В доступной литературе на сегодняшний день достаточно полно представлена информация об особенностях структурной перестройки в плаценте при беременности, осложненной ПЭ. Определены механизмы развития острых и хронических расстройств маточно-плацентарного кровообращения, детализированы варианты нарушений созревания ворсинчатого хориона, выявлены особенности воспалительных и дистрофических изменений в плаценте. Дана подробная характеристика процессов адаптации и компенсации при данном осложнении беременности. Показано, что соотношение общепатологических процессов и компенсаторных реакций в плаценте определяет стадию плацентарной недостаточности.
Следует подчеркнуть, что наряду с этиопатогенетическими моментами выраженность и распространенность патологических изменений в плаценте зависят от тяжести ПЭ. Исходя из этого, целью проведенного исследования явилось определение патоморфологических изменений в плацентах женщин при беременности, осложненной ПЭ средней тяжести и тяжелой.
Материалы и методы
В соответствии с целью исследования изучены патоморфологические особенности плацент при различной степени тяжести ПЭ. В первую группу (I гр.) включены плаценты от 25 женщин при беременности, осложненной ПЭ средней тяжести. Во вторую группу объединена 21 плацента при тяжелой ПЭ (II гр.). Группу контроля (III гр.) составили 19 плацент от женщин при беременности неосложненной ПЭ со сроком гестации – 39 нед. 6 дней. Забор плацент осуществлялся в акушерской клинике ФГБУ «Ивановский НИИ материнства и детства В.Н. Городкова» МЗ РФ. С плацентарной ткани, фиксированной в 10% растворе нейтрального формалина, после стандартной парафиновой проводки готовились срезы, окрашивались гематоксилином Эрлиха и эозином. Комплексная оценка структурных особенностей плацент включала макроскопическую диагностику, органометрию и обзорную гистологию. Обработка полученных результатов проводилась на персональном компьютере с помощью STATISTICA 6.0.
Результаты исследования и их обсуждение
Возраст женщин группы контроля составил 28,5±5,3 лет. Беременность у женщин данной группы протекала на фоне нейроциркуляторной дистонии (15,8%), миопии (15,8%) и ожирения (5,3%). У 9 женщин диагностирована цервикальная эктопия шейки матки (47,4%). Из воспалительной патологии органов репродуктивной системы в 8 случаях (42,1%) выявлен кольпит, у четырех женщин (21,15%) – аднексит. У восьми пациенток (42,11%) данной группы имела место угроза прерывания беременности ранних сроков. В группе контроля превалировали повторнобеременные женщины. Средняя прибавка массы тела за период беременности составила 11,9±4,4 кг.
Масса и площадь материнской поверхности плацент группы контроля соответствовали аналогичным параметрам гестационной нормы (таблица).
Органометрические параметры плацент женщин с преэклампсией средней тяжести и тяжелой
|
Группы |
Срок беременности (нед) |
Масса плацент, г |
Площадь материнской поверхности, см2 |
Линейные параметры, см |
|
Контроль (п=19) |
39,7 |
511,3 ± 29,7 |
295,8 ± 23,1 |
19,7х17,3 х1,9 |
|
ПЭ средней тяжести (п=31) |
35,1 |
360,6±18,2*х |
206,6 ± 12,5* |
17,1х14,7х1,9 |
|
ТПЭ (п=32) |
33,2 |
287,9 ±0,07* |
185,03 ±11,61* |
16,1х13,1х1,8 |
* - p < 0,0001- достоверное отличие от группы контроля
х - p=0,006 - достоверное отличие от группы ТПЭ
В III гр. преобладали плаценты овальной формы (68,4%) с парацентральным (63,2%) и центральным (21,1%) прикреплением пупочного канатика. Лишь в двух случаях (10,5%) диагностирована неправильная форма провизорного органа. Пуповина в 11 случаях (57,9%) была умеренно извита. Извитость пупочного канатика в 11 последах (57,9%) сочеталась с варикозным расширением пуповинной вены, в 9 (47,4%) – с гипоплазией вартонова студня. На плодовой поверхности 10 плацент (52,6%) обнаружен белесоватый ободок шириной не более 0,5 см и протяженностью на 1/3 длины окружности плаценты.
Из общепатологических процессов в плацентах группы контроля доминировали нарушения материнского и плодового кровотока в виде хронических геморрагических (4 – 21,1%) и ишемических инфарктов (9 – 47,4%), мелкоочагового тромбоза (4 – 21,1%) и стаза (7 – 36,8%) межворсинчатого пространства центральных и суббазальных зон. Хронические геморрагические инфаркты были мелкоочаговыми и локализовались преимущественно в краевых отделах плаценты.
Дистрофические и некротические изменения эпителия ворсин с умеренным и повышенным отложением фибрина диагностированы в 12 (63,2%) и 5 плацентах (36,3%), соответственно. Умеренное отложение фибрина обнаружено в базальной децидуальной оболочке 8 последов (42,1%). В зонах некроза эпителия ворсин 9 плацент выявлены мелкоочаговые отложения солей кальция.
Нарушения плацентарного кровотока инициировали развитие процессов адаптации и компенсации. Гиперплазия терминальных ворсин и капилляров в них диагностированы в 9 плацентах (47,4%), в 11 случаях (57,9%) – гиперплазия синцитиальных почек. Количественное увеличение синцитиокапиллярных мембран выявлено в 26,3% (5) случаев. Из адаптационных процессов в 6 плацентах (31,4%) обнаружено выраженное полнокровие промежуточных и в 4 плацентах (21,1%) - терминальных ворсин.
Средний возраст женщин с ПЭ средней тяжести не отличался от соответствующего параметра группы контроля и составил 28,6±4,8 лет. В данной группе, как и в группе контроля, преобладали повторнобеременные пациентки (17 – 68%). У всех женщин данной группы, в отличие от III гр, беременность завершилась преждевременными родами в сроке гестации 35 нед. и 4 дня., (р<0,05). Из них у 19 женщин (76%) имели место оперативные роды. Данная беременность у 9 женщин (36%, p<0,05) протекала на фоне хронического пиелонефрита, у 6 (20%) – ожирения (p<0,05). Частота воспалительных заболеваний органов репродуктивной системы у женщин при ПЭ средней тяжести не отличалась от таковой в группе контроля. Прибавка массы тела за беременность у женщин с ПЭ средней тяжести составила 12,5±6,2 г и не отличалась от аналогичного показателя в группе контроля. Антропометрические параметры новорожденных соответствовали сроку гестации, масса – 2286,9±788,3 г; длина – 45,3±4,9 см.
В группе женщин, беременность которых осложнилась преэклампсией средней тяжести, преобладали плаценты округлой 11 (44%) и овальной 6 (24%) форм с центральным 3 (12%) и парацентральным 16 (64%) прикреплением пуповины. В два раза чаще, в отличие от группы контроля, диагностирована неправильная форма плацент с краевым прикреплением пупочного канатика (6 – 24%), что совпадает с данными И.А.Пановой с соавт., (2009) и Н.И.Киселевой, (2008). По степени извитости пуповины, варикозному расширению пуповинной вены, гипоплазии вартонова студня и по наличию ободка на плодовой поверхности плацент не выявлено достоверных различий по сравнению с III группой. Но в 2 раза чаще, в отличие от группы контроля, по ходу пуповины диагностированы ложные узлы (32%, p<0,05) с гипертрофией вартонова студня и извитым ходом сосудов в них, что составляет структурную основу нарушений пуповинного кровотока.
Средняя масса плацент у женщин данной группы составила 381,1±108,7 г, площадь материнской поверхности – 208,4±57,9 см 2 (табл.). В отличие от группы сравнения в 11 плацентах (44%) диагностировано снижение органометрических параметров. Следует отметить, что суммарно превалировали плаценты с гипоплазией II (27,3%) и III (45,5%) степени тяжести. Доминирование тяжелых форм гипоплазии плацент свидетельствует о нарушении развития плаценты на ранних этапах плацентации.
Из общепатологических процессов в плацентах исследуемой группы так же, как в III гр., доминировали нарушения материнского кровотока в виде хронических геморрагических инфарктов (18 – 72%), ПОНРП (6 – 24%), стаза (14 – 56%) и тромбоза (4 – 16%) межворсинчатого пространства суббазальных и центральных зон. Частота ПОНРП и стаза в 2 раза, а хронических геморрагических инфарктов в 4 раза превышала аналогичный параметр в группе контроля. Данные расстройства материнского кровообращения протекали на фоне незавершенной гестационной перестройки эндометриальных сегментов спиральных артерий в парацентральных и краевых отделах плаценты. Нарушения плодового кровотока в виде ишемических инфарктов диагностированы в 18 плацентах (72%, p<0,05). Дополнительным структурным подтверждением недостаточности фетального кровотока явилась выраженная дилатация и полнокровие вен стволовых ворсин.
Умеренное (40%) и повышенное (36%) отложение фибрина в зонах некроза эпителия ворсин, сопровождающееся по данным Т.А.Колесниковой с соавт. (2011), повышением уровня тканевого тромбопластина и снижением синтеза аннексина V, усиливает реологические нарушения материнского и плодового кровотока при ПЭ [5]. Отложение фибрина в зонах некроза эпителия ворсин в 44% случаев сочетается с мелкоочаговыми петрификатами в некротизированных участках трофобластического эпителия.
Процессы адаптации и компенсации в плацентах при ПЭ средней тяжести, как и в группе сравнения, представлены гиперплазией терминальных ворсин, капилляров в них и синцитиальных почек. Из адаптационных процессов достоверно чаще определялось полнокровие промежуточных и терминальных ворсин (48%, p<0,05). Результатом сопоставления патоморфологических изменений с процессами компенсации и адаптации в плаценте явилась диагностированная в 20% случаев хроническая компенсированная и в 68% субкомпенсированная плацентарная недостаточность.
Женщины, беременность которых осложнилась тяжелой эклампсией, не отличался от пациенток группы контроля по возрасту и паритету родов. Беременность у всех женщин данной группы завершилась преждевременными родами, в т.ч. в 85,7% случаев (р<0,05) оперативными в сроке гестации 33 нед и 3 дня. Из фоновой патологии диагностирован хронический пиелонефрит (52,88%, р<0,001), кольпит (57,14%) и аднексит (4,29%).
Прибавка массы тела за беременность не отличалась от аналогичного параметра в группе контроля и составила 12,2±5,6 кг. Антропометрические параметры новорожденных данной группы были ниже аналогичных показателей гестационной нормы. Задержка роста плода, диагностированная у 66,7% новорожденных данной группы (р<0,05), патогенетически связана со снижением массы (286,9±109,3 г), площади материнской поверхности плаценты (191,5±74,9 см 2, табл.). и высоким процентом (57%) плацент с гипоплазией III ст. Неправильная форма, гипоплазия плацент III ст. и краевое прикрепление пуповины – это результат нарушения имплантации и ранней плацентации [4].
Из общепатологических процессов в плацентах при беременности, осложненной тяжелой ПЭ, также, как и в III гр., доминировали нарушения материнского кровотока, но при этом в 3 раза чаще диагностировались хронические геморрагические инфаркты и в 2 раза чаще – ПОНРП. Характерной особенностью плацент при тяжелой ПЭ явилось снижение компенсаторного резерва плаценты в виде слабо выраженной гиперплазии терминальных ворсин, капилляров и синцитиокапиллярных мембран в них (14,29%). При сопоставлении патологических изменений в плацентах с выраженностью процессов адаптации и компенсации в 100% случаев была диагностирована плацентарная недостаточность: в 10% – острая, в 80% – хроническая субкомпенсированная и в 10% – декомпенсированная.
При сравнении данных акушерско-гинекологического анамнеза и результатов патоморфологического исследования плацент при ПЭ средней тяжести и тяжелой выявлены следующие особенности. Женщины сравниваемых групп сопоставимы по возрасту, паритету родов и по частоте встречаемости такой экстрагенитальной патологии, как ожирение, миопия, нейроциркуляторная дистония, мочекаменная болезнь и хронический пиелонефрит.
Не выявлено достоверных различий среди плацент сравниваемых групп по форме органа и особенностям прикрепления пупочного канатика. В сравниваемых группах в три раза чаще по сравнению с III гр. диагностировано краевое прикрепление пуповины, что совпадает с результатами ранее проведенных исследований и является морфологическим подтверждением нарушений имплантации и ранней плацентации при ПЭ [3].
Органометрические параметры плацент при ПЭ средней тяжести и тяжелой были ниже аналогичных показателей гестационной нормы. Следует подчеркнуть, что при высоком проценте гипоплазий плацент в сравниваемых группах гипоплазия III степени в два чаще (57,14%, р<0,05) диагностировалась при тяжелой ПЭ и сопровождалась в 74% случаев ЗРП.
Среди плацент сравниваемых групп не выявлено достоверных различий по частоте таких общепатологических процессов, как незавершенная гестационная перестройка эндометриальных сегментов спиральных артерий, хронические геморрагические инфаркты, ПОНРП, апоплексия плаценты, стаз, тромбоз межворсинчатого пространства центральных и суббазальных зон. Характерной особенностью плацент при тяжелой ПЭ явилась центральная локализация крупноочаговых (более ¼ площади материнской поверхности плаценты) хронических геморрагических инфарктов и тромбоза межворсинчатого пространства суббазальных зон. Достоверно чаще в плацентах при тяжелой ПЭ диагностировались крупноочаговые некрозы базальной пластинки и эндометриальных сегментов спиральных артерий с распространенными интрабазальными и суббазальными кровоизлияниями, составляющими структурную основу острой плацентарной недостаточности (рис.1).
При анализе процессов адаптации и компенсации в плацентах сравниваемых групп выявлены следующие особенности. Гиперплазии терминальных ворсин, капилляров терминальных ворсин достоверно чаще диагностированы в плацентах при ПЭ средней тяжести (рис. 2). По степени выраженности адаптационных реакций не выявлено достоверных различий в сравниваемых группах.
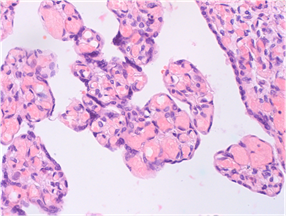
Рис. 1. Плацента 32 недель гестации при беременности, осложненной тяжелой ПЭ. Крупноочаговое кровоизлияние в базальную пластинку. Окраска гематоксилином и эозином, х150.
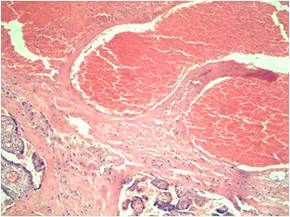
Рис. 2. Плацента 35 недель гестации при беременности, осложненной ПЭ средней тяжести. Гиперплазия и полнокровие капилляров терминальных ворсин. Окраска гематоксилином и эозином, х300.
Заключение
Таким образом, характерными патоморфологическими изменениями в плацентах при беременности, осложненной преэклампсией средней тяжести являются гипоплазия плацент II степени, краевое прикрепление пуповины в сочетании с ложными узлами пупочного канатика, острые и хронические нарушения материнского кровообращения на фоне умеренно сформированных процессов адаптации и компенсации.
К отличительным признакам плацент при тяжелой преэклампсии следует отнести гипоплазию плацент III ст., центральную локализацию нарушений материнского кровотока, крупноочаговый фибриноидный некроз базальной пластинки и спиральных артерий с распространенными интра- и суббазальными кровоизлияниями, составляющими структурную основу острой и хронической декомпенсированной плацентарной недостаточности.
Рецензенты:
Перетятко Л.П., д.м.н., профессор, заведующая лаборатории патоморфологии и электронной микроскопии Федерального государственного бюджетного учреждения "Ивановский научно-исследовательский институт материнства и детства имени В.Н. Городкова" Министерства здравоохранения Российской Федерации, г. Иваново.
Борзова Н.Ю., д.м.н., профессор, главный научный сотрудник отдела акушерства и гинекологии Федерального государственного бюджетного учреждения "Ивановский научно-исследовательский институт материнства и детства имени В.Н. Городкова" Министерства здравоохранения Российской Федерации, г. Иваново.
Библиографическая ссылка
Майсина А.И., Кулида Л.В., Смирнова Е.В. ПАТОМОРФОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ПЛАЦЕНТ ПРИ ПРЕЭКЛАМПСИИ СРЕДНЕЙ ТЯЖЕСТИ И ТЯЖЕЛОЙ // Современные проблемы науки и образования. – 2015. – № 3. ;URL: https://science-education.ru/ru/article/view?id=19640 (дата обращения: 20.04.2024).



