В процессах естественного самоочищения открытых экосистем доминирующую роль играют актинобактерии рода Rhodococcus. Выраженная экологическая пластичность, полифункциональность, способность к усвоению различных ксенобиотиков указывают на технологические преимущества использования родококков в качестве потенциальных биокатализаторов процессов деструкции различных ксенобиотиков, в том числе и фармполлютантов [7]. Ранее нами на примере дротаверина гидрохлорида было показано, что родококки способны к биодеструкции лекарственных средств, производных изохинолина с образованием простых ароматических соединений – производных протокатеховой кислоты [6]. На настоящий момент имеются сведения о биотрансформации кодеина с использованием некоторых групп микроорганизмов. Так, в работах Lister et al. идентифицированы продукты биотрансформации кодеина штаммом Pseudomonas putida m10: дигидрокодеин, гидрокодон и 14-гидроксикодеин [8]. В экспериментах по биотрансформации кодеина цианобактериями Nostoc muscorum обнаружены 6-ацетилкодеин, оксикодон, норкодеин и морфин [9]. Информация по биодеградации кодеина актинобактериями рода Rhodococcus отсутствует.
Цель настоящего исследования: идентифицировать продукты биологической деструкции кодеина фосфата в культуральных жидкостях родококков методом газовой хроматографии–масс-спектрометрии.
Материалы и методы исследования
В работе использовали кодеина фосфат (КФ) в виде фармацевтической субстанции (белый кристаллический порошок производства Алкалоида Химический завод ЗАО, Венгрия). Биодеструкцию КФ проводили в колбах Эрленмейера объемом 250 мл, содержащих 100 мл фосфатного буферного раствора состава (г/л): Na2HPO4-8,9; KH2PO4-3,39 (рН 7,0) в условиях периодического культивирования на орбитальной качалке Cetromat IS (“Sartorius”, Германия) при 160 об/мин и температуре 28оС. В качестве штамма-биодеструктора использовали Rhodococcus rhodochrous ИЭГМ 647, поддерживаемый в Региональной профилированной коллекции алканотрофных микроорганизмов (официальный акроним коллекции ИЭГМ, номер во Всемирной федерации коллекции культур 768, www.iegm.ru/iegmcol) [4]. КФ вносили в среду культивирования из стерильного концентрированного раствора (0,1%) до конечной концентрации 0,004% на 3 сут процесса биодеструкции. Продолжительность процесса биодеструкции КФ составляла 27 сут. Для анализа использовали пробы, отобранные на 26 сут процесса биодеструкции с остаточным содержанием кодеина фосфата 1,2 %.
Для извлечения кодеина совместно с продуктами биодеструкции из культуральной жидкости родококков использовали метод твердофазной экстракции. Продукты биодеструкции КФ исследовали методом ГХ-МС в виде нативных веществ и ацетильных дериватов, учитывая наличие в структуре КФ полярных гидроксильных групп и снижение его концентрации в процессе биологической деструкции.
Оборудование. Исследование состава продуктов биодеструкции КФ проводили с использованием газового хроматографа Agilent 7820, оснащенного капиллярной кварцевой колонкой НР-5MS длиной 30 мм с внутренним диаметром 0,25 мм и толщиной пленки неподвижной фазы 0,25 мкм, и масс-селективного детектора Agilent 5975 (Agilent, США). Для твердофазной экстракции применяли систему с вакуумной камерой (манифолд) на 12 позиций (Supelico) и насос низкого вакуума AIR CADET (США). Для выполнения процедур дериватизации использовали термоблок ПЭ-4030 (ОАО «Экрос», Россия), одноканальный испаритель ПЭ-2300, микровстряхиватель ПЭ-2 (ОАО Экрос, Россия), полуавтоматические пипетки-дозаторы, позволяющие отбирать объемы жидкостей 4-40 мкл, 40-200 мкл и 0.2-1 мл, 1-5 мл. В качестве источника микроволнового излучения применяли СВЧ – печь Rolsen MS1770SA (Россия).
Режим работы газового хроматографа с масс-селективным детектором. Скорость потока газа-носителя (гелий) через колонку составляла 1,5 мл/мин, режим работы split/splitless (деление потока 15:1, с задержкой включения 1 мин после ввода пробы). Температура испарителя, хроматографа и интерфейса детектора задавалась в значениях 250 и 280 оС. Температура колонки начальная 70 оС в течение 2 мин, прогрев до 280 оС со скоростью программирования 20 град/мин, выдержка при конечной температуре 8 мин. Напряжение на умножителе масс-селективного детектора устанавливали равной величине автоматической настройки детектора. Регистрацию масс-спектров для ацетильных производных кодеина и продуктов его биодеструкции проводили в режиме полного сканирования ионов в интервале масс 42-450 а.е.
Пробоподготовка культуральных жидкостей родококков. Подготовку проб культуральных жидкостей родококков для твердофазной экстракции осуществляли посредством их центрифугирования в течение 5 мин при 10000 об/мин. (MiniSpin Eppendorf, Германия). Полученные образцы в количестве 30 мл экстрагировали трехкратно равными (по 10 мл) объемами хлороформа при рН 10. Необходимое значение рН среды устанавливали с помощью универсального индикатора путем добавления концентрированного раствора аммиака. Объединенные экстракты сушили над Na2SO4, растворитель удаляли на роторном испарителе. Сухой остаток после испарения экстрагента растворяли в 1 мл метанола. В качестве контролей использовали: стерильный раствор КФ 0,004% в фосфатном буферном растворе (pH 7,0) – абиотический контроль, а также надосадочную жидкость от живых клеток Rhodococcus rhodochrous ИЭГМ 647 в фосфатном буферном растворе (pH 7,0), не содержащем КФ – раствор плацебо.
К исследуемым пробам объемом 0,5 мл прибавляли 50 мкл спиртового раствора внутреннего стандарта – этилморфина гидрохлорида (0,02 мг/мл) и 2 мл 1/15 М фосфатного буферного раствора (рН 4,8). Содержимое флаконов центрифугировали при 3000 об/мин в течение 10 минут. Центрифугат отделяли от осадка и подвергали твердофазной экстракции.
Процедура твердофазной экстракции. Экстракцию проводили на патронах SampliQ EVIDEX (200 мг/3 мл), имеющих смешанный тип фазы (обращенная и катионит). Кондиционирование сорбента проводили путем последовательного пропускания через картридж 2 мл 95% этанола и 2 мл 1/15 М фосфатного буферного раствора (рН 4,8), после чего загружали образец со скоростью 1 мл/мин. Промывку сорбента осуществляли последовательно 1 мл 1/15 М фосфатного буферного раствора (рН 4,8) и 1 мл 10% этанола со скоростью 2-3 мл/мин. Сушку патрона проводили под вакуумом в течение 20 минут. Элюирование проводили двукратно по 2 мл смеси н-гексан–этилацетат (3:1) (элюат I, элюат не исследовали). Далее элюировали двукратно по 2 мл смеси дихлорметан–изо-пропанол–25% раствор аммиака (4:1:0,1). Элюат II испаряли в токе азота при температуре 400 С.
Дериватизация. К сухому остатку элюата II прибавляли 40 мкл безводного пиридина и 60 мкл уксусного ангидрида, флакон плотно укупоривали и обрабатывали микроволновым излучением в СВЧ – печи с мощностью 560 Вт в течение 5 минут. После охлаждения флакон вскрывали и выпаривали избыток реагентов в токе азота при температуре не выше 400 С. Сухой остаток растворяли в 100 мкл безводного этилацетата и 1 мкл вводили в инжектор хроматографа.
Все использованные в работе растворители и реактивы имели квалификацию «х.ч.».
Результаты исследования и их обсуждение
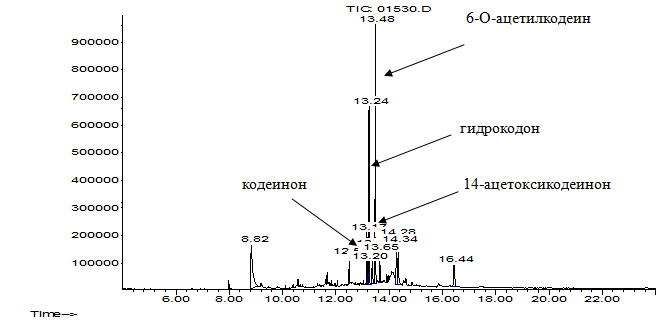
В культуральных жидкостях R. rhodochrous ИЭГМ 647 в виде ацетилдериватов были разделены и идентифицированы 6-О-ацетилкодеин, гидрокодон, кодеинон и 14-ацетоксикодеинон. Хроматограммы пробы культуральной жидкости родококков, абиотического контроля и раствора плацебо представлены на рис. 1-3.
Рис. 1. Хроматограмма экстракта культуральной жидкости родококков, содержащего КФ и продукты его биодеструкции в виде ацетилдериватов
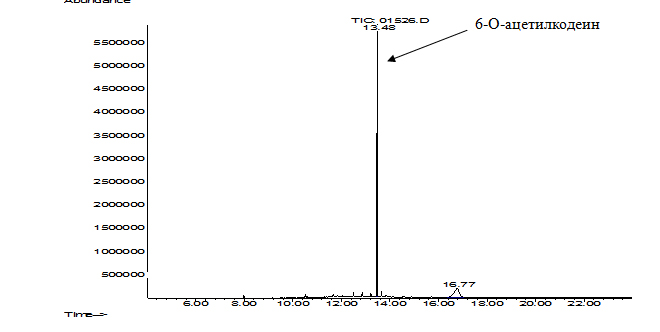
Рис. 2. Хроматограмма абиотического контроля – раствора КФ 0,004% в фосфатном буферном растворе (pH 7,0) в виде ацетилдеривата
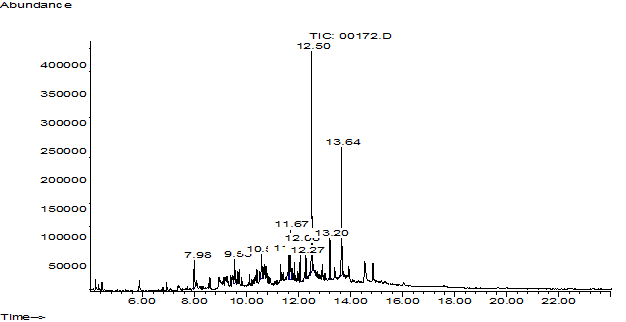
Рис. 3. Хроматограмма раствора плацебо – центрифугата клеток R. rhodochrous ИЭГМ 647 в фосфатном буферном растворе (pH 7,0)
На основании изучения характера масс-фрагментации полученных дериватов продуктов биодеструкции КФ обработаны и описаны их масс-спектральные характеристики, дополненные газо-хроматографическими данными (табл. 1).
Таблица 1
Масс-спектральные характеристики и газо-хроматографические данные дериватов КФ
и продуктов его биодеструкции
|
Соединение (m/z опорного иона) |
tr, мин |
Относительная площадь пика, % |
Характеристические ионы, m/z |
|
6-О-ацетилкодеин (341) |
13,48 |
1,2 |
341,282,229 |
|
Гидрокодон (299) |
13,25 |
4,5 |
299,242,214 |
|
Кодеинон (297) |
13,17 |
25,5 |
297,229,214 |
|
14-Ацетоксикодеинон (312) |
13,49 |
68,8 |
355,312 ,229 |
Среди идентифицированных веществ (6-О-ацетилкодеина, гидрокодона, кодеинона и 14-ацетоксикодеинона) наиболее высокое относительное содержание в спектрах целевых соединений наблюдалось у 14-ацетоксикодеинона (68,8%).
С целью сокращения
времени анализа и упрощения процедуры пробоподготовки нами были исследованы
также пробы культуральной жидкости родококков без проведения дериватизации.
Хроматограмма экстракта пробы культуральной жидкости родококков без
предварительной дериватизации, а также относительное содержание кодеина и
продуктов его биодеструкции в культуральной жидкости родококков в данных
условиях пробоподготовки представлены на рис. 4 и в табл. 2.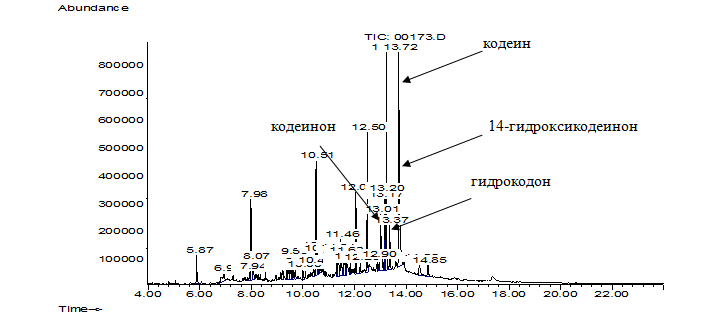
Результаты анализа масс-спектров и хроматограмм недериватизованных компонентов культуральных жидкостей (рис. 4) показали, что среди продуктов биодеструкции КФ на 26 сут детектировался гидрокодон, (3,6-дигидрокси-N-метил-4,5-эпоксиморфинен-7, m/z=299), кодеинон (5-α, 6-α)-7,8-дидегидро-4,5-эпокси-3-метокси-17-метилморфинан-6-он, m/z =297) и 14-гидроксикодеинон (7,8-дидегидро-4,5-эпокси-14-гидрокси-3-метокси-17-метил–морфинан-6-он, m/z=313) с наибольшим выходом (57,1%) по сравнению с другими идентифицированными веществами (табл. 2).
Таблица 2
Относительное содержание кодеина и продуктов его биодеструкции в культуральной жидкости R. rhodochrous ИЭГМ 647 (внутренняя нормализация)
|
Вещество |
Относительное содержание, % |
|
Кодеин |
1,18 |
|
Гидрокодон |
6,41 |
|
Кодеинон |
35,3 |
|
14-Гидроксикодеинон |
57,1 |
При сравнении результатов, полученных в разных условиях пробоподготовки, установлено, что основные продукты биодеструкции КФ – кодеинон и гидрокодон имеют большие значения относительного содержания в экстракте культуральной жидкости без дериватизации. Однако содержание недериватизованного 14-гидроксикодеинона оказалось несколько меньше (57,1%) по отношению к его деривату (68,8%), а содержание кодеина сохранилось на одном уровне (1,18% и 1,2%). Таким образом, оценивать относительное содержание КФ и его метаболитов в культуральной жидкости родококков эффективнее без использования дериватизации.
На основании данных ГХ-МС анализа составлена схема биотрансформации кодеина клетками R. rhodochrous ИЭГМ 647 (рис. 5).
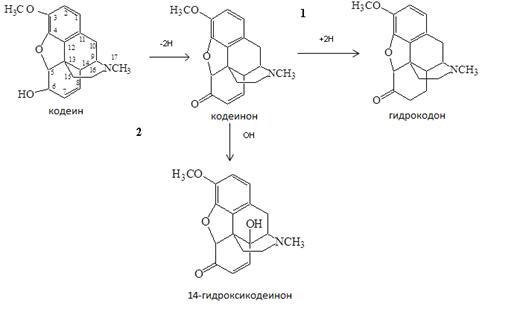
Рис. 5. Схема биотрансформации кодеина клетками R. rhodochrous ИЭГМ 647
Как видно из схемы (рис. 5), модификации молекулы кодеина могут протекать по двум направлениям. Первое направление (1): в результате реакции дегидрирования кодеина в 6 положении образуется кодеинон, который, в свою очередь, восстанавливается в положениях 7-8 до гидрокодона. Второе направление (2) соответствует превращению кодеина в кодеинон в результате реакции дегидрирования в 6 положении с последующим превращением кодеинона в 14-гидроксикодеинон в результате реакции гидроксилирования в 14 положении. Цикл морфинана в процессе биодеструкции КФ клетками R. rhodochrous ИЭГМ 647 не разрушается.
Следует отметить, что образующийся в процессе биодеструкции 14-гидроксикодеинон является важным промежуточным веществом в синтезе 14-гидроксинорморфинонов, широко используемых наркотических анальгетических средств, а также антагонистов опиатных рецепторов – оксикодона, нороксиморфона, налтрексона и др. [3]. Данные соединения получают полусинтетически из тебаина – второстепенного компонента опиумной смолы, обладающего высокой стоимостью ввиду низкого содержания (0,5%) в исходном сырье. В связи с этим существуют разные схемы синтеза 14-гидроксинорморфинонов из более доступных по сравнению с тебаином веществ – кодеина и морфина, содержащихся в природном сырье в количестве 2 % и 10 %, соответственно. Так, например, производят шестиэтапную химическую трансформацию кодеина в нороксикодон и далее в нороксиморфон с использованием полученного фотохимическим способом синглетного кислорода, или прямым аллиловым окислением кодеина хромовой кислотой в соответствующие 14-гидроксипроизводные морфина [3]. Этим процессам свойственны недостатки, заключающиеся в низких выходах целевого продукта, продолжительности во времени, использовании тяжелых металлов, оказывающих негативное влияние на окружающую среду. Биотрансформация кодеина с использованием штамма R. rhodochrous ИЭГМ 647 позволяет получить 14-гидроксикодеинон, минуя стадии превращения кодеина в тебаин с дальнейшим окислением последнего в 14-гидроксизамещенные морфиноны. Данный способ получения 14-гидроксикодеинона описан в работе Lister D. L. et. al. с использованием в качестве штамма – биодеструктора Pseudomonas putida m10 [8]. Выход 14-гидроксикодеинона при использовании Pseudomonas putida m10 и R. rhodochrous ИЭГМ 647 составил 24,0 и 57,1 %, соответственно. Таким образом, использование клеток R. rhodochrous ИЭГМ 647 может быть перспективно для получения 14-гидроксикодеинона.
Заключение
Методом газовой хроматографии–масс-спектрометрии идентифицированы основные продукты биодеструкции кодеина фосфата клетками R. rhodochrous ИЭГМ 647: кодеинон, гидрокодон и 14-гидроксикодеинон, последний из которых является важным промежуточным звеном в синтезе наркотических анальгетиков и их антагонистов.
Рецензенты:Хомов Ю.А., д.фарм.н., профессор кафедры фармацевтической химии ФЗО и ФДПО ГБОУ ВПО «ПГФА» Минздрава России, г. Пермь;
Михайловский А.Г., д.фарм.н., профессор кафедры общей и органической химии ГБОУ ВПО «ПГФА» Минздрава России, г. Пермь.
Библиографическая ссылка
Плотников А.Н., Тюмина Е.А., Катаев С.С., Вихарева Е.В. ИДЕНТИФИКАЦИЯ ПРОДУКТОВ БИОЛОГИЧЕСКОЙ ДЕСТРУКЦИИ КОДЕИНА ФОСФАТА МЕТОДОМ ГАЗОВОЙ ХРОМАТОГРАФИИ – МАСС-СПЕКТРОМЕТРИИ // Современные проблемы науки и образования. – 2015. – № 3. ;URL: https://science-education.ru/ru/article/view?id=20336 (дата обращения: 16.04.2024).



