Среди многочисленных вариантов лечения ММ у женщин фертильного возраста предпочтение отдается органосохраняющим методам, включающим консервативную миомэктомию с помощью гистероскопии, лапароскопии и лапаротомии, эмболизацию маточных артерий, дистанционное разрушение опухоли MR-контролируемым фокусированным ультразвуком (ФУЗ-абляция миоматозных узлов).Но даже использование малоинвазивных органосберегающих хирургических методик не гарантирует 100% эффективности лечения. Литературные источники утверждают, что вероятность рецидива заболевания после консервативной миомэктомии в течение 5 лет составляет 45-55% [14; 15]. А удельный вес выполняемых гистерэктомий при ММ в структуре оперативных вмешательств достигает 60,9-95,3% [3].В связи с этим приоритет при лечении ММ остается за гормональной терапией, используемой как в качестве нео- и адъювантной, так и самостоятельного варианта лечения[2; 3; 7; 9;12]. Однако, несмотря на огромный выбор гормональных препаратов, нередко на фоне их применения у пациенток с ММ отмечаются побочные эффекты и осложнения (нарушения менструального цикла, метроррагии, увеличение размеров миоматозных узлов), что диктует необходимость дальнейшего изучения патогенетических особенностей течения заболевания для оптимизации существующих методов консервативной терапии.
Цель исследования: изучить особенности иммунной системы и причины ее дисфункции у больных миомой матки, осложненной геморрагическим синдромом.
Материал и методы исследования: под нашим наблюдением находилось 76женщин с ММ, размеры которой не превышали 12-недельную беременность, с преимущественно интрамуральной и субсерозной локализацией узлов, и имеющей показания для консервативного лечения. Основную группу составили 43 пациентки с ММ и клиникой геморрагического синдрома на фоне гормонотерапии. В группе сравнения (n=33)осложнений при консервативном лечении ММ гормональными препаратами не наблюдалось. Контрольная группа была представлена практически здоровыми женщинами (n=27). Всем пациенткам проводилось стандартное клинико-лабораторное обследование и ультразвуковое сканирование абдоминальным и вагинальным датчикомна аппарате HITACHI-5500 с применением широкополосных, сверхвысокоплотных конвексных датчиков 3,5-5,0 МГц и полостных датчиков 5,0-7,5 МГц. Состояние иммунной системы оценивали по содержанию цитокинов в сыворотке крови женщин. Исследование проводили методом твердофазного иммуноанализа. Для определения интерлейкинов (ИЛ-1β, ИЛ-4, ИЛ-6), интерферона(γ-ИНФ) ифактора некроза опухоли (ФНО-α) использовали наборы реактивов «Вектор-БЕСТ», г.Новосибирск. Для определения интерлейкина ИЛ-2 использовали набор реактивов фирмы Biosource, USA. Для определения Fas-лиганда(Fas-L) использовали набор реактивов фирмы Medsystems, Австрия. Дополнительно проводили обследование на выявление антителIgGиIgM к возбудителям урогенитальных инфекций (хламидиоз, уреаплазмоз, трихомониаз, цитомегаловирусной и герпетической инфекций) с помощью иммуноферментного анализа (ИФА).
Статистическая обработка результатов исследования проведена с использованием пакета прикладных программ Statgraphics (Statistical Graphics System), разработанного фирмой STSC Inc.
Результаты исследования и их обсуждение. Возраст обследованных варьировал от 21 до 42 лет и в среднем составил в основной группе – 30,5±4,3 года, в группе сравнения – 31,2±5,4 года, в контрольной группе – 30,2±5,5 года, что не имело значимых межгрупповых различий. Общая характеристика групп представлена в таблице 1. Детальное изучение анамнеза показало высокую частоту генитальной патологии у больных с ММ (табл. 1). Удельный вес хронических воспалительных заболеваний половых органов в основной группе и в группе сравнения превышал показатель контрольной группы в 8 раз, нарушений менструального цикла по типу гиперменореи, полименореи, мено- и метроррагии – в 20 раз, доброкачественных заболеваний шейки матки – в 18 раз. Использование с целью контрацепции внутриматочных спиралей (ВМС) прослежено только в группах женщин с ММ. Кроме того, необходимо отметить, что реализовать репродуктивную функцию смогла лишь каждая вторая пациентка с ММ, в то время как в группе контроля превалировали рожавшие женщины, а частота самопроизвольных абортов была значительно выше у больных основной группы и группы сравнения (табл. 1).
Таблица 1
Общая характеристика групп обследованных женщин
|
Исследуемый показатель |
Основная группа (n=43) |
Группа сравнения (n=33) |
Контрольная группа (n=27) |
|||
|
n |
% |
n |
% |
n |
% |
|
|
Акушерско-гинекологический анамнез |
||||||
|
Роды |
21 |
48,8 |
16 |
48,5 |
22 |
81,5 |
|
Самопроизвольный аборт |
16 |
37,2 |
12 |
36,4 |
2 |
7,4 |
|
Нарушения овариально-менструального цикла |
33 |
76,7 |
25 |
75,8 |
1 |
3,7 |
|
Хронические воспалительные заболевания гениталий |
38 |
88,4 |
29 |
87,9 |
3 |
11,1 |
|
Эктопия шейки матки |
28 |
65,1 |
21 |
63,6 |
1 |
3,7 |
|
Использование ВМС |
2 |
4,7 |
1 |
3,0 |
0 |
0 |
|
Экстрагенитальные заболевания |
||||||
|
Ожирение |
28 |
65,1 |
21 |
63,6 |
1 |
3,7 |
|
Заболевания сердечно-сосудистой системы |
15 |
34,9 |
12 |
36,4 |
0 |
0 |
|
Заболевания желудочно-кишечного тракта |
6 |
13,9 |
5 |
15,2 |
2 |
7,4 |
|
Анемия |
42 |
97,7 |
0 |
0 |
0 |
0 |
Изэкстрагенитальной патологии при ММ превалировали: ожирение, заболевания сердечно-сосудистой системы и желудочно-кишечного тракта (табл. 1). Полученные данные согласуются с мнением большинства исследователей о значении факторов риска в возникновении ММ [4;9]. При этом частота встречаемости соматической и генитальной патологии в основной группе и группе сравнения была сопоставима. А отличительной особенностью группы женщин с ММ, осложненной геморрагическим синдромом, являлось наличие анемии различной степени тяжести (97,7%).
С целью гормонотерапии ММ пациентки обеих групп получали Бусерелин-депо (3,75 мг каждые 4 недели), продолжительность приема препарата варьировала от 1 до 6 месяцев. В основной группе осложнения в виде сохраняющегося геморрагического синдрома (от незначительных до обильных маточных кровотечений) после начала гормонотерапии в течение первого месяца отметили 26 женщин (60,5%), от 2 до 3 месяцев – 17 (39,5%).
Результаты проведенного ультразвукового обследования показали, что размеры матки в группах обследуемых женщин колебались от 6-7 до 12 недель беременности. По данным УЗИ, средний объем матки в основной группе составил 394,2±178,6 см³, в группе сравнения – 396,7±172,3 см³ (Р>0,05). Наиболее часто встречалась субсерозно-интерстициальная и интерстициальная локализация узлов, реже – субсерозная (рис. 1). Количество миоматозных узлов варьировало от 3 до 6, а размеры узлов ММ находились в пределах от 2,5 до 5 см.
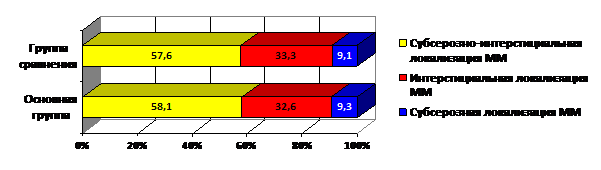 Рис. 1. Локализация миоматозных узлов в группах обследуемых
женщин
Рис. 1. Локализация миоматозных узлов в группах обследуемых
женщин
Дополнительное использование в работе доплерографии дало возможность определить характер васкуляризации миоматозных узлов. У больных с ММ, осложненной геморрагическим синдромом на фоне гормонотерапии, превалировал гиперваскулярный тип опухоли, что подтверждает ранее проведенное исследование И.Е. Рогожиной и соавт.[1].Авторами было установлено, что основными диагностическими критериями комплексного ультразвукового исследования ММ, осложненной маточным кровотечением, являются гиперваскулярный тип миоматозных узлов, а также увеличение максимальной скорости кровотока и индекса периферического сопротивления в маточных артериях. В основной группе характерные признаки доплерографии зарегистрированы в нашей работе в 90,7% наблюдений (n=39), а в группе сравнения – в 30,3%(n=10).
а)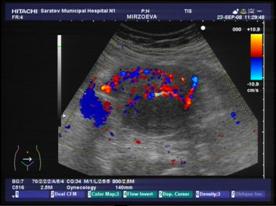 б)
б)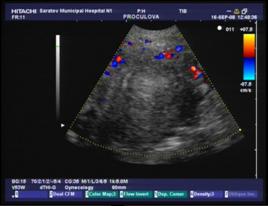
Рис. 2: а) гиперваскулярный и б) гиповаскулярный тип кровоснабжения миомы матки
Результаты исследования иммунной системы показали достоверное снижение всех изучаемыхцитокинов у больных ММ, при этом более выраженное снижение показателей констатировано в группе пациенток с клиникой геморрагического синдрома (табл. 2). КонцентрацииИЛ-1β,ИЛ-2, ИЛ-4, ИЛ-6и γ-ИНФ у больных группы сравненияуменьшались в 1,3 раза по отношению к контрольным данным, а содержание ФНО-α – в 1,5 раза (Р<0,05). В основной группе уровнипро- и противовоспалительных цитокинов снижались в 1,4-2 раза.
Таблица 2
Результаты исследования иммунной системы в группах обследуемых женщин
|
Исследуемый показатель (пг/мл) |
Основная группа (n=43) |
Группа сравнения (n=33) |
Контрольная группа (n=27) |
|
ИЛ-1β |
4,65 ± 0,19* |
5,10 ± 0,24* |
6,5 ± 0,08 |
|
ИЛ-2 |
60,1 ± 0,65* |
63,21 ± 1,04* |
79,68 ± 1,41 |
|
ИЛ-4 |
2,59 ± 0,32* |
2,86 ± 0,37* |
3,71 ± 0,09 |
|
ИЛ-6 |
4,33 ±0,22* |
4,81 ± 0,59* |
6,25 ± 0,14 |
|
ФНО-α |
0,80 ± 0,02*# |
1,04 ± 0,15* |
1,56 ± 0,05 |
|
γ-ИНФ |
8,58 ± 1,16*# |
10,09 ± 1,22* |
13,32 ± 0,27 |
|
Fas-L |
0,15 ± 0,03*# |
0,21 ± 0,02* |
0,30 ± 0,05 |
* Р - достоверность различий с контрольной группой (Р<0,05);
#Р - достоверность различий с группой сравнения (Р<0,05).
Соотношение γ-ИНФ/ ИЛ-4 у пациенток с ММ несколько снижалось в сравнении с контрольной группой (с 3,6 до 3,5), а при сочетании ММ с геморрагическим синдромом до 3,3, что свидетельствует о редукции преимущественноTh-1 лимфоцитов по сравнению с Th-2 клетками и подавлении в большей степени при ММ клеточного иммунного ответа. Ряд исследователей также связывают прогрессирование опухолевого процесса с иммунодепрессией и неспособностью клеток подвергаться апоптозу [1;2]. При изучении маркера апоптоза в клеточной популяции Fas-L (табл. 2) в группах обследуемых женщин мы констатировали уменьшение его уровня с 0,30±0,05 пг/мл в контрольной группе до 0,21±0,02 пг/мл – в группе сравнения, с прогрессирующем падением его содержания (в 2 раза) в сыворотке крови пациенток с ММ в сочетании с геморрагическим синдромом. Снижение концентрации Fas-L при ММ (Р<0,05) относительно показателей контрольной группы свидетельствует о снижении цитотоксического киллинга, осуществляемого Т- и NК-клетками, что способствует медленному прогрессированию заболевания и согласуется с мнением И.С.Сидоровой [8].Выявленные прогрессирующие нарушения синтеза цитокинов и угнетение апоптоза при ММ, осложненной геморрагическим синдромом на фоне гормонотерапии, послужили основанием для поиска причин возникновения дисфункции иммунной системы у данного контингента больных.
Учитывая высокую частоту хронических воспалительных заболеваний гениталий у больных ММ, мы включили в план обследования женщин иммуноферментный анализ крови (ИФА) на обнаружение антител IgG и IgM к возбудителям урогенитальных инфекций.
Результаты ИФА показали, что в группе сравнения хламидиоз был диагностирован у 14 пациенток (42,4%), уреаплазмоз – у 19 (57,6%), герпес-вирусная инфекция – у 15 (45,5%). При этом с помощью ИФА у женщин с хорошей переносимостью гормонотерапии выявлялись только IgG к возбудителям урогенитальных инфекций. В основной группе антителаIgGиIgM к хламидийной инфекции обнаружены у 34 обследованных женщин (79,1%); уреаплазменной – у 35 (81,4%), а хронический трихомониаз, герпетическая и цитомегаловирусная инфекции диагностированы во всех случаях (рис. 3).
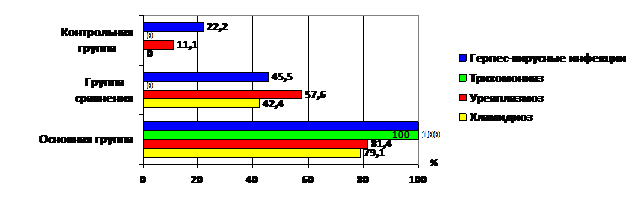
Рис. 3. Результаты обследования женщин методом ИФА
к возбудителям урогенитальных инфекций
Необходимо также отметить, что выявление IgM к возбудителям урогенитальных инфекций у больных основной группы свидетельствовало об активизации хронического воспалительного процесса гениталий, проявлением которого, по нашему мнению, и являлся геморрагический синдром в видематочного кровотечения различной степени выраженности. Кроме того, можно предположить, что назначение гормональных препаратов для консервативного лечения ММ на фоне хронического эндометрита специфической этиологии оказывает потенцирующее иммунодепрессивное воздействие на организм женщины, увеличивая частоту побочных эффектов и осложнений.
Заключение. Результаты исследования цитокинового профиля у больных ММ, осложненной маточным кровотечением на фоне гормонотерапии, свидетельствуют о выраженных нарушениях иммунного статуса, редукции функции Th1- и Th2-лимфоцитов и, как следствие, значительном угнетении апоптоза при данной патологии, что может способствовать дальнейшему росту опухоли и прогрессированию заболевания. Возникновение геморрагического синдрома на фоне гормонотерапии ММ более характерно для гиперваскулярного типа опухоли (90,7%). Выявлено весомое значение инфекционного фактора и сексуально-трансмиссивных инфекций в патогенезе осложнений консервативного лечения ММ.Установлено, что геморрагический синдром на фоне гормонотерапии ММ ассоциируется с обострением хронических урогенитальных инфекций, что диктует необходимость более детального обследования женщин с данной патологией, с целью совершенствования способов консервативного лечения ММ, снижения частоты осложнений и повышения эффективности.
Рецензенты:Салов И.А., д.м.н., профессор, заведующий кафедрой акушерства и гинекологии лечебного факультета ГБОУ ВПО «Саратовский государственный медицинский университет им. В.И. Разумовского» Минздрава России, г.Саратов;
Василенко Л.В., д.м.н., профессор кафедры акушерства и гинекологии ФПК и ППС ГБОУ ВПО «Саратовский государственный медицинский университет им. В.И. Разумовского» Минздрава России, г. Саратов.
Библиографическая ссылка
Хворостухина Н.Ф., Столярова У.В., Новичков Д.А., Островская А.Е. ПРИЧИНЫ ДИСФУНКЦИИ ИММУННОЙ СИСТЕМЫ У БОЛЬНЫХ МИОМОЙ МАТКИ, ОСЛОЖНЕННОЙ ГЕМОРРАГИЧЕСКИМ СИНДРОМОМ // Современные проблемы науки и образования. – 2015. – № 4. ;URL: https://science-education.ru/ru/article/view?id=20803 (дата обращения: 19.04.2024).



