При исследовании растительного сырья, в котором основными биологически активными веществами являются флавоноиды, необходимо наличие достоверных методик анализа, позволяющих качественно и количественно определить соответствующий флавоноид в пробе сложного многокомпонентного состава. Масс-спектрометрия (МС) в тандеме с хроматографией (ВЭЖХ) иликапиллярным электрофорезом (КЭ) является методом выбора в данном случае. Однако в настоящее время эти комбинации используютсятольков научно-исследовательских работах по изучению состава флавоноидных соединений в различных растительных объектах[11]. Согласноже нормативной документации (НД)на лекарственное растительное сырье (ЛРС) и препараты из ЛРС, анализ индивидуальных флавоноидов проводят с помощью обращенно-фазового варианта ВЭЖХ с СФ-детектором: определение рутина в гречихи траве, синенсетина в ортосифона листьях, апигенина-7-глюкозида в ромашке цветках и т.д.[4].Вместе с тем, как и любой другой метод, ВЭЖХ не может быть универсальным в данном случае, так как структурные различия между флавоноидами могут быть достаточно незначительными и особенно большие сложности возникают при разделении веществ, имеющих близкие параметры гидрофобности. В этом случае необходимо применение особых колонок, применение сложного градиента, а также использование различного рода добавок к элюенту.
На сегодня перспективнойальтернативойметоду ВЭЖХявляется КЭ. Среди основных преимуществ данного метода можно назвать экономичность, высокую эффективность и особенности механизма разделения веществ, так как величины отношений заряда к радиусу могут отличаться в большей степени, нежели значения коэффициента распределения(logP).
В то же время метод КЭ не используется в НД на ЛРС и препараты из ЛРС, содержащее флавоноиды. Например, несмотря на наличие общей фармакопейной статьи на метод КЭ, в европейскую фармакопею не включено ни одного растительного объекта, анализ биологически активных веществ которого проводился бы с его помощью[4]. Необходимо также отметить, что на сегодня накоплен определенный научный опыт анализа флавоноидов данным методом. Так, только по данным популярного интернет-ресурса pubmed.com [19],число публикаций на эту тему составляет более 350.
Такая недооценка фармакопеями отчасти связана с отсутствием описанных закономерностей электрофоретического поведения, а также общих подходов к анализу флавоноидов данным методом, поскольку подавляющая часть исследований сводится к эмпирическому поиску условий анализа флавоноидовв конкретных объектах.
Значительная часть данных работ посвящена анализу именно в условиях капиллярного зонного электрофореза (КЗЭ), как самого простого варианта, где флавоноиды анализируются в щелочных электролитахс рН ≥8. Выбор области рН электролита связан с особенностями их физико-химических свойств, т.к. заряженными частицами флавоноидымогут быть только в щелочной среде, ионизируясь по фенольным гидроксилам.Об этом свидетельствуютприведенные в литературе значения pKa для агликонов различных группфлавоноидов(табл. 1).
Таблица 1
Литературные данные значенийpKaдля флавоноидов различных групп
|
Группа |
Флавоноид |
pKa1 |
pKa2 |
pKa3 |
Источник |
|
Флавон |
Апигенин |
6,60 |
9,30 |
- |
[8] |
|
Лютеолин |
6,90 |
8,60 |
10,30 |
[8] |
|
|
Флаванонон |
Гесперетин |
6,80 |
10,40 |
- |
[13] |
|
Флавонол |
Кемпферол |
6,96 |
8,78 |
10,60 |
[10] |
|
Кверцетин |
7,10 |
9,09 |
11,12 |
[10] |
|
|
Флаванонол |
Дигидроксикверцетин |
6,68 |
8,89 |
10,95 |
[15] |
Несмотря на различие в строении, для всех групп характерны схожие области pKa,обуславливающие использование щелочных электролитов в их анализе.
Определяющим фактором в КЗЭ является собственная или эффективная электрофоретическая подвижность (ЭЭП) частицы (µэф), которая, в свою очередь, зависит от двух основополагающих факторов: заряда и радиуса частицы при условии постоянных значений вязкости (формула 1)[6].
![]() (1)
(1)
q – заряд иона;
η – вязкость раствора;
r – радиус иона.
В эксперименте µэф рассчитывают по разности между общей (наблюдаемой) электрофоретической подвижностью и электрофоретической подвижностью электроосмотического потока (ЭОП) по формуле 2 [6]:
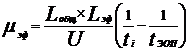 (2)
(2)
Lобщ- общая длина капилляра, см;
Lэф - эффективная длина капилляра, см;
U- величина рабочего напряжения, вольт;
ti- время миграции компонента, с;
tЭОП - время миграции маркера ЭОП, с.
Известно, что в КЗЭ при условии постоянства параметров прибора (геометрия капилляра, температура, напряжение, длина волны) ключевыми факторами, влияющими на подвижность и соответственно на выбор условий анализа, являются состав электролита, его рН и концентрация [2;6].При выборе электролита определенного состава необходимо учитывать не только его достаточную буферную емкость и малое поглощение в выбранной длине волны, но также и способность вступать во взаимодействие с анализируемыми компонентами, что также может влиять на µэф. Например, в литературе описана способность флавоноидов вступать в процессы комплексообразования с боратным электролитом [12; 16; 17]. Что касается рН электролита, то данный параметр является наиболее важной переменной. Величина рН ведущего электролита определяет как скорость ЭОП, так и форму нахождения компонента в растворе,поскольку он влияет на заряд самой частицы. Но если при рН 8 и более (условия анализа флавоноидов) скорость ЭОП меняется не значительно, т.к. уже достигает своего максимума [5], то влияние на заряд частиц будет определяющим, учитывая pKa флавоноидов (табл. 1). Ионная сила электролита оказывает существенное влияние на скорость потока и соответственно на скорость анaлитoв, причем подвижности их (наблюдаемые) будут обратно пропорциональны корню квадратному изконцентрации буфера. Поэтому буферы низкой концентрации (менее 20 мМ) обеспечивают максимально быстрое разделение[6]. При этом необходимо учитывать, что увеличение концентрации не всегда повышает селективность анализа, так как возможны эффекты перегрузки и появление дополнительного уширения полос из-за тепловыделения. Кроме того, существенно увеличивается время анализа, что также является нежелательным следствием повышения концентрации электролита [2;6].
В этой связи целью настоящего исследования является: изучение закономерностей электрофоретического поведения флавоноидов в электролитах различного состава и рН и разработкана их основе рядаобщих подходов канализу данной группы соединений в условиях КЗЭ.
Материалы и методы исследования
Работу вели на системе капиллярного электрофореза «Капель 103Р» (группа компаний «Люмэкс», Россия) с кварцевым капилляром (диаметр 50 мкм, Lобщ/Lэф= 60/50 см). Детектирование осуществляли спектрофотометрически при фиксированной длине волны 254нм, напряжение составляло +20 кВ, температура комнатная. Ввод пробы – гидродинамический, 150 мбар×с.
В работе реализовывался вариант КЗЭ, при этом использовался диапазон рН электролита от 8 до 11, т.к. в этом случае скорость ЭОП является максимальной [5]. Кроме того, флавоноиды в данной области рН способны к различной степени ионизации по фенольным гидроксилам [8;10; 13; 15].
Полностью данный диапазон охватывает только боратный буферный раствор, который для эксперимента готовился на четырех уровнях рН (8,0, 9,2, 10,0 и 10,8). В качестве альтернативного электролита использовался карбонатный буферный растворс рН 9,2, 10,0 и 10,8. И учитывая, что карбонатный буферный раствор готовится только в диапазоне рН от 9,2 до 11, то электролит с рН 8,0 создавали с помощью фосфатного буферного раствора. Все растворы готовили в соответствии с [3;9], с контролем полученных значений потенциометрически. Концентрация всех электролитов составляла 10 мМ.
Среди флавоноидов использовались стандартные образцы флавонов (космосиин, ≥97% (Fluka), витексин-2``-О-рамнозид,≥98% (Fluka),апигенин,≥97% (Sigma),лютеолин, ≥99% (Fluka), диосмин (DIOSMIN FOR SYSTEM SUITABILITY CRS, Europian Pharmacopoeia Reference Standard), диосметин, (PhytoLab)), флавононы (нарингин, 97%(«Сигмабиосинтез») гесперидин, 97% («Сигмабиосинтез») гесперетин, ≥95% (Fluka)), флавонолы (астрагалин, 97% (Appli Chem), кемпферол, >97% (PHYTOPLAN) рутин, 97-102% («Сигмабиосинтез») гиперозид,≥97% (Sigma), кверцетиндигидрат, 99,9% («Сигмабиосинтез»), флавононолы (дигидрокверцетин, ≥90% (Sigma)).
Результаты исследования и их обсуждение
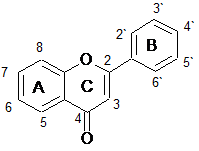
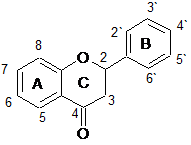
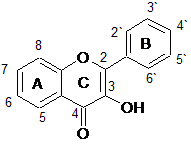
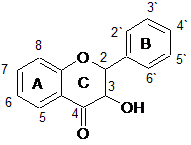
Флавоноиды анализировались двумя группами, в зависимости от наличия гидроксильной группы в третьем положении (кольцо С), т.е. одну группу составили флавоны и флаваноны, другую – флавонолы и флаванонолы. Структурные формулы анализируемых веществ представлены в таблице 2.
Изучалось влияние степени гидрирования кольца С, количества гидроксильных групп, степени гликозилирования флавоноидов на их ЭЭП в зависимости от состава и рН ведущего электролита.
Таблица 2
Структурные формулы15 флавоноидов – представителей группы флавонов, флаванонов, флавонолов и флаванонолов
|
Скелет |
Радикалы |
Название флавоноида (степень гликозилирования) |
Аббре-виатура |
|
Флавоны |
|||
|
|
5,7,4`-ОН |
Апигенин (агликон) |
Ap |
|
5,4`-OH-7-глюкозид |
Космосиин (гликозид апигенина) |
Cos |
|
|
(5,7,4`-ОН -8-глюкорамнозид) |
Витексин-2``-О-рамнозид (гликозид апигенина) |
Vit |
|
|
5,7,3`,4`-ОН |
Лютеолин (агликон) |
Lut |
|
|
5,7,3`-ОН,4`-ОСН3 |
Диосметин (агликон) |
Dt |
|
|
(5,3`-ОН-4`-OCH3-7-рамноглюкозид) |
Диосмин (гликозид диосметина) |
D |
|
|
Флаваноны |
|||
|
|
5,7,3`-ОН-4`-ОСН3 |
Гесперетин (агликон) |
Ht |
|
5,3`-ОН-4`-OCH3-7-рамноглюкозид |
Гесперидин (гликозид гесперетина) |
H |
|
|
5,4`-ОН-7-рамноглюкозид |
Нарингин (гликозид нарингенина) |
Nar |
|
|
Флавонолы |
|||
|
|
3,5,7,4`-ОН |
Кемпферол (агликон) |
Kaemp |
|
5,7,4`-ОН-3-глюкозид |
Астрагалин (гликозид кемпферола) |
Astr |
|
|
3,5,7,3`4`-ОН |
Кверцетин (агликон) |
Quer |
|
|
5,7,3`4`-ОН-3-рамноглюкозид |
Рутин (гликозид кверцетина) |
Rut |
|
|
5,7,3`4`-ОН-3-галактозид |
Гиперозид (гликозид кверцетина) |
Hyp |
|
|
Флаванонолы |
|||
|
|
3,5,7,3`4`-ОН |
Дигидрокверцетин (агликон) |
DHQ |
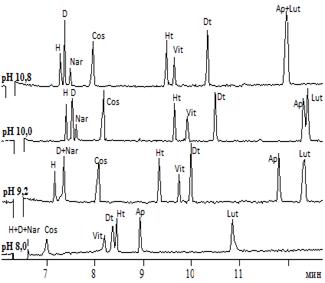
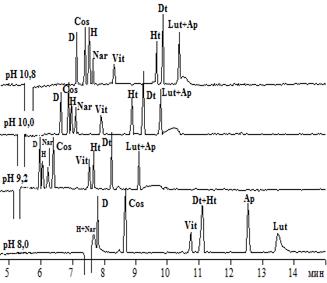
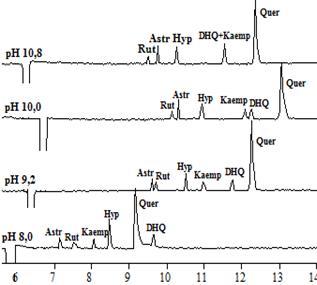
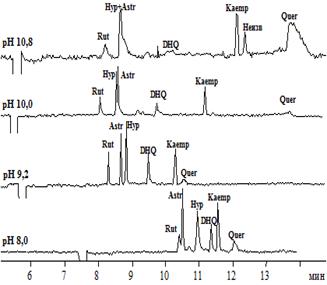
На рисунках 1 и 2 представлены электрофореграммы, полученные в электролитах различных составов и рН (флавоны и флаваноны – рисунок 1; флавонолы и флавононолы – рисунок 2).
|
|
|
Рис.1.Электрофореграммы растворов модельной смеси флавонов и флаванонов при различных рН боратного(A), а также фосфатного (рН 8,0) и карбонатного (рН 9,2, 10,0, 10,8) электролитов (B)
|
|
|
Рис.2.Электрофореграммы растворов модельной смеси флавонолов и флаванонолов при различных рН боратного (A), а также фосфатного (рН 8,0) и карбонатного (рН 9,2, 10,0, 10,8) электролитов (B)
Анализ рисунка 1 показывает, что гесперидин, дисомин и нарингин при рН 8 обладают незначительнойЭЭП как в боратном, так и в фосфатном электролите. Это свидетельствует о недостаточномэффективном заряде данных соединений. С увеличением рН электролитов (и боратного, и карбонатного) для всех указанных гликозидов наблюдается увеличение ЭЭП вследствие повышения заряда. Сравнение последовательности миграции и степени разделения флавонов и флаванонов для боратного и карбонатного электролитов свидетельствует о существенных отличиях. Например, при рН 10 в боратном электролите наблюдается следующая последовательность миграции: гесперидин → диосмин → нарингин → космосиин → гесперетин → витексин-2``-О-рамнозид → диосметин → апигенин → лютеолин. Тогда как для карбонатного при этом же уровне рН последовательность иная: диосмин → космосиин → гесперидин→нарингин→ витексин-2``-О-рамнозид→ гесперетин- → диосметин → апигенин+лютеолин. Также нужно отметить, что в карбонатном электролите наблюдалось размывание зоны лютеолина, в связи с чем отмечается низкая селективность анализа пары апигенин/лютеолин в данных условиях, по сравнению с боратным электролитом.
Что касается флавонолов и флаванонолов, то в их анализе возможно использование ведущих электролитов в более широком диапазоне рН, так как уже при рН 8 все анализируемые соединения обладают ЭЭП, т.е. имеют достаточный эффективный заряд. Последовательность миграции флавонолов и флаванонолов в целом схожа для боратного электролита в сравнении сфосфатным и карбонатным. Однако, тем не менее, для ряда соединений наблюдается различная последовательность миграции в зависимости от состава электролита при одних и тех же значениях рН (рис. 2). Немаловажным также является тот факт, что в фосфатном и карбонатном электролите с увеличением значений рН электролита наблюдается усиление размывания зон кверцетина и дигидрокверцетина, что приводит к потере чувствительности и требует использования более высоких концентраций веществ.
В связи с этим,по результатам эксперимента, сравнивались параметры эффективности всех изучаемых соединений в боратном и карбонатном электролитах в зависимости от рН (табл.3). Этот аспект имеет значения для практического использования того или иного буферного раствора в анализе флавоноидов в растительных объектах, так как присутствие большого количества сопутствующих компонентов требует наличия достаточно высоких параметров эффективности и чувствительности методик.
Таблица 3
Сравнительный анализ параметров эффективности флавоноидовот рН для карбонатного и боратного электролитов
|
Флавоноид |
Эффективность, тыс. т.т |
|||||||
|
рН фосфатного (8) и карбонатного (9,2; 10,0; 10,8) электролитов |
рН боратного электролита |
|||||||
|
8,0 |
9,2 |
10,0 |
10,8 |
8,0 |
9,2 |
10,0 |
10,8 |
|
|
Ap |
356 |
253 |
317 |
217 |
393 |
473 |
563 |
196 |
|
Cos |
507 |
232 |
232 |
282 |
102 |
166 |
259 |
208 |
|
Vit |
194 |
503 |
482 |
465 |
203 |
484 |
479 |
478 |
|
Lut |
50 |
149 |
109 |
43 |
199 |
197 |
455 |
196 |
|
Dt |
93 |
444 |
323 |
342 |
237 |
474 |
498 |
513 |
|
D |
- |
320 |
406 |
418 |
- |
296 |
680 |
613 |
|
Ht |
92 |
366 |
263 |
275 |
413 |
497 |
542 |
559 |
|
H |
- |
601 |
335 |
317 |
- |
442 |
654 |
658 |
|
Nar |
- |
764 |
585 |
597 |
- |
296 |
467 |
419 |
|
Kaemp |
375 |
310 |
226 |
324 |
392 |
202 |
265 |
227 |
|
Astr |
544 |
452 |
422 |
414 |
543 |
637 |
619 |
570 |
|
Quer |
64 |
214 |
57 |
6 |
65 |
232 |
269 |
202 |
|
Rut |
242 |
498 |
339 |
31 |
60 |
448 |
243 |
322 |
|
Hyp |
118 |
372 |
432 |
414 |
308 |
321 |
175 |
223 |
|
DHQ |
250 |
250 |
281 |
9 |
367 |
405 |
262 |
227 |
Приведенные в таблице 3 результаты свидетельствуют, что практически для всех флавоноидов на всех уровнях рН наилучшая эффективность достигается при использовании боратного электролита. Этосвидетельствует о его преимуществе при выборе ведущего электролита для анализа флавоноидов в сложных растительных объектах.
Такие различия в поведении флавоноидов в зависимости от состава электролита могут быть связаны со способностью флавоноидов вступать в процессы комплексообразования с компонентами боратного электролита, в то время как в среде фосфатного и карбонатного электролитов комплексы не образуются [14].
Известно, что при растворении тетрабората натрия в воде происходит диссоциация соли с образованием гидратированного аниона:
Na2B4O7 + 2H2O = 2Na+ + [B4O5(OH)4]2-
Гидратированный тетраборат-ион имеет сложное строение. При дальнейшем взаимодействии с водой этот сложный анион превращается в четыре молекулы B(OH)3 и выделяет два гидроксид-иона, которые и обеспечивают щелочную реакцию раствора. Реакция протолиза отвечает уравнению[1]:
B4O72- + 11H2O = 4[B(H2O)(OH)3] + 2OH-
Дигидроксисоединения в щелочных условиях образуют бораты, как показанонарисунке3. Борная кислота (B0),являясь кислотой Льюиса, связывает гидроксильные ионы, образуя при этом борат-анионы (B-). Как борная кислота, так и борат реагируют с дигидроксисоединением(L), в результате чего образуется эфир борной кислоты (B0L) имоноэфир-борат (B-L), соответственно. Впоследствии оба эфира могут реагировать с другим дигидроксисоединением, в результате чего образуется диэфир (B-L2)[12].
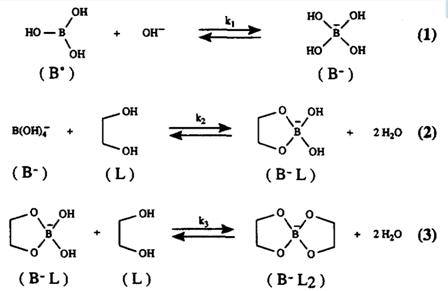
Рис.3. Равновесие между борной кислотой, борат-ионом и диолами в щелочной среде
Причем в реакцию комплексообразования могут вступать как фенольные диольные группы агликонов, так и диольные группы сахарных фрагментов гликозидов флавоноидов[12;18].В последнее время рядом авторов комплексообразование борной кислоты и флавоноидов представляются в виде следующих продуктоввзаимодействия (рис. 4)[7].
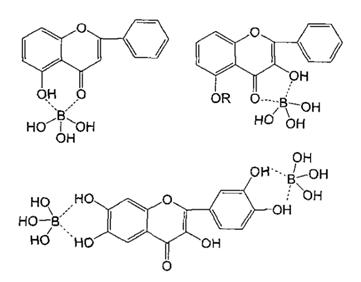
Рис.4.Продукты взаимодействия борной кислоты с флавоноидами
Таким образом, образующиеся боратные комплексы будут обладать собственной ЭЭП, отличной от ЭЭП самих флавоноидов.
Еще одним подтверждением образования комплексов может послужить сравнительное изучение изменений ЭЭП в зависимости от рН электролитов разных составов.
На рисунках 5-8 представлены графики зависимости ЭЭП (µэф) от рН для электролитов разных составов.
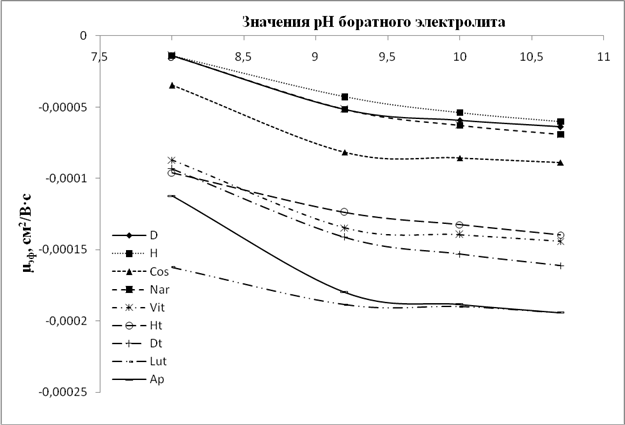
Рис.5. Графики зависимости значений µэф флавонов и флаванонов от рН боратного электролита
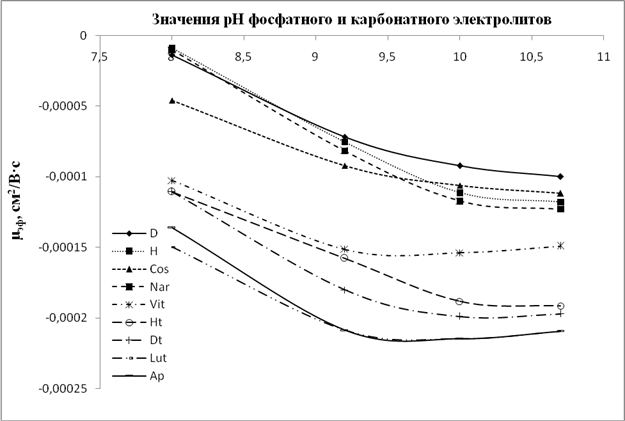
Рис.6. Графики зависимости значений µэф флавонов и флаванонов от рН карбонатного электролита (рН 9,2; 10; 10,8) и фосфатного (рН 8)
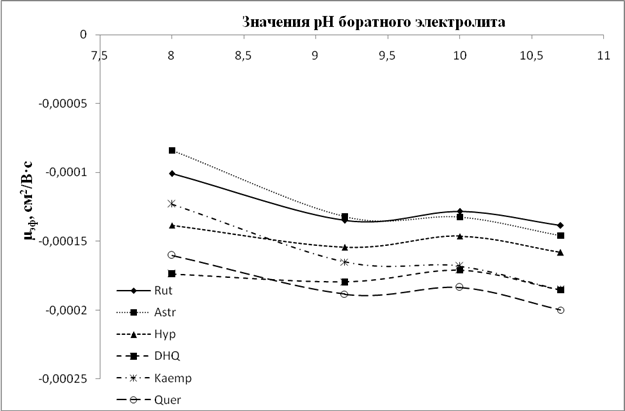
Рис.7. Графики зависимости значений µэф флавонолов и флаванонолов от рН боратного электролита
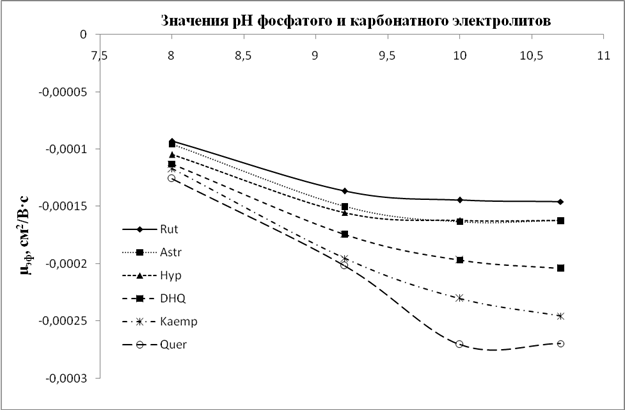
Рис. 8. Графики зависимости значений µэф флавонолов и флаванонолов от рН карбонатного электролита (рН 9,2; 10; 10,8) и фосфатного (рН 8)
Анализ данных зависимостей показывает, что для всех флавоноидов, и особенно для флавонолов и флаванонолов, при значении рН боратного электролита 9,2 и более наблюдается некая стабилизация ЭЭП, хотя при этом в ряде случаев меняется селективность анализа (например, пары рутин/астрагалин и дигидроксикверцетин/кемпферол (рис. 2A)).В то время как для фосфатного и карбонатного электролитов тренд на увеличение значений ЭЭП с ростом рН сохраняется для большинства анализируемых флавоноидов. Данное различие свидетельствует, что при рН около 9 происходит образование комплексов диольных групп флавоноидов с компонентами боратного электролита. Данные комплексы стабильны в щелочной среде и менее подвержены влиянию повышения рН среды, нежели сами флавоноиды в условиях фосфатного и карбонатного электролитов. При этом флавоноиды с ростом рН продолжают ионизироваться в большей степени, по сравнению с комплексами, что увеличивает эффективный заряд частицы и приводит к росту ЭЭП.
Анализируя поведение флавоноидов в боратном электролите, можно отметить ряд особенностей. В частности, флавоноиды мигрируют двумя зонами: сначала зона гликозидов, потом агликонов. Это связано с бо̀льшим размером (радиусом) частиц гликозидов, что, соответственно, снижает их ЭЭП. Ввиду сложностиопределения радиуса частиц ряд источников рекомендует пользоваться значениями молекулярных масс (M.r.), для которых также выявлена взаимозависимость с ЭЭП[14]. Влияние массы (размера) частицы на ЭЭПсохраняется и для структурно близких пар гесперидин/диосмин, гесперетин/диосметин, дигидроксикверцетин/кверцетин. Различие всего в два атома водорода позволяет разделить данные пары во всем диапазоне рН. Причем, ввиду меньшей массыдиосмин, диосметин и кверцетин мигрируют после гесперидина, гесперетина и кверцетина соответственно. Исключением в данной тенденции выглядит поведение витексин-2``-О-рамнозида (M.r.=578) по сравнению, например, с космосиином (M.r. = 432). Учитывая их структурную близость (оба производные апигенина), а также то, что витексин-2``-О-рамнозид является дисахаридом апигенина, в то время как космосиин – моносахарид, то можно было бы ожидать миграцию витексин-2``-О-рамнозида раньше космосиина. Однако на практике наблюдается обратная ситуация, причем ЭЭПвитексин-2``-О-рамнозида настолько велика, что превышает таковую для некоторых агликонов (гесперетин). Это объясняется тем, что витексин-2``-О-рамнозид является С-гликозидом и соответственно гидроксил в 7 положении не замещен по сравнению с космосиином. По данным литературы, наиболее «кислыми» являются 7-ОН- и 4'-ОН-группы[7].За счет ионизации данных гидроксиловповышениезаряда частицыбудет существенным, что и происходит в случае с витексин-2``-О-рамнозидом.Анализ поведения некоторых пар агликонов (апигенин/лютеолин, кемпферол/кверцетин) показывает, что лютеолин и кверцетин мигрируют после апигенина и кемпферола соответственно. Это объясняется присутствием большего количества фенольных гидроксилов в кольце B. Ионизация данных гидроксилов повышает заряд частиц и, как следствие, приводит к возрастанию значений ЭЭП.
Таким образом, по результатам проведенных исследований можно сформулировать ряд методологических подходов к анализу флавоноидов в условиях КЗЭ.
1. Для анализа флавоноидов в условиях КЗЭ целесообразнее использовать боратный электролит с рН 9,2–10,8, т.к. он, за счет процессов комплексообразования, позволяет достичь более высоких параметров эффективности и селективности.
2. Увеличение рН от 9,2 до 10,8 в целом не существенно влияет на ЭЭП большинства флавоноидов, в связи с чем этот подход применим в некоторых случаях при необходимости повышения селективности анализа.
3. Для предварительного моделирования электрофоретического поведения флавоноидов в боратном электролите необходимо учитывать, что ЭЭПвозрастает с уменьшением массы (размера) веществ, а также с увеличением количества фенольных гидроксилов.
Выводы
Проведено изучение электрофоретического поведения 15 флавоноидов в ведущих электролитах различного состава и рН. Показано, что боратный электролит обладает преимуществом по эффективности и селективности анализа за счет процессов комплексообразования с диольными группами флавоноидов. Установлено, что в боратном электролите при рН среды от 9,2 до 10,8значения ЭЭП меняются,как правило,не существенно, что позволяет использовать значение рН равное 9,2 в качестве основного.В работе показана взаимосвязь ЭЭП флавоноидов от их массы (размера) и количества фенольных гидроксилов. С использованием полученных результатов сформулирован ряд методологических подходов по анализу флавоноидовметодом КЗЭ.
Рецензенты:Кодониди И.П., д.фарм.н., доцент кафедры органической химии ПМФИ – филиала ГБОУ ВПО «ВолгГМУ» Минздрава России, г. Пятигорск.
ПоповаО.И., д.фарм.н., профессор кафедры фармакогнозии ПМФИ – филиала ГБОУ ВПО «ВолгГМУ» Минздрава России, г. Пятигорск.
Библиографическая ссылка
Сенченко С.П., Компанцева Е.В. ИЗУЧЕНИЕ ЭЛЕКТРОФОРЕТИЧЕСКОГО ПОВЕДЕНИЯ ФЛАВОНОИДОВ С ЦЕЛЬЮ РАЗРАБОТКИ МЕТОДОЛОГИЧЕСКИХ ПОДХОДОВ К ИХ АНАЛИЗУ В УСЛОВИЯХ КАПИЛЛЯРНОГО ЗОННОГО ЭЛЕКТРОФОРЕЗА // Современные проблемы науки и образования. – 2015. – № 4. ;URL: https://science-education.ru/ru/article/view?id=20806 (дата обращения: 20.04.2024).