Изучение процессов морфогенеза печени на различные критические периоды эмбрионального и постэмбрионального онтогенеза ведет к пониманию степени зрелости и функциональных возможностей органов и организма в целом. Анализ этапов онтогенеза птиц позволяет лучше понять вектор эволюционных адаптаций к факторам среды обитания – усложнение и совершенствование морфогенеза печени в связи с высокой интенсивностью метаболических процессов, становлением новых механизмов устойчивости к стрессу, анатомо-физиологическими особенностями, связанными с полетом, особенностями организации генома [6; 8]. С этих позиций актуально изучение морфофункциональных особенностей развития органов и тканей, которые непосредственно участвуют в поддержании гомеостаза организма. Одним из органов является печень. Полифункциональность, быстрота вовлечения в деструктивные и репаративные процессы определяет интерес исследователей к сравнительному изучению закономерностей структурно-функциональной организации печени в эмбриональные и постэмбриональные сенситивные периоды развития, анализу адаптационных перестроек, выявлению механизмов, обеспечивающих развитие организма в целом [1]. Регенеративная биология рассматривает поддержание тканевого гомеостаза на организменном уровне (интегральные показатели крови), межклеточных стромально-паренхимных цитокоммуникаций органа, динамическому балансу между погибшими и пролиферирующими клетками на различные периоды онтогенеза согласно уровневости организации биологических систем. Антропогенные химические, физические и биологические факторы оказывают прямое и опосредованное, комбинированное и комплексное действие на организм птиц [2]. Таким образом, к жизни в городе приспосабливаются виды, которые имеют определенный адаптивный резерв, или широкой нормой реакции [7]. Соответственно экологический стресс, который испытывают городские популяции, выше. В связи с этим целью нашей работы является изучить динамику показателей клеточного состава периферической крови, переключение путей ПКГ гепатоцитов и их регуляцию, динамику стромально-паренхимных сопряженностей печени птиц вида Columbalivia в критические периоды эмбрио- и постэмбриогенеза.
Материалы и методы исследования
Для решения поставленных задач эксперимент поставлен на группе птиц вида Columbalivia (formadomestica) Gmelin, 1789. Все серии экспериментов проводили в две повторности на период эмбриогенеза – 16 сутки и на 40 сутки постэмбриогенеза. Декапитация и забор материала для исследований проводился под легким эфирным наркозом. В каждой экспериментальной группе было по 20 особей. Для изучения интегральных показателей организма проводили забор периферической крови птиц. На препаратах проводили подсчет лейкоцитарной формулы. Для изучения и анализа стромально-паренхимного соотношения цитотипов печени, путей ПКГ, процессов пролиферации гепатоцитов использовали метод иммунофенотипирования [9]. Подсчет числа клеток в трех зонах ацинуса на световом микроскопе AxioImagerA1 с помощью программного обеспечения Axiovisionrev. 4.7. («CarlZeiss», Германия). Показатели пролиферации гепатоцитов определяли с помощью выявления антител к белкам-маркерам PCNA (разведение 1:100, Novocastra). В дальнейшем проводился подсчет на 1000 гепатоцитов и PCNA-позитивных и количества двуядерных форм гепатоцитов(‰). Количество и пространственную локализацию десмин-синтезирующей популяции клеток Ито проводили с помощью выявления антител к десмину (NCL-L-DES-DERIL, разведение 1:50, Novocastra); тканевых макрофагов с помощью выявления антител к CD68 (разведение 1:25, Termoscientific). Анализ путей и регуляции программируемой клеточной гибели (ПКГ) проводили с использованием антител к белкам-маркерам каспазы-3 (СРР32, Novocastra), к белкам LC3А/B (Abcam, Великобритания), белкам-маркерам р53 и bcl-2 (Novocastra, Германия). Статистическую обработку полученных данных осуществляли с помощью пакета прикладных программ «STATISTICA-6». Различия считались значимыми при р=0,05. При проведении эксперимента руководствовались принципами гуманного отношения к животным в соответствии с Международными рекомендациями [4].
Результаты и их обсуждение
Период эмбрионального развития характеризуется дефицитом парциального содержания кислорода, не сформированной системой терморегуляции, толерантной стратегией метаболической адаптации [5; 6; 14]. Гистологическое строение паренхимы печеночного ацинуса трубчатого типа (рис. 1Г). Клеточный состав периферической крови характеризуется значимым преобладанием лимфоцитов и сегментоядерных нейтрофилов, что отражает формирование иммунной системы эмбриона [9]. Бóльшее количество погибших гепатоцитов определяется в центролобулярной зоне ацинуса, при этом ведущим путем гибели гепатоцитов является апоптоз (I тип), о чем можно судить по количеству СРР32-позитивных гепатоцитов (рис. 1А). II тип гибели гепатоцитов – аутофагия, исходя из количества LC3A/B-позитивных гепатоцитов, реализуется в перивенулярной зоне на фоне высокого количества р53-позитивных гепатоцитов (рис. 1Б). По всей видимости, в условиях недостатка питательных веществ р53 регулирует синтез белка LC3А/В – одного из ключевых участников процесса аутофагии [3; 13]. Наименьшее количество СРР32-позитивных выявлено в области портального тракта, данная сопряженность в реализации апоптоза соотносится с высоким уровнем экспрессии антиапоптического белка bcl-2, который служит фактором выживания гепатоцитов [12], предполагают, что bсl-2 может подавлять апоптоз путем регулируемого переноса [Са2+] через мембрану ЭПР [11]. В центролобулярной зоне выявлено большое число PCNA-позитивных – и двуядерных форм гепатоцитов.
Наибольшее количество тканевых макрофагов выявлено в области портального тракта, а десмин-позитивных клеток Ито – в центролобулярной. Выявленное наибольшее число CD68-позитивных макрофагов, по всей видимости, связано с детоксикацией поступающих ксенобиотиков с током крови, усилением процессов по утилизации клеточного детрита, а также отражает процесс дифференцировки тканевых макрофагов из моноцитов крови.
Таким образом, цитокоммуникации в процессе морфогенеза представлены центролобулярной зоне сопряженностями таких показателей, как – большое число СРР32- так и LC3A/B-позитивныхгепатоцитов (в большей мере СРР32-позитивных) с трансформацией клеток Ито в десмин-позитивные и увеличением числа двуядерных и PCNA-позитивных гепатоцитов. По всей видимости, активирующим фактором для трансформации клеток Ито стала потеря контактного торможения с гепатоцитов в связи с их гибелью и TGF-a , который высвобождается при гибели гепатоцитов [10]. При этом так как активированные клетки Ито являются единственным в печени источником фактора роста гепатоцитов HGF, который создает благоприятные условия микроокружения для дифференцировки двуядерных гепатоцитов denovo.
В перивенулярной зоне – на фоне повышенной экспрессии гепатоцитами р53 отмечается в большей мере реализация ПКГ по пути аутофагии, при этом количество bcl-2-, PCNA-позитивных гепатоцитов и десмин-позитивных клеток Ито минимально.
В области портального тракта – на фоне высоких показателей числа тканевых макрофагов, десмин-позитивных клеток Ито и экспрессии гепатоцитами белка bcl-2 выявлено снижение числа двуядерных гепатоцитов, количества погибших гепатоцитов по пути аутофагии и экспрессии гепатоцитами р53.
К 40-м суткам постэмбриогенеза отмечается интенсивный рост организма, устанавливается гомойотермная температура тела, начинается период активных полетов [8]. Строение паренхимы печеночного ацинуса – трубчато-трабекулярное (рис. 2Г). В периферической крови количество сегментоядерных нейтрофилов, эозинофилов, базофилов более чем на 30 % увеличивается, однако количество палочкоядерных нейтрофилов на 43 % уменьшается, что может быть следствием стимулирующего действия лейкопоэтинов, адренокортикотроного и соматотропного гормона, нервной системы. Выявленное увеличение числа эозинофилов, по-видимому, связано с их участием в процессах каскадной регуляции функционирования клеток периферической крови.
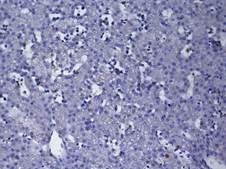 А
А Б
Б
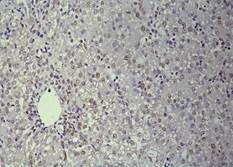 В
В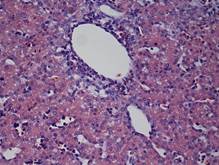 Г
Г
Рис. 1. Печень эмбрионов Columbalivia на 16 сутки развития. Увеличение ок10хоб20. Окрашивание антителами к СРР32 (А), антителами к LC3A/B (Б), антителами к PCNA(В). Протокол HIAR (HeatInducedAntigenRetrieval), стрептавидин-биотиновый метод (LSAB), хромоген АЭК. Окраска гематоксилин-эозин (Г)
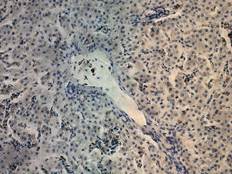 А
А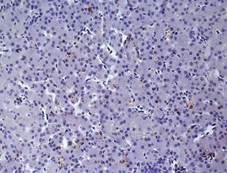 Б
Б
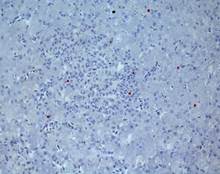 В
В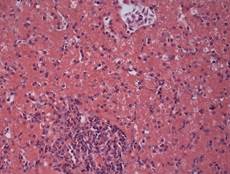 Г
Г
Рис. 2. Печень Columbalivia на 40 сутки постэмбрионального развития. Увеличение ок10хоб20. Окрашивание антителами к СD-68 (А), антителами к bcl-2 (Б), антителами к р53 (В). Протокол HIAR (HeatInducedAntigenRetrieval), стрептавидин-биотиновый метод (LSAB), хромоген АЭК. Окраска гематоксилин-эозин (Г), очаг некроза
В динамике изменения количества лимфоцитов выявлено уменьшение их числа на 22 %, а, следовательно, некоторое угнетение показателей гуморального иммунитета, тогда как количество моноцитов в 6 раз увеличивается. Столь резкое увеличение числа моноцитов отражает участие в формировании вместе с тканевыми макрофагами печени единой моноцитарно-макрофагальной системы и, следовательно, обеспечение естественной резистентности организма, и ранние проявления специфического иммунного ответа.
Во всех зонах ацинуса уменьшается число PCNA-позитивных гепатоцитов.
Согласно результатам иммунофенотипирования цитотипов печени в перипортальной зоне выявлено увеличение количества СРР32- и LC3A/B-позитивных гепатоцитов, причем в большей мере LC3A/B-позитивных – на 59 %. На фоне этого отмечено увеличение числа десмин-позитивных клеток Ито и снижение числа двуядерных форм гепатоцитов.
В центролобулярной зоне на фоне уменьшения числа PCNA-позитивных гепатоцитов снижается количество тканевых макрофагов.
В области центральных вен – на фоне увеличения экспрессии гепатоцитамиbcl-2 (рис. 2Б), выявлено увеличение числа двуядерных форм гепатоцитов, это является отражением активации ацитокинетических митозов. В то же время снижается количество тканевых макрофагов (рис. 2А) и десмин-позитивных клеток Ито.
Таким образом, в изучаемые критические периоды эмбрио- и постэмбриогенеза морфогенез печени сопровождается как деструктивными, так и пластическими изменениями. Эти реакции обеспечивают реализацию «функциональной сверхзадачи» механизмов срочной адаптации, которые, в свою очередь, обеспечивают поддержание тканевого гомеостаза на различных сроках онтогенеза. Выявленные изменения изучаемых показателей во многом определяют скорость, масштабы, способы и эффективность этапов регенерации, а эволюционно сформированная пространственно-топографическая цитокоммуникативная сопряженность – функционирование органа.
Рецензенты:
Молдавская А.А., д.м.н., профессор кафедры анатомии человека ГОУ ВПО «Астраханская государственная медицинская академия», г. Астрахань;
Мкртчан О.З., д.б.н., профессор кафедры биологии и биологического образования ФГОБУ ВПО Омский государственный педагогический университет, г. Омск.
Библиографическая ссылка
Хамитова Л.Е. ДИНАМИКА ИНТЕГРАЛЬНЫХ ПОКАЗАТЕЛЕЙ ОРГАНИЗМА И МОРФОГЕНЕЗ ПЕЧЕНИ ПТИЦ В КРИТИЧЕСКИЕ ПЕРИОДЫ ЭМБРИОНАЛЬНОГО И ПОСТЭМБРИОНАЛЬНОГО ОНТОГЕНЕЗА // Современные проблемы науки и образования. – 2015. – № 5. ;URL: https://science-education.ru/ru/article/view?id=21496 (дата обращения: 20.04.2024).



