Бурую ржавчину пшеницы вызывает биотрофный паразитический гриб Puccinia triticina Erikss. Микроэволюционные процессы в популяциях P. triticina приводят к регулярному появлению новых вирулентных рас и преодолению устойчивости растений. Для создания сортов с длительной устойчивостью актуально исследование комплекса механизмов, стабильно защищающие иммунные виды от патогенов.
Мало окультуренный вид Triticum timopheevii Zhuk. отличается иммунитетом к грибным болезням и считается одним из перспективных доноров генов устойчивости [1]. Защитные механизмы пшеницы Тимофеева к ржавчине мало изучены. Ранее была исследована генерация активных форм кислорода (АФК) в инфицированных P. triticina листьях T. timopheevii. Установлено, что в течение двух суток после инокуляции в тканях накапливался супероксид-анион О2•-, позже - перекись водорода Н2О2 [7].
Для расширения представлений о механизмах устойчивости T. timopheevii к ржавчинным грибам представляет интерес изучение роли полисахарида каллозы (β-1,3-глюкан) во взаимодействиях. Синтез каллозы может быть индуцирован абиотическими стрессами и обработкой элиситорами различных патогенов. Полисахарид откладывается на клеточных стенках, образуя барьер для проникновения веществ. Доказано участие каллозы во многих физиологических процессах растений (регуляция деятельности ситовидных клеток и плазмодесм, формирование серединной пластинки во время клеточных делений и др.) [2].
Синтез каллозы считают самостоятельным защитным механизмом, подавляющим или ограничивающим развитие патогенных грибов [8]. Взаимосвязь синтеза каллозы с другими защитными механизмами мало исследована. В связи с этим задачами работы были исследование роли каллозы в защите T. timopheevii от бурой ржавчины, а также выявление взаимосвязи между синтезом каллозы и накоплением перекиси водорода Н2О2.
Материалы и методы исследований
Объектами исследований были образцы Triticum timopheevii Zhuk. к-30920 и к-38555 из коллекции Всероссийского института растениеводства им. Н.И. Вавилова (ВИР). В качестве контроля использовали восприимчивый к бурой ржавчине сорт Памяти Азиева яровой мягкой пшеницы T. aestivum L. Для заражения использовали инокулюм популяции P. triticina, собранный на сортах мягкой пшеницы в Западной Сибири (г. Омск) в 2013 г. и размноженный в лаборатории. Опыты проводили на растениях в стадии проростков по бензимидазольной методике [4]. Тип реакции растений определяли через 10 суток после инокуляции (п/ин) по 5-балльной шкале: балл 0-2 - устойчивость, 3-4 - восприимчивость [10].
Цитологические исследования проводили на листьях, фиксированных лактофенолом через 1; 2; 3; 5, 10 суток после инокуляции (п/ин). Локализацию Н2О2 определяли путем витального окрашивания листьев 0,02 %-ым водным раствором 3,3'-диамино-бензидин тетрахлорида (ДАБ) («Sigma», США) с помощью вакуум-инфильтрации, через 30 мин материал фиксировали в лактофеноле. В присутствии ДАБ Н2О2 образовывала вишневое соединение [9]. Для выявления структур гриба и реакции СВЧ листья окрашивали 1%-ным анилиновым синим в лактофеноле, затем дифференцировали окраску насыщенным водным раствором хлоралгидрата, при этом структуры гриба и отмершие клетки растения окрашивались в синий цвет. Присутствие полисахарида каллозы выявляли окрашиванием тех же листьев 1%-ным кораллином (аурин) в 4%-ном водном растворе соды Na2CO3 в течение 20-30 мин, затем дифференцировали окраску в растворе соды, при этом каллоза окрашивалась в красно-розовый цвет [5]. Размеры колоний и пустул, зон образования каллозы и Н2О2 измеряли с помощью окуляр-микрометра, их площадь вычисляли по формуле площади эллипса. Цитологические исследования проводили на 10-ти растениях каждого образца T. timopheevii, а также 5-ти растениях мягкой пшеницы с помощью светового микроскопа Axioscop («Carl Zeiss», ФРГ). В статье приведены средние значения по данным и их стандартные ошибки.
Результаты исследований и их обсуждение
На первом этапе работы был определен тип реакции растений на заражение P. triticina. На листьях восприимчивого сорта T. aestivum (контроль) формировались крупные пустулы (балл 4). Большинство растений (70%) образца к-38555 были иммунны, на их листьях пустулы гриба не развивались, появлялись лишь мелкие некротические пятна (балл 0), а на остальных образовывались мелкие пустулы, окруженные зонами отмершей ткани (балл 1). Образец к-30920 был более восприимчив в болезни, в нем 30% растений были иммунны, на остальных развивались пустулы, окруженные зонами некроза или хлороза (баллы 1-3).
Цитологические исследования показали, что на листьях восприимчивого сорта мягкой пшеницы споры образовывали ростковые трубки, которые двигались к устьицам и образовывали на них аппрессории для проникновения гриба в ткани. Затем в тканях развивался мицелий с большим числом гаусторий (рис. 1 а), а через 10 сут п/ин формировались большие пустулы (средняя площадь 371,2±49,1 тыс. мкм2) (рис. 1 б).
Выявлено несколько вариантов взаимоотношений пшеницы Тимофеева с P. triticina:
I - остановка развития гриба на поверхности листа на стадии ростковой трубки;
II - отмирание патогена после контакта с устьицами на стадиях аппрессория, подустьичной или инфекционной гифы (рис. 1 в);
III - гибель колоний после внедрения гаусторий в единичные клетки растений и отмирания их в результате реакции СВЧ;
IV - подавление образования гаусторий, замедление роста и абортация колоний через 3-5 сут п/ин без проявления реакции СВЧ (рис. 1 д);
V - развитие колоний и формирование пустул меньшего размера, чем в контроле (в к-3855 - в 11 раз; в 30920 - в 4-8 раз) (рис. 1 е). На восприимчивых растениях (балл 3) в зоне колоний и пустул признаков несовместимости до спороношения не отмечено. На устойчивых растениях (балл 1-2) в центре части колоний отмечена гибель единичных клеток растений в результате реакции СВЧ, но гифы гриба выходили за пределы зоны некроза (рис. 1 г).
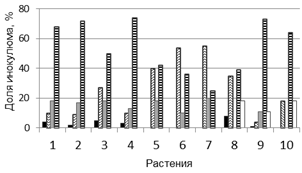
Таким образом, на растениях T. timopheevii существенная доля инокулюма (15-40%) гриб погибал до внедрения в клетки растения (варианты I, II), в вариантах III, IV и V образовывал разветвленный мицелий, но пустулы появлялись только в варианте V. Описанные варианты взаимодействия в разных сочетаниях и соотношениях установлены в растениях двух образцов T. timopheevii (рис. 2 а, б). Эти результаты подтверждают ранее полученные данные о полиморфизме растений T. timopheevii по признаку устойчивости к болезни, а также о характерных способах взаимодействия P. triticina с растениями [6]. Однако результаты взаимодействия образцов с популяциями 2011 и 2013 гг. количественно отличались, что может быть объяснено как случайным выбором семян для экспериментов, так и изменением состава популяции P. triticina.

Рис.1. Особенности развития P. triticina и реакций растений Triticum aestivum (а, б) и T. timopheevii (в - к): а - мицелий в листе восприимчивого сорта; б - пустула на листе восприимчивого сорта; в - аппрессорий, погибший на устьице; г - колония в листе устойчивого растения, инфекционные гифы выходят за зону реакции СВЧ; д - абортивная колония с вакуолизированными клетками; е - маленькая пустула на листе восприимчивого растения, окруженная клетками с отложениями каллозы; ж - каллоза на стенках клеток растения, погибших в результате реакции СВЧ, и локальные отложения в местах контакта с отмирающими гифами (стрелки) (5 сут п/ин); з - отложения каллозы в зоне колоний с реакцией СВЧ и без нее (стрелки) (10 сут п/ин); и - аккумуляция Н2О2 в цитоплазме, на стенках клеток (белые стрелки) и в межклеточном пространстве (черные стрелки); к - интенсивная аккумуляция Н2О2 в зоне реакции СВЧ и слабое накопление в зоне колонии, погибшей независимо от реакции СВЧ (стрелки).
 а
а 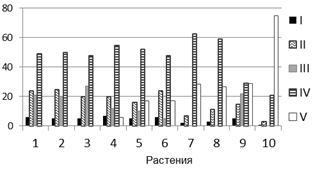 б
б
 в
в 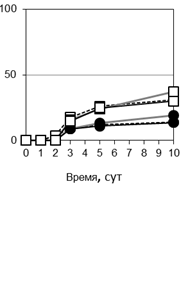 г
г 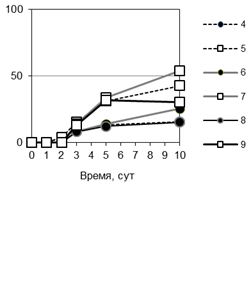 д
д
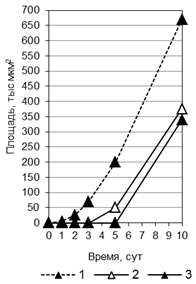
Рис. 2. Особенности взаимодействия P. triticina c T. timopheevii к-38555 (а, г), к-30920 (б, д) и T. aestivum (в): а, б - соотношение вариантов взаимодействия (I-V) гриба с растениями (от нанесенного инокулюма); в - д - динамика роста мицелия (1, 4, 5), увеличения зон синтеза каллозы (2, 6, 7) и аккумуляции Н2О2 (3, 8, 9).
Изучение динамики развития колоний показало, что в восприимчивом сорте пшеницы мицелий в течение первых 2 сут п/ин занимал малую площадь, затем скорость распространения мицелия резко увеличивалась. Значимые различия в динамике развития колоний между контролем и несовместимыми вариантами взаимодействия III, IV проявились через 2 сут п/ин (рис. 2 в-д). Цитохимические исследования показали, что в зараженных листьях мягкой пшеницы (контроль) слабый синтез каллозы отмен только в тканях под пустулами. Сходные отложения каллозы отмечены под пустулами на листьях T. timopheevii (рис. 1 е).
При изучении развития P. triticina на T. timopheevii внимание было сосредоточено на взаимодействиях, приводящих к ингибированию патогена (варианты I-IV). Не установлено накопления каллозы при остановке развития гриба на поверхности листа и при попытке внедрения в устьица T. timopheevii (варианты I, II). Интенсивные отложения каллозы обнаружены на стенках клеток растений, погибших в результате реакции СВЧ, через 3 сут п/ин и позднее (вариант 3) (рис. 1 ж). Для варианта IV было характерно интенсивное подавление образования гаусторий и отмирание колоний через 3-5 сут п/ин. В этом случае синтез каллозы был выражен слабее, чем в варианте III, проявлялся после замедления и прекращения роста колоний, преимущественно на участках стенок, контактировавших с вакуолизированными гифами. К концу эксперимента отложения становились толще. Зоны синтеза каллозы в вариантах III и IV были тесно взаимосвязаны с размерами колоний. К концу эксперимента усиливался синтез каллозы на стенках клеток вокруг колоний (рис. 2 г, д).
Ранее было установлено, что в зараженных бурой ржавчиной растениях T. timopheevii через 3-10 сут п/ин накапливалась Н2О2 [7]. Известно, что АФК являются мессенджерами сигнальной трансдукции и участвуют в активации набора защитных реакций [3]. В связи с этим была изучена взаимосвязь между продукцией Н2О2 и синтезом каллозы. При совместимом взаимодействии P. triticina с мягкой пшеницей и T. timopheevii слабое накопление Н2О2 отмечено только в момент спороношения под пустулами, в меньшей зоне, чем синтез каллозы (рис. 2 в). В вариантах взаимодействия I и II Н2О2 не выявлена. Однако при взаимодействиях, сопровождающихся реакцией СВЧ (вариант III), отмечено интенсивное накопление Н2О2 в зоне колонии, сначала в цитоплазме погибших клеток, позже - на клеточных стенках и в межклеточном пространстве (рис.1 и). В варианте IV умеренное накопление Н2О2 обнаружено в цитоплазме клеток в центре колоний, а на периферии колоний АФК накапливались на клеточных стенках в местах контакта с отмирающими вакуолизированными гифами (рис. 1 к). Таким образом, распределение каллозы и Н2О2 в тканях, а также интенсивность их синтеза в двух образцах T. timopheevii были сходны.
Защитные реакции преимущественно проявлялись в зоне распространения мицелия (рис. 2 в-д). Корреляционный анализ показал для вариантов III и IV тесную взаимосвязь между размерами колоний и зонами каллозных отложений (r = 0,86-0,99) (таблица). Отмечена также высокая положительная корреляция между размерами зон синтеза каллозы и Н2О2 (10 сут п/ин) (r = 0,74-0,99). В тоже время в варианте V установлена отрицательная корреляция между размерами каллозных отложений и колоний. На стенках клеток растений вокруг небольших пустул наблюдались каллозные отложения, а по мере увеличения размеров колоний и пустул зоны синтеза каллозы сокращались.
Коэффициенты корреляции (r) между площадью колоний и зонами синтеза каллозы и H2О2 при разных вариантах взаимодействия P. triticina с растениями T. timopheevii
|
Образец |
Варианты взаимодействия |
||||
|
I |
II |
III |
IV |
V |
|
|
S колонии - S каллозы |
|||||
|
к-30920 |
- |
- |
0,91 |
0,99 |
-0,71 |
|
к-38555 |
- |
- |
0,99 |
0,86 |
-0,82 |
|
S каллозы - S H2О2 |
|||||
|
к-30920 |
- |
- |
0,98 |
0,99 |
0,74 |
|
к-38555 |
- |
- |
0,95 |
0,96 |
0, 81 |
В связи с биологическими свойствами каллозы предполагается ее двойственное защитное действие в патогенезе: 1) участие в образовании физического барьера, восстанавливающего целостность поврежденной клеточной стенки; 2) создание слоя, препятствующего поглощению питательных веществ из клеток хозяина [8]. Известно, что содержание каллозы в клетках растений динамически изменяется и зависит от активности ферментов с противоположным действием: каллозосинтетаза обеспечивает синтез каллозы, а β-1,3-глюканазы разрушают полисахарид при изменении физиологического состояния или после исчезновения индуктора. На клеточных культурах показано, что значительное повышение содержания каллозы происходило уже через 2-4 часа после обработки индукторами, а затем содержание каллозы в клетках снижалось в результате действия глюканаз [2]. На примере культуры клеток сои показано, что синтез каллозы зависим от поступления Са2+-ионов в цитоплазму [2]. В настоящее время известно, что ионные потоки и поляризация мембраны также необходимы для образования АФК - мессенджеров сигнальных систем, запускающих комплекс защитных реакций, включая укрепление клеточных стенок [3].
В наших экспериментах было показано, что большая часть инокулюма, нанесенного на растения T. timopheevii, погибала на разных стадиях патогенеза, что может быть связано с проявлением различных защитных механизмов. Интенсивный синтез каллозы был тесно связан с проявлением реакции СВЧ и накоплением в погибших клетках Н2О2. Эти события совпадали по времени с подавлением развития мелких колоний после образования нескольких гаусторий (вариант взаимодействия II), а также с замедлением развития колоний на поздних этапах патогенеза (вариант V). Эти результаты согласуются с данными изучения взаимодействия ржавчинного гриба Uromyces vignae Barclay. с иммунными сортами вигны. Показано, что гриб прекращал развитие после внедрения единичных гаусторий и гибели клеток растений в результате реакции СВЧ, при этом каллозные отложения появлялись вокруг гаусторий и на стенках погибших клеток [8], а в цитоплазме клеток растения накапливалась перекись водорода [9].
В наших экспериментах было показано, что гибель существенной доли аппрессориев не была связана с синтезом Н2О2 и каллозы (вариант II). Ранее было установлено, что на этой стадии взаимодействия основной защитной реакцией иммунных растений является образование супероксид-аниона, разрушающего структуры гриба [7]. Значительная часть колоний (от 25 до 75%), развивавшихся на растениях T. timopheevii, погибала независимо от реакции СВЧ (вариант IV). Ранее было показано, что гибель таких колоний связана с подавлением формирования гаусторий и голоданием паразита [7]. Вероятно, слабое накопление Н2О2 и каллозы имело неспецифический характер и было связано с реакцией на элиситоры, выделявшиеся из отмирающих клеток гриба. Ранее на примере взаимодействия U. vignae было показано, что усиление синтеза каллозы вокруг гаусторий происходит после инактивации антибиотиками или старения этих структур [8].
В проведенных исследованиях установлена тесная взаимосвязь между интенсивностью синтеза перекиси водорода и каллозы, а также локализацией этих защитных веществ в тканях. Известно, что уровень АФК в клетке регулируется многокомпонентной про/антиоксидантной системой, обеспечивающей накопление окислителей в местах инфекции для ингибирования патогенов, а также предотвращающих распространение токсичных молекул в соседние клетки [3]. Можно предположить, что каллоза участвует в защите здоровых клеток от перекиси водорода при ржавчинных болезнях.
Таким образом, проведенные исследования показали, что в растениях T. timopheevii синтез каллозы являются частью комплекса защитных механизмов от бурой ржавчины. Установлена тесная взаимосвязь между накоплением перекиси водорода в тканях устойчивых растений и синтезом каллозы. Вероятно, растения T. timopheevii обладают дополнительными механизмами устойчивости, не связанными с накоплением АФК и каллозы. Полученная информация может быть использована для создания растений с длительной устойчивостью к ржавчинным болезням.
Рецензенты:
Барайщук Г.В., д.б.н., профессор кафедры садоводства, лесного хозяйства и защиты растений ФГБОУ ВПО ОмГАУ им. П.А. Столыпина, г. Омск;
Баженова О.П., д.б.н., профессор кафедры экологии, природопользования и биологии ФГБОУ ВПО ОмГАУ им. П.А. Столыпина, г. Омск.
Библиографическая ссылка
Пожерукова В.Е., Плотникова Л.Я. ЗНАЧЕНИЕ КАЛЛОЗЫ И ПЕРЕКИСИ ВОДОРОДА В ЗАЩИТЕ ПШЕНИЦЫ ТИМОФЕЕВА ОТ БУРОЙ РЖАВЧИНЫ // Современные проблемы науки и образования. – 2015. – № 2-2. ;URL: https://science-education.ru/ru/article/view?id=23276 (дата обращения: 20.04.2024).



