Несмотря на высокий уровень финансирования фармацевтической отрасли для поиска и получения новых фармакологических веществ, количество разрабатываемых новых лекарственных препаратов, тем не менее, постоянно уменьшается [4]. При этом реальное количество новых веществ, полученных с помощью различных методов биологического или химического синтеза и претендующих на роль потенциальных лекарственных средств, значительно снизилось и составляет менее одного препарата в год на одну фармакологическую компанию.
В связи с этим, можно отметить стремление современных ученых разрабатывать новые медицинские технологии лечения и профилактики различных патологических состояний на основе нанотехнологий и наночастиц [1]. Так, при изучении моделей рака печени и молочной железы in vivo у лабораторных мышей многопрофильная группа ученых, инженеров и клиницистов установила, что обычно летальная доза химиотерапевтического препарата, связанная с наноалмазами, значительно уменьшает размер опухоли у животных. При этом уровень выживаемости повышается, а побочных токсических эффектов на ткани и органы не наблюдается [10].
Одним из приоритетных научных направлений нашего научно-образовательного центра «Морфология и физиология здорового человека» является «Разработка нанотехнологии биомедицинского назначения для создания новых медицинских технологий лечения социально значимых заболеваний». В качестве базового наноматериала мы выбрали наноалмазы детонационного синтеза.
Мы считаем наноалмазы высокоэффективным наноматериалом в силу их физико-химических свойств – размеры алмазных ядер 4–6 нм, удельная площадь поверхности до 420 м2/г, высокая сорбционная способность [8]. После дополнительной очистки по запатентованной технологии учеными Института биофизики СО РАН (г. Красноярск) наноалмазы приобретают уникальное свойство – высокую коллоидную устойчивость, что, на наш взгляд, делает их оптимальным материалом для разработки нанотехнологии биомедицинского значения [6, 7].
Для применения наноалмазов в этом качестве необходимо изучить эффекты их действия на организм при различных путях введения. В экспериментах, проведенных ранее, при внутривенном двукратном введении 0,3мл 1% золя модифицированных наноалмазов в 5% растворе глюкозы лабораторным крысам в хвостовую вену, гибели животных не наблюдалось. При многократном введении золей модифицированных наноалмазов собакам были отмечены незначительные преходящие изменения в ЭХО-структуре селезенки и деятельности сердца, регистрируемой на ЭКГ. Опыт был проведен на трех животных, у которых в дальнейшем не было выявлено патологических изменений на протяжении около полугода [9]. К сожалению, в этих экспериментах не было проведено морфологическое исследование внутренних органов экспериментальных животных.
Целью настоящего исследования - изучить влияние гидрозолей наноалмазов на строение внутренних органов экспериментальных животных при их внутривенном введении.
Материал и методы
Исходными наноалмазами были наночастицы, получаемые в НПО «Алтай» (г. Бийск), которые модифицировали по запатентованной методике [6, 7]. Раствор необходимой концентрации готовили путем добавления 5% раствора глюкозы к навеске порошка наноалмазов. Затем органозоль разливали в чистую стеклянную тару, герметично укупоривали резиновой пробкой с алюминиевой обкаткой и стерилизовали в автоклаве.
Для проведения эксперимента по внутривенному введению были использованы 10 кроликов породы «бабочка» (2800–3000г), самцы. Животных случайным образом разделили на 2 группы:
1) экспериментальная группа – 5 кроликов, которым однократно вводили 5 мл 1% раствора наноалмазов на 5 % растворе глюкозы;
2) контрольная группа – 5 кроликов, которым однократно вводили 5% раствор глюкозы.
Инъекции растворов проводили в краевую ушную вену.
Через 15 минут после введения наночастиц, кроликов выводили из эксперимента с соблюдением принципов эвтаназии согласно требованиям, изложенным в «Руководстве по лабораторным животным и альтернативным моделям в биомедицинских технологиях», разработанным ФГБУ «Научный центр биомедицинских технологий» РАМН [3]. При вскрытии животных оценивали внешний вид внутренних органов, для гистологических исследований забирали фрагменты сердца, легких, печени и почек и фиксировали их в течение 24 часов в 10% формалине. Изготовление гистологических препаратов и их окраску (гематоксилин-эозином и по методу Ван Гизон) осуществляли по стандартным методикам. Все гистологические препараты подвергали обзорной микроскопии для оценки общей гистоархитектоники и возможного распределения наноалмазов во внутренних органах. Морфологическое исследование проводили с помощью микроскопа Olympus BX45 c насадкой для фото-видеодокументации Olympus DP25 и пакетом компьютерного программного обеспечения Cell^D.
Результаты исследования и их обсуждение
При вскрытии трупов животных экспериментальной и контрольной групп органы расположены анатомически правильно, при макроскопическом исследовании нарушений в строении не выявлено. Сердце обычной формы и размеров, кровоизлияний под эпикард и эндокард нет, полости сердца заполнены жидкой темной кровью, на разрезе миокард полнокровный, красно-коричневого цвета, блестящий. Легкие заполняют плевральные полости, на разрезе бледно-розового цвета, с участками неравномерного полнокровия. Печень обычного анатомического строения, на разрезе полнокровная, темно-коричневого цвета. Почки бобовидной формы, на разрезе серо-синюшного цвета, неравномерного кровенаполнения.
При обзорной микроскопии гистологических препаратов сердца кроликов эксперментальной и контрольной групп эндокард, миокард и перикард имели обычное гистологическое строение, без патологических изменений.
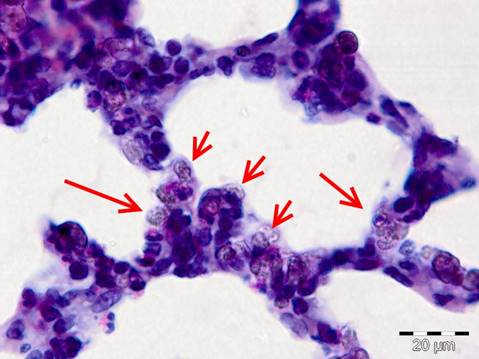
В легких кроликов экспериментальной группы в капиллярах были выявлены крупные светло-коричневые полупрозрачные гранулы, сливающиеся между собой. Данные частицы наблюдаются в большом количестве в мелких кровеносных сосудах (рис. 1). Разрушения стенок альвеол и мелких бронхов не выявлено. У животных контрольной группы гистоархитектоника органа сохранена, в просвете кровеносных сосудов наблюдаются только форменные элементы крови.
Рисунок 1. Наноалмазы в сосудах легких животных экспериментальной группы (показаны стрелочками). Окраска гематоксилин-эозин. Ув. х400.
В печени животных экспериментальной группы в синусоидных капиллярах долек также визуализируются мелкие светло-коричневые полупрозрачные гранулы, сливающиеся между собой (рис. 2), но гораздо в меньшем количестве, чем в легких – обнаруживается 1-2 конгломерата в поле зрения. У животных контрольной группы, также как и у животных экспериментальной группы, печень имеет дольково-балочное строение, но при этом в просвете синусоидных капилляров определяются только форменные элементы крови.
В почках животных экспериментальной группы в капиллярах клубочков также определяются мелкие полупрозрачные светло-коричневые гранулы (рис. 3).
В почках данные частицы встречаются значительно реже, чем в легких и в печени. Эпителий почечных канальцев без признаков некротических и дистрофических изменений. У животных контрольной группы гистологическая структура органа не нарушена, светло-коричневые частицы в почечных тельцах не обнаружены.
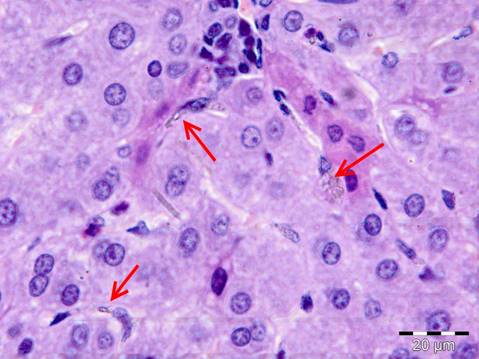 |
Рисунок 2. Наноалмазы в сосудах печени животных экспериментальной группы (показаны стрелочками). Окраска гематоксилин-эозин. Ув. х400.
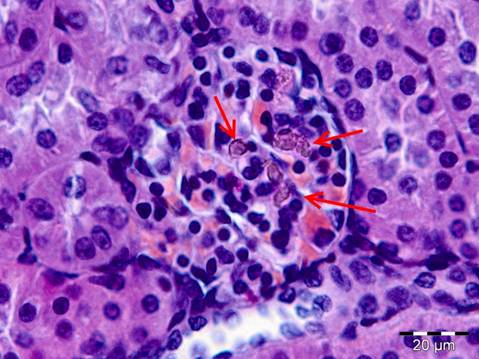 |
Рисунок 3. Наноалмазы в капиллярах почечного тельца животных экспериментальной группы (показаны стрелочками). Окраска гематоксилин-эозин. Ув. х400.
Учитывая отсутствие полупрозрачных светло-коричневых частиц в просвете капилляров органов животных контрольной группы, можно сделать предположение, что наблюдаемые гранулы в капиллярной сети органов животных экспериментальной группы являются конгломератами наноалмазов.
Заключение
Изучение структуры сердца, легких, печени и почек на органном и тканевом уровнях свидетельствует о том, что однократное внутривенное введение 5 мл 1% раствора наноалмазов в 5% растворе глюкозы не вызывает нарушений в структуре этих органов.
Через 15 минут после однократного внутривенного введения золей наноалмазов, конгломераты наночастиц в наибольшем количестве визуализировались в капиллярах легких, несколько реже – в капиллярах печеночных долек, наименьшее количество наночастиц – в капиллярах почечных телец. В сосудистом русле миокарда конгломераты наночастиц не визуализировались.
Такое распределение наноалмазов может свидетельствовать о том, что наноалмазы, попав в кровеносное русло, контактируют своей поверхностью с плазмой крови, растворенными в ней веществами, вследствие чего они теряют свою коллоидную устойчивость, адгезируя между собой, формируют крупные, видимые при световой микроскопии, конгломераты, которые в той или иной степени задерживаются капиллярной сетью легких. Кроме того, учитывая данные о том, что наноалмазы в организме экспериментальных животных могут фагоцитироваться макрофагами, можно предположить, что отсутствие конгломератов наноалмазов в сосудах сердца и наличие их в синусоидных капиллярах печени и сосудистом клубочке почечных телец обусловлено присутствием клеток макрофагальной природы – клеток Купфера в печеночных дольках и мезангиоцитов почечных телец. Также можно предположить, что альвеолярные макрофаги легких также играют определенную роль в распределении наноалмазов в организме экспериментальных животных.
Для дальнейшей разработки концепции применения модифицированных наноалмазов детонационного синтеза в качестве основы препаратов биомедицинского назначения, необходимо проведение ряда экспериментов, направленных на уточнение механизмов взаимодействия наноалмазов с клетками иммунной системы и дальнейшей элиминации наночастиц из организма. Результаты таких исследований в сочетании с ранее полученными нами данными [2,5], могут стать основой для понимания взаимодействия модифицированных наноалмазов с организмом млекопитающих, создания медицинских препаратов и средств адресной доставки лекарственных веществ на основе модифицированных наноалмазов.
Авторы выражают искреннюю признательность и благодарность за помощь в проведении исследования и предоставление стерильных гидрозолей наноалмазов детонационного синтеза заведующему лабораторией нанобиотехнологии и биолюминесценции ИБФ КНЦ СО РАН (г.Красноярск), д.б.н. Бондарю Владимиру Станиславовичу, старшему научному сотруднику лаборатории нанобиотехнологии и биолюминесценции ИБФ КНЦ СО РАН (г.Красноярск) Пузырю Алексею Петровичу.
Рецензенты:
Али-Риза А.Э., д.м.н., профессор кафедры патологической анатомии им. проф. П.Г. Подзолкова с курсом ПО ГБОУ ВПО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России, г.Крсноярск;
Чикун В.И., д.м.н., профессор, заведующий кафедрой судебной медицины ИПО ГБОУ ВПО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России, г.Красноярск.
Библиографическая ссылка
Жуков Е.Л., Медведева Н.Н. РЕАКЦИЯ ВНУТРЕННИХ ОРГАНОВ КРОЛИКОВ НА ВНУТРИВЕННОЕ ВВЕДЕНИЕ НАНОАЛМАЗОВ // Современные проблемы науки и образования. – 2015. – № 6. ;URL: https://science-education.ru/ru/article/view?id=23648 (дата обращения: 24.04.2024).



