Колоректальный рак занимает одно из ведущих мест в структуре онкологической заболеваемости и смертности [1,2,4]. Только в России ежегодно регистрируется до 60000 новых случаев в год. У 30–50 % больных со II и III стадией заболевания после радикальных операций в течение первых пяти лет возникают рецидивы и/или метастазы [1,2,4]. В связи с этим актуальным остается вопрос прогнозирования развития последних. Опухолевую прогрессию определяют несколько механизмов: пролиферативная активность, факторы апоптоза, ангиогенеза. Они отвечают за рост и развитие опухоли, способности к инвазии и метастазированию. Одним из ведущих факторов в ангиогенезе являются матриксные металлопротеиназы (ММП). ММП относятся к семейству цинковых металлопротеиназ, функция которых связана с обменом белков межклеточного матрикса [9]. Им принадлежат функции активации, инактивации и модификации большого количества молекул, которые контролируют процессы инвазии, метастазирования и ангиогенеза [9].
Повышенная экспрессия ММП наблюдается практически во всех злокачественных опухолях и ассоциируется с агрессивным течением заболевания и неблагоприятным прогнозом. ММП с определенной избирательностью гидролизуют все основные компоненты соединительнотканного матрикса (СТМ). Тканевые коллагеназы: ММП-1, ММП-8, ММП-13 – гидролизуют фибриллярные коллагеназы – основу соединительнотканного матрикса, обеспечивая развитие процесса инвазии. Активность ММП в клетке реализуется различными механизмами: транскрипцией, активацией белка и взаимодействием с тканевыми ингибиторами матриксных металлопротеиназ (ТИММП).ММП-2 и ММП-9 – гидролизуют коллаген IV типа – основу базальных мембран, которая обеспечивает отделение эндотелиальных клеток от мембран с последующей их миграцией и участием в процессе ангиогенеза. ММП-2 и ММП-9 высвобождают ряд ангиогенных факторов, связанных с соединительнотканным матриксом [8,9]. Показано, что у больных с аденокарциномой легкого, выявлен значительный уровень экспрессии ММП-2 и ММП-9 опухолевыми клетками, что обусловливает высокую инвазивность опухоли, аналогичные данные получены и при раковых опухолях желудка [4,8].
Степень васкуляризации опухоли является мощным фактором, способствующим приобретению опухолью метастатического потенциала как на ранних, так и на поздних стадиях. При метастазировании гематогенным путем опухолевые клетки должны прикрепиться к эндотелию, выйти в просвет сосуда, выжить в циркулирующей крови, остановиться в какой-либо отдаленной ткани и образовать там клон [5].
Другим, не менее важным, маркером потенциала опухоли является белок р53. Р53 выполняет три основные функции: регуляцию клеточного цикла, индукцию апоптоза (в случаях, когда повреждения ДНК клетки не могут быть репарированы), стабилизацию генома. Нарушение регуляции клеточного цикла, связанное с изменением активности р53, ведет к развитию и прогрессированию злокачественного процесса. Мутации гена p53 ведут к «сверхэкспрессии» этого белка, которые иммуногистохимическим путем выявляются с помощью анти-р53 антител. Считается, что иммуногистохимическая положительная реакция полностью зависит от наличия мутантного типа р53 [6].
Прогнозировать течение опухолевого процесса возможно, с использованием одного из маркеров пролиферативной активности ki-67. Во многих крупных исследованиях по течению опухолей различных локализаций показано, что ki-67 является универсальным фактором прогноза рецедивирования и общей безрецидивной выживаемости [3].
Не менее важным показателем развития опухолевой прогрессии является микрососудистая инвазия опухоли, которую иммуногистохимически можно выявить с помощью антител к CD31. По уровню экспрессии CD 31 производится подсчет плотности микрососудов в опухоли, которая является важным прогностическим признаком [8].
Еще одним из маркеров прогрессирования опухолевого процесса являются циркулирующие в крови опухолевые клетки, увеличение количества которых может стать поводом к более тщательному обследованию пациентов в «досимптомном периоде» [5,8,10]. В проведенных многоцентровых рандомизированных исследованиях показана роль повышения уровня ЦОК в развитии опухолевой прогрессии при раке молочной железы, предстательной железы и колоректальном раке. В ряде стран Запада данный параметр используется для коррекции химиотерапии (отмена, смена линии и т.д.) [11].
Цель исследования: изучить экспрессию некоторых иммуногистохимических маркеров (ki-67, р53, CD31,ММП-2) в зависимости от количества циркулирующих опухолевых клеток у больных с раковыми опухолями толстой кишки.
Материалы и методы исследования: в исследование были включены 40 больных (20 мужчин и 20 женщин) в возрасте от 50 до 72 лет с IIIB стадией колоректального рака. Материалом для исследования служили удаленные опухоли толстого кишечника (после радикальной операции) и венозная кровь из периферической вены (в дооперационном периоде). Изучали количество циркулирующих опухолевых клеток в венозной крови с использованием системы CellSearch™, состоящей из двух приборов: станции пробоподготовки и анализатора. Принцип работы станции основан на подсчёте количества эпителиальных опухолевых клеток, выделяемых из крови. Идентификация клеток осуществляется с помощью флюоресцентно меченых антител к цитокератинам (СК8,СК18,СК19), общелейкоцитарному антигену CD45 и ядерного красителя DAPI. Анализ основан на иммуномагнитном обогащении клеток при помощи металлических наночастиц, покрытых полимерным слоем, содержащим антитела к EpCAM молекулам (маркеры эпителиальных клеток) с дальнейшей иммунофлуоресцентной идентификацией собранных в магнитном поле клеток. Иммуногистохимическое исследование проводили на срезах с парафиновых блоков, предназначенных для стандартного морфологического исследования, с помощью моноклональных антител ki-67, р53, CD31,ММП-2 фирмы Dako. Парафиновые срезы депарафинировали и регидратировали по стандартной методике. «Демаскировку» антигенов проводили в PT-LinkThermo. Протокол включал в себя предварительный нагрев до 65 °C , восстановление антигена в течение 20 минут при температуре 97 °C и дальнейшее охлаждение до 65 °C . Затем стекла промывали в течение 1–3 минут TBS-буфером (Dako) и помещали в автостейнер Thermo Scientific для окрашивания в автоматическом режиме. Для визуализации иммуногистохимической реакции использовали систему детекции RevealPolyvalent HRP-DAB DetectionSystem. Срезы докрашивали гематоксилином Майера, для заключения использовали бальзам Bio-Mount. Оценку экспрессии маркеров изучали как минимум на 10 случайно выбранных полях зрения с применением светового микроскопа ZeissAxioImager M2 под увеличением х10, х40.
В исследовании применяли следующие критерии оценки маркеров:
1) опухоль считали отрицательной по р53, если в ткани опухоли отсутствовала ядерная реакция с антителами или количество окрашенных клеток было менее 25 %, и положительной по р53, если было окрашено более 25 % ядер опухолевых клеток;
2) для оценки пролиферативной активности (ПА) опухоли подсчитывали количество ki-67-положительных опухолевых клеток, приходящихся на 200–300 опухолевых клеток. Индекс ki-67 определяли по формуле:
ПА= число ki-67 положительных клеток х 100/общее количество клеток.
Маркеры пролиферативной активности расценивали на основе наиболее часто употребляющегося способа оценки пролиферативной активности: 0 % – 20 % – низкая пролиферативная активность, 21 % – 50 % – умеренная пролиферативная активность, 51 % –100 % – высокая пролиферативная активность;
3) Для оценки ангиогенеза в опухолях использовали индекс внутриопухолевой микрососудистой плотности (intratumormicrovesseldensity – MVD). Микрососуды окрашивали антителом CD31. Количество сосудов определяли в каждом поле зрения препарата при использовании объектива х40 с использованием программы AxioVs40 v-4.8.1.0.
Статистический анализ результатов исследования проводился с помощью программы STATISTICA 7.0 (StatSoftInc., США) и MedCalc (версия 9.3.5.0).
Результаты исследования и их обсуждение: у исследованных больных был обнаружен повышенный уровень ЦОК>3 клеток (от 3 до 400 клеток в образце) в 75 % случаев. По стандартам, применяемым к исследованию ЦОК, образец считается положительным, при любом количестве ЦОК большем, чем 3 клетки. При этом у большего числа пациентов (42,5 %) с высоким уровнем ЦОК при морфологическом исследовании операционного материала была диагностирована низкодифференцированная аденокарцинома. Соотношение количества ЦОК со степенью дифференцировки опухоли показана в таблице 1.
Таблица 1
Зависимость количества ЦОК в периферической крови от степени дифференцировки опухоли
|
Степень дифференцировки опухоли |
Количество больных (абсолютные числа, %) с ЦОК>3n=30 |
Количество больных (абсолютные числа, %) с ЦОК<3n=10 |
|
Высокодифференцированная аденокарцинома |
5 (12,5 %) |
3 (7,5 %) |
|
Умереннодифференцированная аденокарцинома |
9 (25 %) |
5 (10 %) |
|
Низкодифференцированная аденокарцинома |
16 (42,5 %)* |
2 (2,5 %)* |
Примечание: * – статистически значимое различие выявления у больных с ЦОК > 3 и < 3с низкодифференцированной аденокарциномой, р=0,0235.
Ретроспективный анализ показал, что ранние рецидивы и метастазы (в сроки до 24 месяцев) развивались чаще у больных с уровнем ЦОК > 3 клеток.
У 67,5 % от общего числа больных была выраженная экспрессия ММП-2. Высокая и умеренная пролиферативная активность была отмечена в 100 % случаев. Экспрессии р53 была отмечена в 67,5 % случаев. CD31 экспрессировался в 75 % образцов, что отражает выраженную микрососудистую инвазию (см. рис. 1–4). Полученные данные иммуногистохимического исследования отражены в таблице 2 и сопоставимы с уровнем ЦОК.
Таблица 2
Показатели ЦОК и иммуногистохимических маркеров
|
Экспрессия ИГХ маркеров |
Количество больных (абсолютные числа, %) с ЦОК>3(n=30) |
Количество больных (абсолютные числа, %) с ЦОК<3(n=10) |
|
Положительная экспрессия р53 |
23(76,7%)* |
4(40%)* |
|
Отсутствие экспрессии р53 |
7(23,7%)** |
6(60%)** |
|
умеренная пролиферативная активность (ki-67) |
10(33,3%) |
3(30%) |
|
высокая пролиферативная активность (ki-67) |
20(66,7%) |
7(70%) |
|
Положительная экспрессия CD31 |
28(93,3%)° |
2(20%)° |
|
Отсутствие экспрессии CD31 |
2(6,7%)°° |
8(80%)°° |
|
Положительная экспрессия ММП-2 |
26(86,7%)ʹ |
1(10%)ʹ |
|
Отсутствие экспрессии ММП-2 |
4(13,3%)ʹʹ |
9(90%)ʹʹ |
Примечание: статистически значимые различия при ЦОК <3и > 3 выявлены: * и ** – по экспрессии р53, р=0,0383; ° и °° – по экспрессии CD31, р=0,00001;ʹ и ʹ ʹ – по экспрессии ММП-2, р=0,0001.
Из таблицы 2 видно, что у больных с высоким уровнем ЦОК отмечена положительная экспрессия маркеров апоптоза, а также маркеров, отражающих микрососудистую инвазию и метастатический потенциал опухоли.
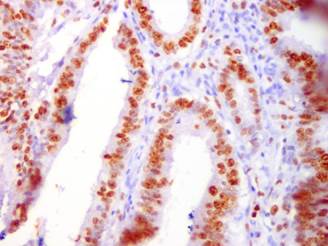
Рис.1. Высокая пролиферативная активность (ki-67) в раковых клетках. ИГХ-исследование
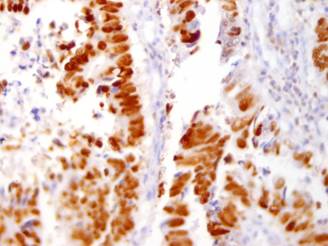
Рис. 2. Содержание р53 в раковых клетках толстой кишки. ИГХ-исследование
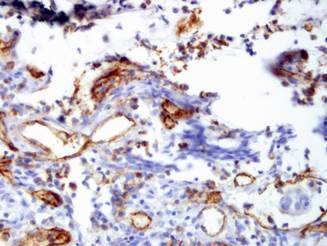
Рис. 3. Экспрессия CD31. Микрососудистая плотность при колоректальном раке.
ИГХ-исследование
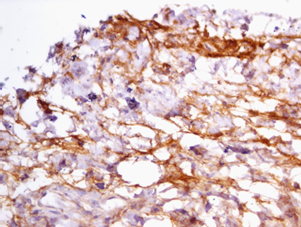
Рис. 4. Положительная реакция ММП-2 в раковых клетках толстой кишки.
ИГХ-исследование
Заключение: проведенное исследование показало, что количество ЦОК находится в прямой зависимости от маркеров апоптоза (р53) (р=0,0383), микрососудистой инвазии (CD31) (р=0,00001), ММП-2 (р=0,0001). Данные морфологические изменения были сопоставимы с клиническими проявлениями в виде возникновения ранних рецидивов и метастазов (у больных с повышенным количеством ЦОК, метастазы и рецидивы возникали в более ранние сроки). Полученные результаты важны для понимания механизмов прогрессии рака толстой кишки и являются прогностическими.
Библиографическая ссылка
Непомнящая Е.М., Кит О.И., Нистратова О.В., Новикова И.А., Никипелова Е.А., Бахтин А.В., Ульянова Е.П., Вострикова Ж.И., Селютина О.Н. ЦИРКУЛИРУЮЩИЕ ОПУХОЛЕВЫЕ КЛЕТКИ И НЕКОТОРЫЕ МОРФО-ИММУНОГИСТОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ ПРИ КОЛОРЕКТАЛЬНОМ РАКЕ // Современные проблемы науки и образования. – 2016. – № 2. ;URL: https://science-education.ru/ru/article/view?id=24378 (дата обращения: 18.04.2024).



