Терапевтический эффект препарата во многом зависит от способности лекарственной формы достигать патологических участков. В последние годы наблюдается рост научных исследований в области таргетной терапии опухолей, разработаны наночастицы, способные выступать в качестве переносчиков лекарственных средств [6]. Ранее нами была показана способность аполипопротеина А-I (апоА-I) образовывать комплексы с такими противоопухолевыми препаратами, как актиномицин Д и винбластин, изучено влияние этих комплексов на биосинтез ДНК в клетках асцитной карциномы Эрлиха [1,2]. В своей работе мы использовали актиномицин Д – препаратиз группы противоопухолевых антибиотиков, продуцируемых актиномицинами Streptomyces parvullus. Его противоопухолевое действие обусловлено интеркаляцией между парами азотистых оснований гуанин-цитозин ДНК и препятствием движению РНК-полимеразы, нарушая, таким образом, транскрипцию антиапоптозных генов [10]. Актиномицин Д представляет собой один из химиотерапевтических препаратов, которые используют в лечении различных видов рака, и является составной частью комбинированной терапии опухолей у детей [12].
Целью настоящей работы явилось изучение влияния апоА-I в комплексе с актиномицином Д на скорость биосинтеза ДНК в культуре клеток асцитной карциномы Эрлиха и гепатоцитов.
Материалы и методы
Выделение аполипопротеина А-I
Белок получали путем делипидирования липопротеиновых фракций высокой плотности (ЛПВП), охлажденной смесью этанол-ацетон (1:1). Осадок белков многократно отмывали охлажденным эфиром и высушивали в токе азота. Смесь белков (20–30 мг), солюбилизировали в растворе (2 мл), содержащем 3 % DS-Na (m/V), 1 мМ меркаптоэтанол и наносили на колонку (1,6 х 100 см, V0 = 55 мл) с Сефарозой 6В-CL («Pharmacia», Швеция). Элюировали 0,01 М трис-НСl буфером (рН 8,6), содержащим мочевину (6 М), азид натрия (0,01%) и фенилметансульфонилфторид (1 мМ).
Скорость потока элюента при хроматографии составляла 10 мл/ч, продолжительность сбора одной фракции – 20 мин, скорость самописца – 0,015 см/мин. Профиль элюции регистрировали на УФ-детекторе при длине волны 280 нм и уровне чувствительности 1,28. Проверку чистоты апоА-I осуществляли методом диск-электрофореза в ПААГ с DS-Na. Для разделения смеси белков использовали 3 % концентрирующий и 12,5 % разделяющий гель (V/V), содержащие 0,1 % DS-Na. Объем пробы составлял 10–20 мкл. Электрофорез проводили в трис-глициновом буфере (рН 8,3), содержащем 0,1 % DS-Na, при комнатной температуре в течение 3 ч при силе тока 10–20 мА на см2 [5]. Белковые полосы визуализировали 0,1 % Кумасси G-250 в смеси метанола и 10 % уксусной кислоты (1:1, V/V). В качестве маркеров использовали набор белков-стандартов («Page Ruler Prestained Protein Ladder» 10-170 кДа «Thermo Scientific», США).
Обессоливание апоА-I проводили методом гель-фильтрации. Раствор белка в мочевине (1,5–2 мл) наносили на колонку (0,8 х 20 см, V0 = 6 мл) с Сефадексом G-25 («Pharmacia», Швеция), и элюировали 0,05 М калий-фосфатным буфером, рН 7,4, содержащим 0,15 М NaCl. Скорость потока – 1 мл/мин, скорость самописца – 0,15 см/мин.
Профиль элюции регистрировали на УФ-детекторе при длине волны 280 нм. Концентрация обессоленного белка составляла 0,2 мг/мл [4].
Оценка скорости биосинтеза ДНК в культуре клеток
Определение скорости биосинтеза ДНК оценивали по включению 3Н-тимидина. Для этого за 2 ч до окончания эксперимента в клеточную культуру добавляли 2мкКи/мл 3Н-тимидина («Amersham», Англия). После окончания культивирования клетки лизировали 0,2н раствором NaOH. Для измерения радиоактивности содержимое лунки (100 мкл) переносили на целлюлозные фильтры («Whatman 3 MM», Англия), предварительно обработанные 10 % трихлоруксусной кислотой (ТХУ). Далее последовательно отмывали от несвязавшейся метки холодным раствором 10 % трихлоруксусной кислоты, затем в горячем 5 % ТХУ и смесью этанол-эфир (1:1). Радиоактивность образцов измеряли на жидкостном сцинтилляционном счетчике «Дельта-300» (TM Analytic, Нидерланды) и выражали в имп/мин на 1 мг белка [8]. В работе использовали 1 мМ исходный маточный раствор актиномицина Д («Applichem», Германия).
Выделение клеток асцитной карциномы Эрлиха
Для эксперимента использовали мышей-самцов линии Black, массой 20–25 г. Клетки асцитной карциномы получали из перитонеального экссудатана 10 день после перевивания. Асцитную жидкость вносили в центрифужные пробирки и центрифугировали в течение 10 мин при 150g для осаждения клеточных элементов. Осадок клеток трижды промывали холодным раствором Рингера – Кребса.
Изолирование и фракционирование клеток печени
Процедура получения гепатоцитов включала четыре основных этапа: (1) перфузия печени in situ раствором Хэнкса без Са++; (2) рециркуляционная перфузия печени in vitro раствором коллагеназы; (3) механическая дезагрегация ткани; (4) дифференциальное центрифугирование при 50g для получения осадка очищенных гепатоцитов [11]. Подсчет клеток проводили в камере Горяева. Жизнеспособность клеток оценивали по исключению трипанового синего [3].
Свежевыделенные клетки ресуспендировали в среде RPMI-1640 («Биолот», Россия), рН 7,4, содержащей 20 мM HEPES («ICN Biomedicals, Inc», США), 2 мM L-глутамина («Вектор», Россия), 100 ЕД/мл пенициллина, 50 мкг/мл гентамицина, 5,6 мM глюкозы. Планшеты предварительно покрывали раствором коллагена (0,1 мг/мл) в 0,1 % уксусной кислоте. После сорбции коллагена планшеты отмывали 0,9 % раствором NaCl и подсушивали. Инкубацию клеток (плотность 800 клеток/мм2) проводили в СО2-инкубаторе («Cole-Parmer», США) при температуре 37 °С, влажности 85 % в атмосфере, содержащей СО2 (5 %) и воздуха (95 %) [7]. Среду заменяли через 2 ч после посева клеток и образования монослоя.
Определение связывающей способности аполипопротеина А-I с противоопухолевым препаратом методом тушения триптофановой флуоресценции
Комплекс апоА-I с актиномицином Д получали, выдерживая их смесь в 0,05 М калий-фосфатном буфере, рН 7,4, содержащим 0,15 М NaCl, в течение 15 мин при комнатной температуре. Образование комплексов апоА-I с актиномицином Д подтверждали методом тушения триптофоновой флуоресценции. Для этого проводили титрование в термостатируемой кювете при температуре 20 ºС с добавлением аликвотцитостатика (по 1мкл) к 2 мл апоА-I в ФСБ (рН 7,4). Снижение флуоресценции составило 73 %. Данное снижение можно расценивать как результат образования комплекса аполипопротеин А-I–актиномицин Д [1]. Комплекс апоА-I–актиномицин Д добавляли к культуре клеток и инкубировали в течение 5 ч. Актиномицин Д применяли в двух концентрациях: 0,1 и 1 мкг/мл [10]. В качестве контроля выступали клетки, которым в среду инкубации добавляли физиологический раствор.
Статистическую обработку данных проводили при помощи программы StatPlus 2009 Professional5.8.4. (США). Статистическую значимость полученных результатов оценивали с помощью t-критерия Стьюдента при уровне значимости p<0,05.
Результаты исследования
На культуре клеток асцитной карциномы Эрлиха показано, что сам апоА-I не изменял скорость биосинтеза ДНК в клетках (рис. 1). Однако присутствие в среде инкубации одного актиномицина Д, а также в составе комплекса апоА-I-актиномицин Д (концентрация актиномицина Д1мкг/мл среды) резко снижает скорость биосинтеза ДНК в клетках (рис.1). Следует отметить, что различия в этих двух группах между собой были незначительны.
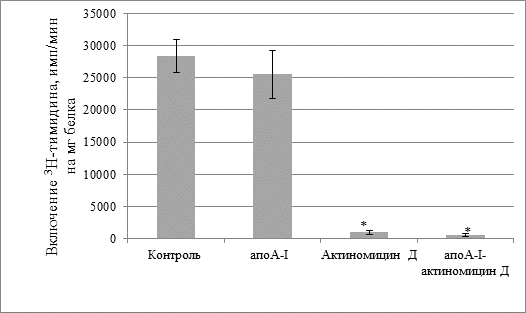
Рис.1. Скорость биосинтеза ДНК в клетках асцитной карциномы Эрлиха. Концентрация актиномицина Д 1 мкг/мл
* – достоверное различие по сравнению с контролем (р < 0,001).
Мы уменьшили концентрацию цитостатика в 10 раз, т.о. она составила 0,1 мкг/мл среды. Оказалось, что в этой концентрации один актиномицин Д (0,1 мкг/мл) не оказывал цитотоксического эффекта – скорость включения 3Н-тимидина в ДНК практически не изменялась (рис. 2). Не влиял на включение метки в ДНК и апоА-I без цитостатика. Однако актиномицин Д в составе комплекса сапоА-I снижал биосинтез ДНК в клетках на 60 % по сравнению с контрольными величинами.
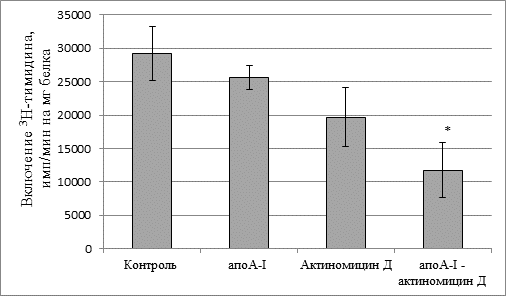
Рис. 2. Скорость биосинтеза ДНК в клетках асцитной карциномы Эрлиха. Концентрация актиномицина Д 0,1 мкг/мл
* – достоверное различие по сравнению с контролем (р < 0,04).
Следует задать вопрос: а как влияет в этой концентрации цитостатик (0,1 мкг/мл) на здоровые клетки? На культуре гепатоцитов здоровых крыс мы показали, что ни один из этих компонентов, в том числе и актиномицин Д в концентрации 0,1 мкг/мл, не оказывал статистически значимого влияния на скорость включения меченого тимидина в ДНК (рис. 3).
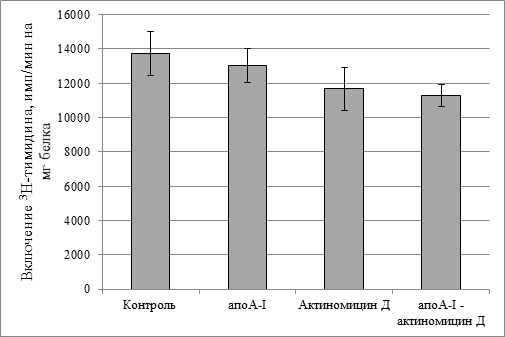
Рис. 3. Скорость биосинтеза ДНК в гепатоцитах.
Концентрация актиномицина Д 0,1 мкг/мл
Выводы
Проведенные исследования свидетельствуют о том, что комплекс апоА-I с актиномицином Д обладает выраженным цитостатическим действием даже в минимальных концентрациях по сравнению с отдельно взятым противоопухолевым препаратом. Это можно объяснить наличием на мембране опухолевых клеток большого количества специфических рецепторов к апоА-I [9], что, по-видимому, позволяет препарату эффективнее попадать внутрь клетки и проявлять противоопухолевую активность.
Библиографическая ссылка
Трифонова Н.В., Князев Р.А., Поляков Л.М. ВЛИЯНИЕ КОМПЛЕКСА АПОЛИПОПРОТЕИНА А-I С АКТИНОМИЦИНОМ Д НА БИОСИНТЕЗ ДНК В НОРМАЛЬНЫХ И ОПУХОЛЕВЫХ КЛЕТКАХ // Современные проблемы науки и образования. – 2016. – № 6. ;URL: https://science-education.ru/ru/article/view?id=25713 (дата обращения: 20.04.2024).



