В настоящее время рак молочной железы (РМЖ) занимает первые ранговые места как в онкологической заболеваемости среди женщин, так и в онкологической смертности [4]. Отёчный рак молочной железы (ОРМЖ) выделяется в особую клинико-морфологическую форму и, по данным разных авторов, встречается у 1-6% больных РМЖ. Данная форма заболевания известна своим неблагоприятным прогнозом: общая 5-летняя выживаемость вследствие агрессивности ОРМЖ не превышает 12-50%.
В соответствии с международной классификацией злокачественных опухолей TNM (7-е издание, 2010 г.) первичному ОРМЖ присваивается код T4d, вторичному - T4b. Пришедший из англоязычной литературы термин «воспалительная форма РМЖ - inflammatory breast cancer (IBC)» более употребим в отношении первичного отечного РМЖ. В доступной литературе не рассматриваются целенаправленно отличия и параллели между отечным и отечно-инфильтративным раком молочной железы (ОИРМЖ), что вносит определенные трудности не только в формулировку диагноза, но и в лечебно-диагностическую тактику. Изучение литературных источников показало в целом идентичность и соответствие в описании ОИРМЖ и ОРМЖ [9; 10]. Вторичная форма отёчного рака молочной железы встречается примерно у 25% пациенток. Клинически вторичная форма ОРМЖ представляет собой местнораспространенный узловой рак молочной железы, сопровождающийся лимфогенным метастазированием и развивающимся вследствие этого блоком оттока лимфы и отеком молочной железы [10].
Для отечного РМЖ характерны признаки агрессивного поведения: на момент постановки диагноза у 95% пациенток регистрируется поражение регионарных лимфоузлов над- и подключичной, аксиллярной групп; стремительное прогрессирование болезни у большинства больных, неизбежно заканчивающееся смертью пациенток [5; 9]. Подходы к лечению ОРМЖ значительно изменились за последние десятилетия. Продолжительность жизни больных в случае использования только оперативного лечения составляет от 12 до 32 месяцев [9]. Комбинация хирургического и радиотерапевтического методов позволяет значительно улучшить местный контроль, но не влияло на появление отдаленных метастазов; не было выявлено и изменения выживаемости больных. Целью введения в практику системной химиотерапии явилась девитализация определяемых и возможных скрытых метастазов в различных органах, а также местная ликвидация первичного опухолевого процесса [2].
При ОРМЖ особой задачей химиотерапии, как этапа комплексного лечения, является резорбция опухоли и расширение возможности последующего хирургического, лучевого и лекарственного воздействия [6; 8]. Поэтому определенный интерес вызывает изучение возможности сочетания регионарной внутриартериальной полихимиотерапии с облучением, для получения синергизма эффектов этих воздействий. Преимущество направленной внутриартериальной доставки цитостатических препаратов заключается в создании повышенной концентрации в зоне поражения, а также радиомодификации. По данным ряда авторов, направленная доставка цитостатиков обеспечивает повышение их локальной концентрации более чем в 10 раз по сравнению с системной химиотерапией [3; 9]. Чем больше концентрация препарата, тем скорее можно ожидать уменьшения массы и объема новообразования и регионарных метастазов, перевода нерезектабельной опухоли в резектабельную [11; 12]. Сочетание системной химиотерапии с внутриартериальным введением ХТ предполагает не только улучшение локального контроля с переводом опухоли в операбельное состояние, но и улучшение отдаленных результатов лечения (общей и безрецидивной выживаемости) [3; 5]. Однако результаты лечения данной категории пациенток до сих пор остаются неудовлетворительными. В связи с этим возникла необходимость в комбинации существующих методов – сочетанного применения химиолучевой терапии с использованием селективной внутриартериальной полихимиотерапии в режиме химиоэмболизации или химиоинфузии внутренней и (или) наружной грудных артерий, с последующей радикальной лучевой терапией. Наряду с взаимным усилением действия, приводящим к повышению эффективности, сочетание данных методов может привести к развитию серьезных нежелательных явлений, что существенно может сказаться на качестве жизни больных. Исследование в данном направлении является актуальным и позволит проанализировать безопасность новой методики комбинированного лечения РМЖ, определить частоту и степень возникающих осложнений [1].
Цель исследования: оценка частоты лучевых реакций и осложнений, определение переносимости и безопасности комбинированного химиолучевого лечения больных ОРМЖ с использованием селективной внутриартериальной полихимиотерапии в режиме химиоэмболизации или химиоинфузии внутренней и (или) наружной грудных артерий, с последующей радикальной лучевой терапией.
Материалы и методы. В 2000-2014 гг. комбинированное лечение местнораспространенного РМЖ T4b получили 77 первично неоперабельных пациенток. Средний возраст в группе составил 48,3 года (от 31 до 68 лет). У 70 женщин оцениваемой группы была диагностирована IIIВ стадия, опухолевый рост сопровождался наличием вторичного отека молочной железы, эритемой, изменениями кожи по типу «лимонной корки»; отдаленные метастазы выявлены у 7 пациенток. Способ лечения инфильтративно-отечного рака молочной железы разработан и впервые применен в ЦНИРРИ МЗ РФ в 2001 г. (патент на изобретение № 2177349, МПК A61N 5/00, Корытова Л.И. и соавт., 2001). Первым этапом лечения выполнялась внутриартериальная регионарная химиотерапия (РХТ) по схеме CMF или АТ. Проводили масляную химиоэмболизацию (ХЭ) (n=50) или химиоинфузию (n=27) внутренней и/или наружной грудных артерий с использованием 50 мг метотрексата, 1000 мг 5-фторурацила, смешанных с 2-5 мл липиодола (n=39), в другой группе 80-100 мг таксотера и 2-5 мл липиодола (n=38). С учетом площади поверхности тела пациентки вводились остальные дозы химиотерапевтических препаратов.
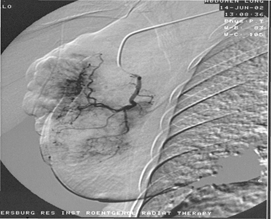
Методика внутрисосудистой (рентгеноэндоваскулярной) ХТ заключалась в пунктировании бедренной, подмышечной или плечевой артерии со стороны, соответствующей пораженной молочной железе. Катетер 4-5F (IF=0,33) устанавливали в подключичной артерии и выполняли ангиографию. Особенности кровоснабжения молочной железы и опухолевого узла оценивали на экране монитора и снимках (рис. 1). Тем же катетером или микрокатетером 2,5 F выполнялась селективная катетеризация сосуда/сосудов, наиболее заинтересованных в кровоснабжении опухоли или МЖ (катетеризировалась внутренняя и/или наружная грудная артерия).
 a
a 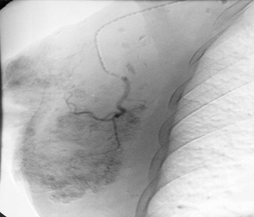 b
b
Рис. 1. Ангиограмма левой медиальной грудной артерии: a - выраженная неоваскуляризация опухолевого узла; b - отсроченное накопление масляного эмболизата в опухоли, окклюзия питающих артерий
Далее выполнялась селективная ангиография внутренней и наружной грудной артерий, посредством того же катетера осуществляли инфузию 2-3 мл раствора Methylenum coeruleum. Перекрашивание кожи грудной стенки и молочной железы (обычно в интервале 1-3 минут) позволяло высказать предположение об особенностях кровоснабжения опухолевого узла и прилежащих к нему тканей из бассейна внутренней или наружной грудной артерий (рис. 2).
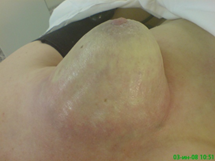
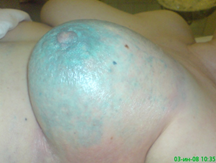
Рис. 2. Введение раствора Methylenum coeruleum выявило, что кровоснабжение опухоли осуществляется из левой внутренней и наружных грудных артерий
Катетер (или микрокатетер) устанавливали в выбранном сосуде и, в зависимости от задач, проводили селективную эмболизацию или химиоинфузию. После ХЭ или ХИ начинали лучевую терапию (ЛТ). Облучение проводили 5 р/нед., в режиме среднего фракционирования дозы (3 Гр) до суммарной дозы (СОД) на основание МЖ 48 Гр, что соответствовало СОДэкв 60 Гр в пересчете на стандартное фракционирование 2 Гр, на зоны регионарного лимфооттока 36-39 Гр фигурным полем – СОДэкв 46-48 Гр.
Всем больным в оцениваемой группе непосредственно перед введением специфических противоопухолевых препаратов, учитывая высокую эметогенность применяемой схемы комбинированной химиотерапии, вводили противорвотные препараты – антагонисты 5-НТ3 рецепторов, в ряде случаев назначение противоопухолевых препаратов сочетали с внутривенным введением дексаметазона с целью потенцирования эффекта противорвотных препаратов. Во 2-3 дни после проведенного курса химиотерапии назначались антагонисты 5-НТ3 рецепторов с целью профилактики отсроченных тошноты и рвоты. В качестве антиэметиков применялись следующие препараты:
ондансетрон (зофран, латран) в дозе 4-8 мг/сут., гранисетрон (китрил) в дозе 3-6 мг/сут., по показаниям дозы антиэметиков увеличивали. Больным, получавшим ХТ по схеме АТ проводилась поддержка КСФ (филграстим 5 мкг/кг п/к во 2-3 дни).
С целью регистрации возможных непосредственных и отсроченных осложнений перед каждым курсом и далее 1 раз в 2 недели определяли уровни общего билирубина, креатинина сыворотки, уровня аминотрансфераз, щелочной фосфатазы, клинический анализ крови, ЭКГ. Степень гематологической токсичности определялась согласно критериям ВОЗ по шкале Common Toxicity Criteria NCIC. Для профилактики осложнений больным проводилась соответствующая медикаментозная терапия.
Ранние постлучевые изменения оценивали на основании классификации Радиотерапевтической онкологической группы совместно с Европейской организацией по исследованию и лечению рака (RTOG/EORC, 1995), дополненной критериями Кооперативной группы исследователей для более полного описания ранних лучевых реакций. Все эти повреждения стадировались по шкале от 0 до 5 в соответствии с выраженностью их проявлений, значению «0» соответствовало отсутствие изменений, а «5» - смерть пациента в результате лучевого повреждения. Интенсивность боли оценивалась по визуально-аналоговой шкале (ВАШ).
Результаты
Все больные оцениваемой группы завершили запланированное лечение в соответствии с планом лечения. Кожные лучевые реакции на фоне проводимой лучевой терапии были выражены умеренно (1-2 степени), для их купирования применялись салфетки колетекс-димексид, колегель с инкорпорированными лекарственными препаратами с деринатом и лидокаином, а также Колетекс-СМЧ с мочевиной на текстильной основе. Необходимо упомянуть о том, что применение салфеток Колетекс для профилактики начиналось с 1-го дня и завершалось спустя 1 месяц после заключительного сеанса лучевой терапии. Ранние кожные реакции 3 степени были зарегистрированы у 5 пациенток, в общей группе составили 6,5%. У 4 из 5 пациенток это было связано с наличием в анамнезе сахарного диабета 2 типа, а у 1 пациентки с погрешностями при использовании профилактических средств (табл. 1, рис. 3).
Таблица 1
Ранние лучевые реакции со стороны кожи
|
Степень |
Пациенты группы CMF (n=39) |
Пациенты группы АТ (n=38) |
|
0. Нет изменений по сравнению с исходным состоянием |
0 |
0 |
|
1. Очаговая слабо выраженная эритема, эпиляция, сухое шелушение, снижение потоотделения |
39 (100%) |
38 (100%) |
|
2. Болезненная или яркая эритема, очаговый влажный эпидермит, умеренный отек |
25 (64,1 %) |
27 (71 %) |
|
3. Сливной влажный эпидермит вне кожных складок, отек с вдавлением |
2 (5,1 %) |
3 (7,8 %) |
|
4. Некроз |
0 |
0 |
a 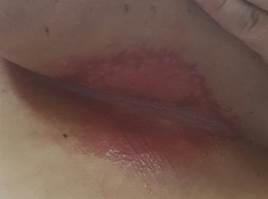 b
b 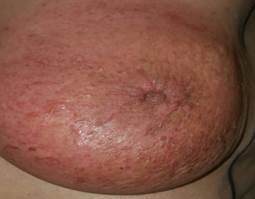
c 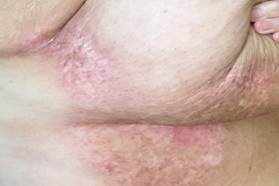 d
d 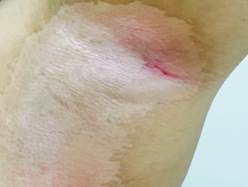
Рис. 3. Кожные лучевые реакции (a, b - ранние лучевые реакции, лучевой эпителит 2 ст.; c, d - разрешение эпителита 2 ст., через 2 месяца после окончания терапии)
Слабо или умеренно выраженные (1-2 степени) поздние изменения тканей ложа молочной железы обнаруживались, как правило, у каждой больной. При этом более чем в 90% случаев выявлялись мягкотканые фиброзы. В случае отказа пациенток от операции отмечали поздний лучевой фиброз 1-2 степени, с умеренной деформацией МЖ.
Гематологическая токсичность 1-2 ст. встречалась у 20% в группе CMF и у 36% в группе АТ. В 10-13% случаев выявлена нейтропения 3-4 степени, которая встречалась чаще в группе, получавшей химиотерапию по схеме АТ (табл. 2). Негематологические осложнения чаще всего проявлялись диспепсией, которая регистрировалась в 40-42% случаев, другие виды негематологической токсичности встречались редко (табл. 3).
Таблица 2
Частота гематологических осложнений у пациенток после ХЛТ
|
Вид токсичности |
Пациенты группы CMF (n=39) |
Пациенты группы АТ (n=38) |
|
Нейтропения 1-2 ст. |
8 (20,5%) |
14 (36,8%) |
|
Нейтропения 3-4 ст. |
4 (10,3 %) |
5 (13,1%) |
|
Фебрильная нейтропения |
1 (2,6%) |
3 (7,9%) |
|
Анемия 1-2 ст. |
4 (10,3 %) |
10 (26,3%) |
|
Тромбоцитопения 1 ст. |
1 (2,6 %) |
2 (5,2%) |
Таблица 3
Частота негематологических осложнений у пациенток после ХЛТ
|
Вид токсичности |
Пациенты группы CMF (n=39) |
Пациенты группы АТ (n=38) |
|
Тошнота |
16 (41,0 %) |
18 (47,4%) |
|
Рвота |
2 (5,1 %) |
5 (13,2%) |
|
Диарея 1-2 ст. |
3 (7,7 %) |
4 (10,5%) |
|
Стоматит 3-4 ст. |
4 (10,3 %) |
5 (13,1%) |
|
Гепатопатия (повышение уровня транстаминаз, билирубина) 1-2 ст. |
1 (2,6%) |
2 (5,2%) |
Клинические симптомы острого пульмонита встречались крайне редко и составили 3,9% от всей группы пациентов. У данной категории больных пульмонит проявился через 2-3 недели после завершения лучевой терапии такими симптомами, как сухой кашель, одышка, субфебрилитет, которые купировали приемом кортикостероидов, антибиотиков, бронхолитиков. Поздние лучевые осложнения в виде пневмофиброза в той или иной степени были зарегистрированы у всех пациенток. Чаще всего эта зона локализовалась в S3 ипсилатерального легкого (табл. 4, рис. 4).
Таблица 4
Частота пульмонитов у пациенток после ХЛТ
|
Степень |
Пациенты группы CMF (n=39) |
Пациенты группы АТ (n=38) |
|
Без патологии |
0 |
0 |
|
Есть рентгенологические изменения |
39 (100%) |
38 (100%) |
|
Клинические симптомы |
1 (2,6%) |
3 (7,9%) |
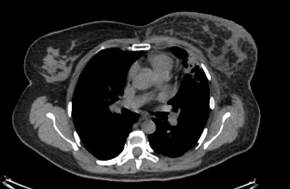
Рис. 4. Проявления лучевого пневмофиброза через год после завершения лечения
В ходе исследования было установлено, что при реализации ЛТ в режиме среднего фракционирования у больных РМЖ симптомы лучевого эзофагита (ЛЭ) проявлялись при достижении СОД 18-24 Гр и усиливались к 13 сеансу ЛТ (СОД 39 Гр). Однако тяжесть ЛЭ не превышала 2 степени. Клинические проявления купировались через 5-7 дней после окончания ЛТ. ЛЭ достоверно чаще встречаются при левосторонней локализации опухоли, что связано с анатомическими особенностями расположения пищевода (табл. 5, рис. 5).
Таблица 5
Частота эзофагитов у пациентов после ХЛТ
|
Степень |
Пациенты группы CMF (n=39) |
Пациенты группы АТ (n=38) |
|
I |
5 (12,8%) |
8 (21,0%) |
|
II |
6 (15,3%) |
10 (26,3%) |
|
III |
0 |
0 |
|
IV |
0 |
0 |
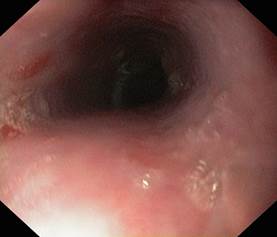
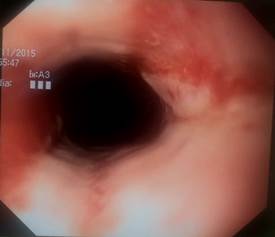
Рис. 5. Эндоскопическая картина лучевого эзофагита. Визуализируются множественные эрозии преимущественно геморрагического характера в верхней трети пищевода
Обсуждение. Химиотерапия оказывает повреждающее действие на опухолевые и нормальные клетки костного мозга, лимфоидной ткани, слизистой оболочки желудочно-кишечного тракта. Клинически действие цитостатиков проявляется, прежде всего, в виде лейкопении, затем (через несколько дней) – тромбоцитопении и в последующем – анемии. Результат действия цитостатиков на органы и системы проявляется в виде патологических синдромов, таких как миелодепрессия, диспептические расстройства, подавления реакции гуморального и клеточного иммунитета, функции репродуктивных органов, алопеции, токсического повреждения печени, почек, сердечно-сосудистой системы. Диспептический синдром, который возникает в ближайшие сроки после введения некоторых препаратов, конкурирует по частоте с побочным действием цитостатиков на гемопоэз. Риск осложнений лучевой терапии связан с объемом и особенностями радиочувствительности нормальных тканей, находящихся в поле облучения, а также с числом фракций и/или величиной разовых и суммарных доз лучевой терапии [7]. Наиболее часто при лечении РМЖ возникают лучевые реакции кожных покровов, т.к. предписанные и экспонируемые дозы облучения находятся на пределе толерантности здоровых тканей и зачастую превышают очаговую. Время появления кожных лучевых реакций и их тяжесть зависят от индивидуальных особенностей организма, наличия сопутствующих заболеваний, сочетанного химиолучевого лечения. Чаще всего эритема кожных покровов регистрируется к концу 3 - началу 4 недели облучения в режиме обычного фракционирования. Близость критических структур, наряду с необходимостью подведения значительных очаговых доз к большим объемам тканей, в случае местнораспространенных опухолей делают проблему возможных реакций и осложнений в здоровых тканях при лечении РМЖ чрезвычайно актуальной. Повреждение легких при ЛТ больных РМЖ возникают, по данным разных авторов, в 11-100% случаев [13; 14]. Однако угрозу для здоровья представляет не сам факт возникновения осложнений, а их не всегда осознаваемые последствия. Лучевые реакции и осложнения на слизистой оболочке пищевода были и остаются актуальной проблемой с момента начала широкой клинической эксплуатации мегавольтных линейных ускорителей электронов. Первые упоминания в литературе относятся к середине 50-х годов XX столетия [15]. Есть устоявшееся мнение, что симптоматический лучевой эзофагит (ЛЭ) наблюдается относительно редко, и менее чем у 1% пациентов, получающих ЛТ, требует эндоскопической и гистологической верификации. Клинические проявления ЛЭ развиваются остро, как правило, в течение первых двух месяцев. При этом ЛЭ – процесс, протекающий доброкачественно и самостоятельно разрешающийся по окончании ЛТ.
Полученные нами данные свидетельствуют о том, что частота лучевых реакций со стороны кожи, гематологических, негематологических осложнений, пульмонитов, эзофагитов при проведении комбинированного лечения с использованием регионарной химиотерапии, последующей лучевой и химиотерапии не превышала частоту осложнений стандартного химиолучевого лечения, упоминающихся в литературе. Острых лучевых повреждений миокарда и перикарда не отмечено. Тяжелых осложнений или угрожающих жизни состояний не отмечалось. Подводя итоги анализа побочных эффектов, следует отметить, что оцениваемая методика обладает приемлемым профилем токсичности.
Выводы
1. Внутриартериальная химиоэмболизация или химиоинфузия в сочетании с лучевой терапией может успешно использоваться как элемент комплексного лечения и является безопасным методом лечения.
2. Предложенная методика обладает приемлемым профилем токсичности.
3. Осложнения данной методики лечения являются типичными для системной ПХТ, радикальной ЛТ и не превышают их по количественным показателям.
4. Разработка мер профилактики позволит не допустить развития серьезных осложнений и положительным образом повлияет на качество жизни пациентов.
Библиографическая ссылка
Маслюкова Е.А., Корытова Л.И., Одинцова С.В., Сергеев В.И., Бондаренко А.В. ОСЛОЖНЕНИЯ СОЧЕТАННОЙ ХИМИОЛУЧЕВОЙ ТЕРАПИИ ОТЕЧНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ // Современные проблемы науки и образования. – 2017. – № 5. ;URL: https://science-education.ru/ru/article/view?id=26888 (дата обращения: 19.04.2024).



