Колоректальный рак (КРР) является одним из наиболее распространенных злокачественных новообразований в мире - ежегодно регистрируется около 1 миллиона новых случаев заболевания и около 715 тысяч летальных исходов. За последнее десятилетие отмечено увеличение заболеваемости КРР у жителей экономически развитых стран, в том числе и России, где это заболевание занимает одну из ведущих позиций, и в настоящее время по числу диагностированных случаев и числу умерших пациентов уступает лишь раку легкого, желудка и молочной железы [1; 2].
Совершенствование хирургических методов и процедур облучения в интеграции с химиотерапией являются основными направлениями в успешном лечении колоректального рака [3]. Лучевая терапия позволяет уменьшить частоту местных рецидивов, однако в значительном числе случаев не удается добиться улучшения показателей отдаленных результатов лечения [4].
В соответствии с российскими и международными стандартами одним из основных методов лучевого воздействия при опухолевом поражении кишечника является неоадъювантная лучевая терапия. Это связано с тем, что опухолевые клетки до операции более оксигенированы и, соответственно, более чувствительны к воздействию ионизирующего излучения. В результате предоперационного облучения происходит девитализация опухолевых клеток и снижение вероятности диссеминации жизнеспособных клеток во время операции [5]. Неоадъювантная лучевая терапия позволяет снизить в 2 раза 5-летнюю частоту рецидивов при раке прямой кишки [6].
Один из вариантов предоперационного лечения - это короткий курс лучевой терапии, который проводится на первичную опухоль и зону регионарного метастазирования за 5 фракций с разовой очаговой дозой (РОД) 5 Гр до СОД (суммарной очаговой дозы) 25 Гр, что изоэффективно 40 Гр [7]. Хотя в настоящее время многие клинические испытания показали, что неоадъювантная лучевая/химиолучевая терапия местнораспространенного рака кишки является стандартом, некоторые вопросы нуждаются в дальнейшем исследовании, в частности: может ли эффект лечения быть повышен за счет увеличения дозы излучения? Чтобы ответить на этот вопрос, необходимы дальнейшие клинические исследования.
Большое влияние на эффективность лучевой терапии оказывает исходная радиорезистентность опухолевых клеток, варьирующая среди опухолей различного происхождения и зависящая от индивидуальных особенностей пациентов [8]. Поэтому разработка методов избирательного повышения радиочувствительности опухоли остается одной из основных задач радиологии. Для её решения необходимы модельные эксперименты на соответствующих клеточных культурах, первым этапом которых является оценка влияния лучевой терапии на выживаемость опухолевых клеток.
Целью данной работы стало определение влияния стандартных доз лучевой терапии 5 и 7 Гр на протяжении 5 дней (изоэффективная доза 37,5 Гр и 49,6 Гр соответственно) на выживаемость клеток аденокарциномы толстой кишки линии HT-29.
Материалы и методы исследования. В исследовании использовалась культура клеток человека – аденокарцинома толстой кишки HT-29. Генотипирование клеток проводилось с использованием набора COrDIS Sprint («Гордиз», Россия), проверялось соответствие стандартному генотипу данной клеточной линии (сравнение с базой данных ATCC [9]) и отсутствие контаминации [10]. Манипуляции с клеточной линией проводились в ламинарном шкафу II степени биологической защиты. Культивирование проводилось в стерильных плоскодонных флаконах (S=25 см2) (Sarstedt, Германия) в среде RPMI-1640 c 10% фетальной телячьей сывороткой и концентрацией гентамицина 50 мкг/мл в условиях 5% CO2 и 95% влажности при 37 °C в инкубаторе CB 150 (Binder, Германия) [10].
Для модельного эксперимента использовались следующие варианты фракционирования: РОД=5 и РОД =7 Гр (облучение проводили 5 раз через каждые 24 часа, что связано с техническими особенностями исследования). Итоговая изоэффективная СОД для первого варианта составила 37,5 Гр, для второго варианта - 49,6 Гр. Облучение проводилось на линейном ускорителе Novalis TX (Varian, США) с использованием томографа Somatom Definition AS Siemens (этап топометрии) и программного обеспечения Eclips (этап сегментирования) [10].
Замену питательной среды и подсчёт количества мертвых клеток (в заменяемой среде) проводили каждый день через один час после облучения во всех флаконах (3 контрольных флаконах, и 6 флаконах для дозы 5 Гр и 7 Гр соответственно). Ежедневно проводили микроскопирование монослойной культуры с помощью инвертированного микроскопа DM IL LED Fluo (Leica, Германия). Оценку общего количества клеток и соотношения живых и мертвых клеток проводили в камере Горяева (использовали 0,4% раствор трипанового синего). На пятый день облучения, после микроскопирования, клеточную линию снимали с подложки флакона путем трипсинизации раствором Трипсин/Версена.
Далее на проточном цитофлюориметре FacsCantoII (BD, USA) с использованием Annexin V-FITC Apoptosis Detection Kit определяли количество клеток, находящихся на различных стадиях апоптоза [10]. Аннексиновый тест (Annexin V-FITC) используется для определения процентной доли клеток, находящихся в апоптозе. Принцип метода основан на свойстве клеток терять асимметричность мембраны на ранних стадиях апоптоза. При этом мембранный фосфолипид фосфатидилсерин (PS) переносится с внутренней стороны плазматической мембраны на ее внешнюю сторону, где с ним связывается Annexin V (Са2+-зависимый фосфолипид-связывающий протеин). Также использовался и пропидиум йодид (PI, стандартный витальный краситель), способный проникать через мембрану погибших и поврежденных клеток. Таким образом, апоптотическими считали клетки, позитивные (+) по Annexin V и негативные по PI (-), мертвыми (подверглись некрозу, поздняя стадия апоптоза) - клетки, позитивные (+) по Annexin V и PI, живыми - клетки, негативные (-) по Annexin V и PI - [10].
Статистический анализ выполняли в прикладном пакете программ Statistica 10.0, для оценки различий использовали параметрический t-критерий Стьюдента для порогового уровня статистической значимости р<0,05.
Результаты исследования и их обсуждение
Пятидневный модельный эксперимент по облучению опухолевых клеток толстой кишки позволил получить данные о влиянии различных доз короткого курса лучевой терапии на их жизнеспособность.
Уже в первый день облучения было обнаружено статистически значимое увеличение количества мертвых клеток в питательной среде: в 6,5 раз (р<0,05) при РОД 5 Гр и в 7,5 раз при РОД 7 Гр. На второй день облучения относительно контроля статистически значимо (р<0,05) в 2,8 раза увеличилось количество мертвых клеток при РОД 5 и 7 Гр, на третий день - в 7 и 9 раз при РОД 5 Гр и 7 Гр соответственно, на четвёртый день - в 6 и 13 раз при РОД 5 Гр и 7 Гр соответственно (рисунок 1). При этом количество мертвых клеток в питательной среде в контрольных флаконах статистически значимо не изменялось на протяжении всего эксперимента. Следует отметить, что на третий и четвертый день облучения наблюдалось снижение количества мертвых клеток на 46 и 54% соответственно при РОД=5 Гр относительно первого дня эксперимента. Это позволяет предположить, что РОД в 5 Гр обладает наибольшим эффектом при первичном облучении, а далее эффективность несколько снижается. При РОД=7 Гр подобного статистически значимого эффекта не наблюдалось.
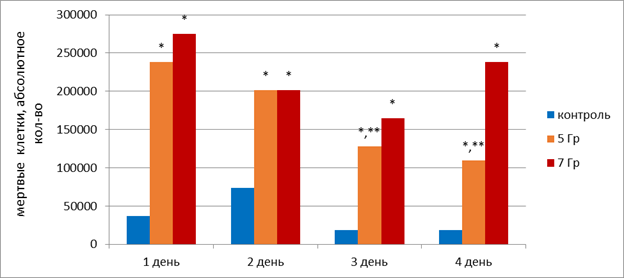
Рис. 1. Динамика показателя мертвых клеток HT-29 в питательной среде в модельном эксперименте с накопительной дозой облучения.
* - статистически значимые отличия (р<0,05) относительно контроля,
** - статистически значимые отличия (р<0,05) относительно первого дня облучения
После 5-дневного облучения на линейном ускорителе Novalis TX культуры клеток HT-29 в дозах 5 и 7 Гр обнаружено значительное снижение общего количества клеток на 55,6 и 71,5% соответственно (р<0,05) (рисунок 2). Как видно, СОД=35 Гр (5 фракций РОД=7 Гр) оказала более выраженный эффект на элиминацию опухолевых клеток, превышающий на 15,9% эффект от СОД=25 Гр (5 фракций РОД=5 Гр) (р<0,05).
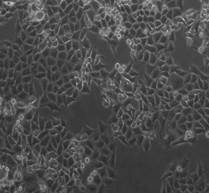
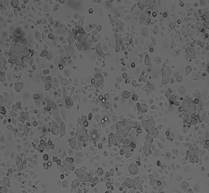

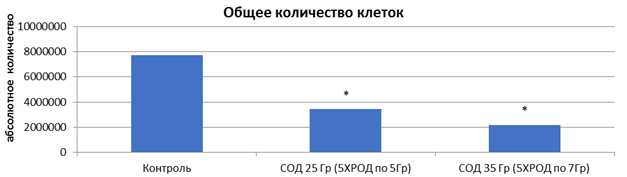
Рис. 2. Микрофотография клеточного монослоя HT-29 после пятого дня облучения (слева направо: контроль - СОД 25 Гр (5 фракций по РОД=5 Гр, изоэффективная доза 37,5 Гр) - СОД 35 Гр (5 фракций по РОД=7 Гр, изоэффективная доза 49,6 Гр)) и общее количество клеток. * - статистически значимые отличия (р<0,05) относительно контроля
Из представленных в таблице и на рисунках 3, 4 и 5 данных видно, что после 5 дней культивирования в контрольных флаконах оставалось 94,07±0,35% живых клеток, одновременно с этим присутствовали клетки, находящиеся на разных стадиях гибели – ранний апоптоз 0,53±0,32%, поздний апоптоз/некроз 4,93±0,51% и мёртвые клетки 0,47±0,06%.
После 5 дней облучения культуры клеток НТ-29 в дозе 5 Гр (СОД 25 Гр, изоэффективная доза 37,5 Гр) наблюдалось изменение соотношений клеток, находящихся на разных стадиях апоптоза: снижение процента живых клеток до 76,13±3,13%, что в 1,2 раза меньше по сравнению с контролем (р=0,0006); процент клеток, находящихся на стадии раннего апоптоза увеличился до 3,23±0,95%, что выше контрольных значений в 6,1 раза (р=0,0096); доля клеток, находящихся на поздних стадиях апоптоза (некроза), и мертвых клеток достигло значений соответственно 17,67±2,42% и 2,97±0,71%, что в 3,6 и в 6,3 раза выше контрольных (р<0,05).
Показатели функционального состояния клеток НТ-29 после различных режимов облучения
|
|
Живые клетки |
Ранний апоптоз |
Поздний апоптоз/ некроз |
Мёртвые клетки |
|
Контроль, n=3 |
94,07±0,35 |
0,53±0,32 |
4,93±0,51 |
0,47±0,06 |
|
СОД 25 Гр (5 фракций по РОД=5 Гр, изоэффективная доза 37,5 Гр) |
76,13±3,13 |
3,23±0,95 |
17,67±2,42 |
2,97±0,71 |
|
% отличия от контроля |
-19 |
+509 |
+258 |
+532 |
|
Р=0,0006 |
Р=0,0096 |
Р=0,0009 |
Р=0,0037 |
|
|
СОД 35 Гр (5 фракций по РОД=7 Гр, изоэффективная доза 49,6 Гр) |
65,83±3,0 |
3,07±0,49 |
25,73±1,42 |
5,33±1,75 |
|
% отличия от контроля |
-30 |
+479 |
+422 |
+1034 |
|
Р=0,0001 |
Р=0,0017 |
Р=0,000018 |
Р=0,0086 |
|
|
% отличия от СОД 25 Гр |
-14 |
-5 |
+46 |
+80 |
После 5 дней облучения культуры клеток НТ-29 в дозе 7 Гр (СОД 35 Гр, изоэффективная доза 49,6 Гр) количество живых клеток снизилось в 1,4 раза (р<0,05) (до значения 65,83±3,0%) относительно контроля, что ниже в 1,1 раза (р<0.05) значений после облучения при СОД 25 Гр. Количество клеток на стадии раннего апоптоза превысило значения контроля в 5,8 раза (р<0,05), а клеток, находящихся на поздних стадиях апоптоза (или некроза), и мертвых клеток достигло значений соответственно 25,73±1,42%, что больше в 5,2 раза (р<0,05) значений контроля и в 1,5 раза (р<0,05) значений при СОД 25 Гр) и 5,33±1,75 (больше в 11,3 раза (р<0,05) значений контроля и в 1,8 раза (р<0,05) значений при СОД 25 Гр) (рисунок 5).

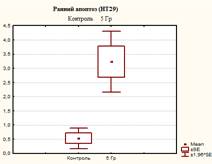
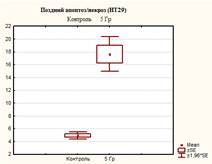

Рис. 3. Оценка уровня апоптоза в культуре клеток НТ-29 после пятидневного облучения при РОД=5 Гр (СОД 25 Гр, изоэффективная доза 37,5 Гр)

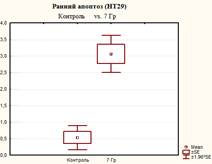


Рис. 4. Оценка уровня апоптоза в культуре клеток НТ-29 после пятидневного облучения при РОД=7 Гр (СОД 35 Гр, изоэффективная доза 49,6 Гр)
Таким образом, после 5-дневного облучения определенный пул клеток НТ-29 сохранил жизнеспособность. Доля таких клеток для СОД 25 Гр (5 фракций по РОД =5 Гр, изоэффективная доза 37,5 Гр) составила 33,7%, для СОД 35 Гр (5 фракций по РОД=7 Гр, изоэффективная доза 49,6 Гр) - 18,5% от изначального количества клеток, взятых в эксперимент. Возможно, наблюдаемый эффект с развитием радиорезистентности благодаря определенным молекулярно-генетическим особенностям этих клеток. Известно, что ионизирующее излучение вызывает повреждения ДНК в опухолевых клетках, индуцирует двухцепочечные разрывы (ДЦР) [11]. Однако некоторые опухолевые клетки способны использовать системы репарации ДЦР для преодоления радиоцитотоксичности, а также иные сигнальные пути, не являющиеся частью репарационных систем клетки [10]. Важно отметить, что для проецирования подобной экспериментальной модели на целостный организм необходимо учитывать такие факторы, как иммунная система [12] и микроокружение опухоли [13]. И, вероятно, in vivo воздействие данных доз будет проявляться несколько иначе.
|
НТ29. Контроль |
|
|
|
НТ29. СОД 25 Гр (5 фракций по РОД =5 Гр) |
|
|
|
НТ29. СОД 35 Гр (5 фракций по РОД=7 Гр) |
|
|
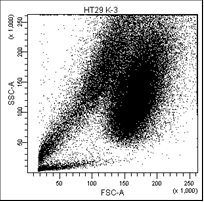
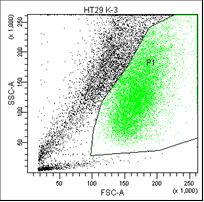
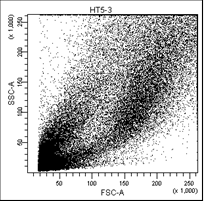
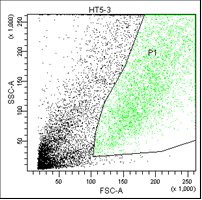
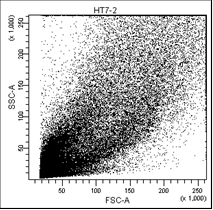
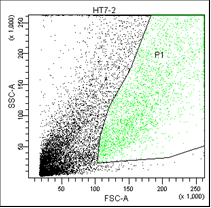
В первом столбце графиков показаны клетки в зависимости от их размера и гранулярности, неокрашенные.
Во втором столбце графиков выделены опухолевые клетки, без учёта дебриса.
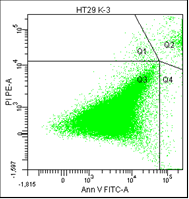
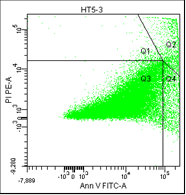
В третьем столбце графиков показано расположение опухолевых клеток, окрашенных пропидием и аннексином.
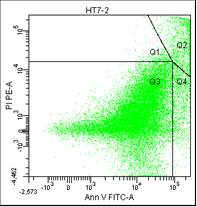
• Q1 – мёртвые клетки (окрашены пропидием).
• Q2 – поздний апоптоз/некроз (клетки окрашены пропидием и аннексином).
• Q3 – живые клетки (не окрашены ни аннексином, ни пропидием).
• Q4 – ранний апоптоз (клетки, окрашенные только аннексином).
Рис. 5. Оценка уровня апоптоза клеток НТ-29 после лучевой терапии в разных режимах в течение 5 дней (данные проточного цитофлюориметра)
Заключение. Проведенное модельное исследование позволило установить, что пятидневная лучевая терапия культуры клеток человека НТ-29 при РОД 5 и 7 Гр с использованием ускорителя Novalis TX приводит к снижению общего количества опухолевых клеток, увеличению количества мертвых клеток и клеток, находящихся на разных стадиях апоптоза. Цитотоксический эффект от РОД 5 и 7 Гр проявился уже после первого облучения, и для РОД = 7 Гр был выражен сильнее. Тем не менее после пятидневного облучения в дозах 5 (СОД 25 Гр, изоэффективная доза 37,5 Гр) и 7 Гр (СОД 35 Гр, изоэффективная доза 49,6 Гр) 33,7% и 18,5% соответственно от изначального количества клеток аденокарциномы толстой кишки линии HT-29 сохранили свою жизнеспособность, что может быть связано с проявлением эффекта радиорезистентности.
Библиографическая ссылка
Кутилин Д.С., Кошелева Н.Г., Максимов А.Ю., Гусарева М.А., Бондаренко Е.С., Сагакянц А.Б., Донцов В.А., Габричидзе П.Н., Черняк М.Н., Гречкин Ф.Н., Мезенцев С.С., Ульянова Е.П., Полуэктов С.И. ВЛИЯНИЕ РАЗЛИЧНЫХ ДОЗ ЛУЧЕВОЙ ТЕРАПИИ НА ВЫЖИВАЕМОСТЬ КЛЕТОК АДЕНОКАРЦИНОМЫ ТОЛСТОЙ КИШКИ ЛИНИИ HT-29 // Современные проблемы науки и образования. – 2019. – № 3. ;URL: https://science-education.ru/ru/article/view?id=28918 (дата обращения: 25.04.2024).