Цель работы. В связи с отсутствием в литературе сведений по совместной растворимости карбоната и фосфата натрия выполнено исследование растворимости в трехкомпонентной системе Na2CO3-Na2HPO4-H2O при 80° C и скорости перехода безводного карбоната натрия в одноводную соль в процессе получения содовой суспензии.
Экспериментальная часть
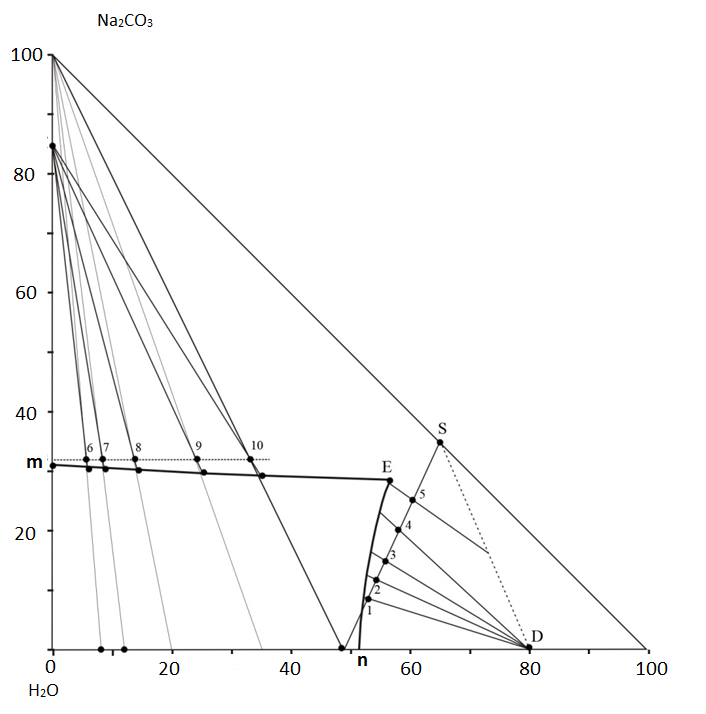
Равновесное насыщение проводили в термостатированной пробирке с мешалкой и обратным холодильником. Для насыщения брали растворы динатрийфосфата, содержащие 6, 12, 20, 35 и 51 % динатрийфосфата. Суспензию выдерживали при температуре 80° C в течение 8 часов и отбирали пробу насыщенного раствора для анализа на содержание карбоната натрия (по объему CO2 газометрически [4]) и фосфата натрия (по P2O5 фотоколориметрически [4]). Для изучения насыщения системы фосфатом натрия раствор, содержащий 48 % динатрийфосфата, смешивали со смесью 1 весовой части безводного карбоната натрия с 2 весовыми частями безводного динатрийфосфата, полученного обезвоживанием 12 водной соли квалификации «XЧ» при температуре 140° C до постоянного веса. Количество соли и смеси солей соответствовало отношениям 3:1, 2:1, 15:1, 1:1, 1:2 (точки 1-5 на рисунке). Составу смеси солей соответствует точка S на диаграмме.
Состав равновесных твердых фаз установлен методом Схрейнемакерса [5] по пересечению линий, соединяющих точки состава насыщенных растворов и точек состава исходной смеси раствора с карбонатом натрия или смесью солей.
В твердой фазе содовой суспензии определяли долю гидратной влаги весовым методом после сушки осадка при 120-140 °С [6]. Перед сушкой осадок промывали ацетоном для удаления жидкой фазы и сушили в термостате при 100-105 °С [7].
Результаты и их обсуждения
Результаты исследования представлены на рисунке в виде диаграммы состояния трехкомпонентной системы. Линия mE на диаграмме представляет растворы, насыщенные одноводным карбонатом натрия, а линия nE - двухводным динатрийфосфатом. При температуре 80° С в данной системе осаждение двойных солей и безводных индивидуальных солей не происходит.
В совместном растворе карбонат натрия высаливается более растворимым динатрийфосфатом. Растворимость его с ростом доли динатрийфосфата снижается с 31,4 % (в воде) до 27 % в растворе, содержащем 55 % динатрийфосфата. Растворимость динатрийфосфата в совместных растворах с увеличение доли карбоната натрия в нем растет с 52 % (в воде) до 55 % в растворе, содержащем 27 % карбоната натрия.
Полученные данные по равновесной растворимости позволяют полагать, что в процессе выдержки содовой суспензии безводный карбонат натрия как метастабильная фаза продолжает растворяться при одновременном осаждении одноводного карбоната натрия.
Анализ твердой фазы содовой суспензии, полученной растворением соды в 20 % растворе динатрийфосфата, на содержание гидратной влаги показывает, что по мере выдержки суспензии при температуре 80° С доля гидратной влаги в осадке составляет через 60 минут 8,6 % масс., через 120 минут она возрастает до 10,8 %, через 4 часа до 12,9 % и через 8 часов до 13,9 %. Судя по полученным данным, полный переход безводного карбоната натрия в одноводную соль, доля гидратной влаги в которой составляет 14,5 %, не достигается. Степень перехода карбоната натрия в одноводный кристаллогидрат за 8 часов составляет 88,2 % и практически не меняется с дальнейшим увеличением времени выдержки суспензии до 24 часов (88,5 %). Можно предположить, что выпадающий одноводный карбонат натрия частично отлагается на поверхности кристаллов безводного карбоната натрия, экранирует поверхность растворения и препятствует дальнейшему растворению частиц соды.
В процессе приготовления содовой суспензии из-за связывания части воды в кристаллогидрат карбоната натрия доля равновесной жидкой фазы уменьшается с одновременным ростом массы равновесной твердой фазы. В результате массовое соотношение жидкой и твердой фаз (Ж:Т) в содовой суспензии снижается с 5,2 до 4,1-4,6.
Заключение
При температуре 80° С в системе Na2CO3 - Na2HPO4 - H2O равновесными твердыми фазами являются одноводный карбонат натрия и двухводный динатрийфосфат.
Карбонат натрия высаливается динатрийфосфатом из совместных растворов.
Рецензенты:
- Луконин В.П., д.т.н., профессор, генеральный директор НИИ Полимеров им. А.А. Каргина, г. Дзержинск.
- Ширшин К.В., д.х.н., профессор, заместитель директора НИИ Полимеров им. А.А. Каргина по научной работе, г. Дзержинск.
Библиографическая ссылка
Никандров М.И., Никандров И.С. РАСТВОРИМОСТЬ В СИСТЕМЕ NA2CO3-NA2HPO4-H2O // Современные проблемы науки и образования. – 2011. – № 6. ;URL: https://science-education.ru/ru/article/view?id=5161 (дата обращения: 20.04.2024).



