Цель исследования. Оценить на молекулярно-генетическом уровне вовлеченность 3-й фазы метаболизма ксенобиотиков (т.е. элиминации) в развитие ДЦП.
Материалы и методы. Материалом для клинического и молекулярно-генетического исследования послужила выборка из 126 не родственных детей с ДЦП и 126 условно здоровых детей. Все обследованные дети были русской национальности, уроженцы Курской области. Обследование больных ДЦП проводилось на базе МУЗ «Городская детская больница № 2» и санатория им. Феодосия Печерского. Обследование детей группы контроля проводилось во время плановых медосмотров в поликлиниках г. Курска. Группы здоровых и больных детей были сопоставимы по полу и возрасту.
Диагноз ДЦП устанавливался на основании неврологического статуса, данных анамнеза, сведений из медицинской документации (амбулаторная карта, история болезни). В соответствии с классификацией Gross Motor Function Classification System - Expanded and Revised (GMFCS - E&R) больные ДЦП были разделены на 5 классов в зависимости от возможности передвигаться в пространстве [6]. Учитывая немногочисленность исследуемой выборки, а также схожесть 1 и 2 классов, 4 и 5 классов GMFCS, указанные классы были объединены. Таким образом, больные ЦП оказались разделены на 3 группы: 1 - возможно самостоятельное передвижение в пространстве (76 детей); 2 - передвижение в пространстве возможно с использованием ручных средств передвижения (трости, «крабы») (24 детей); 3 - передвижение больного в пространстве за счет опоры собственных нижних конечностей невозможно в связи с выраженностью двигательных нарушений (26 детей).
Выделение геномной ДНК осуществляли из размороженной крови стандартным методом фенольно-хлороформной экстракции. Генотипирование полиморфизма C3435T гена MDRI проводили методом ПЦР-ПДРФ согласно протоколу, описанному в литературе [7]. Результаты электрофоретического разделения в агарозном геле фрагментов ДНК, полученных после рестрикции продуктов гидролиза, содержащих полиморфизм C3435T гена MDRI, представлены на рисунке 1.
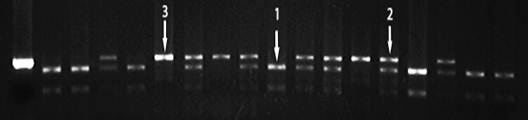
Рис. 1. Электрофоретическое разделение фрагментов ДНК, содержащих полиморфизм С3435Т гена MDRI: 1 - 3435 CC («дикий» генотип); 2 - 3435 CT (гетерозиготный генотип); 3 - 3435 TT (мутантный генотип).
Результаты исследования и их обсуждение. Для оценки соответствия распределений генотипов ожидаемым значениям при тестировании на равновесие Харди-Вайнберга и для сравнения распределений частот генотипов и аллелей в выборках больных ДЦП и здоровых детей использовали критерий χ2 Пирсона. При количестве наблюдений в выборке менее 10 учитывали поправку Йетса на непрерывность. Уровень значимости принимали р<0,05.
Частоты генотипов полиморфизма C3435T гена MDRI в объединенной группе пациентов находились в соответствии с равновесием Харди-Вайнберга (р>0,05). В то же время среди детей с ДЦП отмечена тенденция к снижению уровня наблюдаемой гетерозиготности, не достигавшая уровня статистической значимости (Но=0,42, Не=0,49, χ2=2,58, р>0,05).
Различий в частотах аллелей и генотипов полиморфизма С3435Т гена MDRI между группами здоровых детей и больных церебральным параличом не выявлено (таблица 1).
Таблица 1 - Распределение частот аллелей и генотипов полиморфизма C3435T гена MDRI в группах здоровых детей и больных церебральным параличом
|
Распределение частот аллелей исследуемого полиморфизма |
||||
|
Исследуемые группы |
3435C |
3435T |
||
|
Больные ДЦП (n=125) |
0,433 |
0,567 |
||
|
Здоровые (n=126) |
0,409 |
0,591 |
||
|
Критерий различий, χ2 (р) |
0,29 (0,59) |
|||
|
Распределение частот генотипов исследуемого полиморфизма |
||||
|
Исследуемые группы |
3435СС |
3435СТ |
3435ТТ |
|
|
Больные ДЦП (n=126) |
28 (22,2%) |
53 (42,1%) |
45 (35,7%) |
|
|
Здоровые (n=126) |
21 (16,7%) |
61 (48,4%) |
44 (34,9%) |
|
|
Критерий различий, χ2 (р) |
1,24 (0,27) |
1,03 (0,31) |
0,02 (0,9) |
|
Анализ частот генотипов здоровых детей и больных ДЦП в зависимости от возможности самостоятельно передвигаться показал, что среди больных детей с выраженными двигательными нарушениями имеет место статистически значимое увеличение частоты мутантного генотипа 3435 ТТ гена MDRI (OR=2,54; 95%CI 1,08-6,01) по сравнению с контрольной группой (таблица 2).
Таблица 2 - Распределение частот генотипов полиморфизма C3435T гена MDRI среди больных ДЦП с учетом возможности самостоятельного передвижения и в группе здоровых детей
|
Исследуемые группы |
I группа (n=76) |
II группа (n=24) |
III группа (n=26) |
||||||
|
С/С |
С/Т |
Т/Т |
С/С |
С/Т |
Т/Т |
С/С |
С/Т |
Т/Т |
|
|
Больные ЦП, n (%) |
19 (25) |
33 (43,4) |
24 (31,6) |
7 (29,2) |
11 (45,8) |
6 (25) |
2 (7,7) |
9 (34,6) |
15 (57,7) |
|
Здоровые дети, n (%) |
21 (16,7) |
61 (48,4) |
44 (34,9) |
21 (16,7) |
61 (48,4) |
44 (34,9) |
21 (16,7) |
61 (48,4) |
44 (34,9) |
|
Критерий различий, χ2 (р) |
2,07 (0,15) |
0,47 (0,49) |
0,24 (0,63) |
1,33 (0,25) |
0,05 (0,82) |
0,5 (0,48) |
0,74 (0,39) |
1,14 (0,29) |
4,71 (0,03) |
Отметим, что из 15 больных ДЦП, обладавших вариантным 3435 ТТ генотипом, 10 индивидов были недоношенными, и 5 детей рождены на сроке 38-40 недель.
Ген MDRI расположен на хромосоме 7q21.1 и кодирует Р-гликопротеин - фермент, относящийся к III фазе биотрансформации ксенобиотиков [7]. Одной из наиболее значимых мутаций в гене MDRI является замена последовательности нуклеотидов в позиции 3435 в 26-м экзоне (С3435Т) [8]. Несмотря на то что данная мутация в гене MDRI не сопровождается изменением структуры кодируемого P-гликопротеина, в различных исследованиях показано снижение генной экспрессии в 2-3 раза при наличии 3435 ТТ-генотипа [10]. Р-гликопротеин экспрессируется в эпителиальных клетках печени, почках и кишечнике. Особенно важную роль играет выработка данного пептида в эндотелиальных клетках капилляров головного мозга, посредством чего регулируется поступление многих фармпрепаратов из крови в паренхиму головного мозга [10]. Но, несомненно, наиболее значимым местом выработки и одновременно точкой приложения данного фермента является субапикальная часть клеток эпителия сосудистых сплетений желудочков головного мозга, где Р-гп участвует в элиминации токсических продуктов метаболизма из крови в цереброспинальную жидкость [8]. Учитывая высокую частоту пери- и интравентрикулярных кровоизлияний среди недоношенных детей (31-55% при гестационном возрасте менее 35 недель [1]), можно предположить, что на фоне органических изменений в сосудистых сплетениях желудочков головного мозга возникает предпосылка к нарушению работы Р-гликопротеин опосредованного транспорта продуктов метаболизма. Очевидно, что недостаточность выведения эндогенных метаболитов в ликвор в условиях мощного оксидантного стресса создает условия для накопления и токсического воздействия ксенобиотиков на структуры головного мозга. В то же время интерпретировать полученные результаты необходимо с осторожностью, учитывая относительно небольшой объем исследованных выборок. Чтобы сделать окончательный вывод о вовлеченности гена MDRI в развитие ДЦП, необходимо проведение исследования на выборках значительно большего объема, а также исследование функционального анализа генной экспрессии гена MDRI.
Заключение. Таким образом, в группе больных ДЦП установлена ассоциация мутантного генотипа 3435 ТТ гена MDRI с риском развития тяжелых двигательных нарушений.
Рецензенты
- Иванов Владимир Петрович, д.мед.н., профессор, заслуженный деятель науки РФ, академик РАЕН, заведующий кафедрой биологии, медицинской генетики и экологии ГБОУ ВПО «Курский государственный медицинский университет» Минздравсоцразвития России, г. Курск.
- Королев Владимир Анатольевич, д.биол.н., профессор кафедры биологии, медицинской генетики и экологии ГБОУ ВПО «Курский государственный медицинский университет» Минздравсоцразвития России, г. Курск.
Библиографическая ссылка
Борзилов Е.Е., Полоников А.В., Трубникова Е.В., Курцева Е.С., Толбатова Н.О., Анцупова Г.В., Борзилов Е.Е. СВЯЗЬ ПОЛИМОРФИЗМА С3435Т ГЕНА МНОЖЕСТВЕННОЙ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ 1-ГО ТИПА С ДВИГАТЕЛЬНЫМИ НАРУШЕНИЯМИ ПРИ ДЕТСКОМ ЦЕРЕБРАЛЬНОМ ПАРАЛИЧЕ // Современные проблемы науки и образования. – 2012. – № 2. ;URL: https://science-education.ru/ru/article/view?id=5920 (дата обращения: 19.04.2024).



