Пентаферрит лития LiFe5O8 является удобным модельным объектом при изучении новых явлений в сложнооксидных системах, таких, например, как явление радиационно-термической интенсификации твердофазных процессов в ферритах [1]. В работах [2; 3] сообщалось, что при изотермическом обжиге смеси карбоната лития и оксида железа в условиях электронного облучения наблюдается многократное увеличение скорости синтеза пентаферрита лития при температуре 600 °С в сравнении с синтезом при термическом обжиге. Эти данные указывают на наличие эффекта радиационной стимуляции твердофазного синтеза пентаферрита лития. Однако с методологической точки зрения существенным остается вопрос о характере фазовых превращений при синтезе пентаферрита лития в условиях различной скорости нагрева реакционной смеси. Такого рода исследования помогут корректно интерпретировать полученные результаты по радиационно-термическому синтезу литиевых ферритов, где в основном используются большие скорости нагрева и охлаждения при воздействии высокоэнергетического электронного пучка. Данную задачу можно решить, применяя ТГ/ДСК методику.
Целью настоящей работы является исследование влияния скорости нагрева на твердофазное взаимодействие в реакционной смеси Li2CO3/α-Fe2O3.
Методика эксперимента
Исходными компонентами реакционной смеси для синтеза пентаферрита лития служили порошки a-Fe2O3 (ЧДА) и Li2CO3 (ХЧ). Перед взвешиванием порошки просушивались в течение 7 ч при температуре ~ 200 °С в сушильном шкафу. Затем порошки взвешивались в пропорции, соответствующей реакции 5Fe2O3+Li2СO3®2LiFe5O8+СО2 и смешивались путем 3-кратного протирания через сито с ячейкой 110 мкм. Образцы реакционной смеси представляли собой свободно засыпанный в измерительные тигли порошок. Насыпная плотность оказалась равной 0,95 г/см3.
Калориметрические измерения осуществлялись в воздушной атмосфере в процессе линейного нагрева в диапазоне скоростей Vнагр=(5-50) °С/мин с помощью термического анализатора STA 449C Jupiter фирмы Netzsch (Германия). Диапазон скоростей был ограничен аппаратурными возможностями установки.
Экспериментальные результаты и их обсуждение
На рис. 1 приведены кривые ДСК, полученные при нагреве реакционной смеси для двух граничных скоростей нагрева образцов: Vнагр=5 °С/мин и Vнагр=50 °С/мин. Применяя программу Peak Separation, разработанную фирмой Netzsch для разделения сложных пиков на составляющие, были выделены из кривых ДСК пять устойчиво повторяющихся эндотермических пиков (рис. 1), из которых первые три S1(545 °С), S2(612 °С) и S3(~690 °С) входят в состав широкого пика ДСК. Четвертый пик S4(730 °С) - связан с плавлением карбоната лития; пятый Sa-b(755 °С) - с переходом «порядок-беспорядок» в октаэдрической подрешетке пентаферрита лития [4; 5]. Площади (интенсивности) всех наблюдаемых пиков ДСК фактически являются энтальпиями реакций, нормированными на массу всей навески.
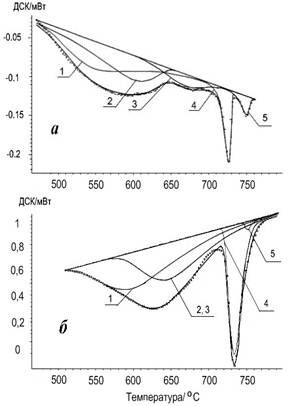
Рис. 1. Разложение кривых ДСК для смеси 1:5 при Vнагр=5 °С/мин (а) и Vнагр=50 °С/мин (б). 1 - S1, 2 - S2, 3 - S3, 4 - S4, 5 - Sa-b
Видно, что трансформация результирующих кривых при переходе к высоким скоростям нагрева заключается в кажущемся упрощении спектра с четырех до двух максимумов. Однако результаты разложения показывают, что на самом деле все составляющие сохраняются и только слабоинтенсивный пик S3 не удается выделить при Vнагр=50 °С/мин. Подробная информация об изменении параметров ДСК при повышении скорости нагрева образцов приведена в таблице 1. Из этих данных видно, что интенсивности всех компонентов широкого пика ДСК (S1 - S3) уменьшаются с повышением скорости нагрева, а интенсивность узкого пика S4 - возрастает. Вероятно, что первые три пика обусловлены ионным обменом между частицами реагентов, находящимися в твердом состоянии, а четвертый - между твердой (α-Fe2O3) и жидкой (Li2CO3) фазами.
Таблица 1 - Зависимости параметров ДСК от скорости нагрева
|
Скорость нагрева |
Нагрев |
Охлаждение (Vохл=10 °С/мин) |
|||||||||||
|
V |
S1 |
T1 |
S2 |
T2 |
S3 |
T3 |
S4 |
T4 |
Sa-b |
Ta-b |
Sa-b |
Тк |
Δm при Тк |
|
К/мин |
Дж/г |
°С |
Дж/г |
°С |
Дж/г |
°С |
Дж/г |
°С |
Дж/г |
°С |
Дж/г |
°С |
% |
|
5 |
46.2 |
548 |
38.3 |
600 |
10.6 |
670 |
13.5 |
727 |
4.7 |
750 |
8.71 |
630.9 |
0.2 |
|
10 |
43.6 |
562 |
30.9 |
605 |
8.9 |
683 |
16.2 |
728 |
4.5 |
751 |
7.43 |
630.1 |
0.2 |
|
20 |
42.6 |
575 |
34.7 |
622 |
5.8 |
693 |
20.7 |
729.5 |
2.9 |
750 |
7.29 |
628.9 |
0.2 |
|
30 |
41.7 |
583 |
34.6 |
628 |
- |
- |
23.8 |
730.4 |
1.9 |
750 |
6.37 |
629 |
0.18 |
|
40 |
40.7 |
587 |
34.1 |
635 |
- |
- |
24.7 |
733 |
1.5 |
751 |
5.02 |
629 |
0.18 |
|
50 |
39.8 |
597 |
33.2 |
646 |
- |
- |
24.7 |
733.9 |
0.9 |
751 |
4.85 |
629.1 |
0.18 |
Вполне очевидно, что повышение скорости нагрева сокращает время взаимодействия между твердыми фазами, сохраняя в большем количестве непрореагировавший Li2CO3 до температуры изменения его агрегатного состояния (~730 °С). Пленка образовавшегося расплава за счет капиллярных сил мгновенно растекается по поверхности частиц Fe2O3, резко расширяя фронт взаимодействия между карбонатом лития и оксидом железа. Если к тому же учесть, что данный процесс реализуется при более высоких температурах, то легко понять причину значительно более высокой эффективности второй стадии разложения карбоната лития. Из-за возрастающего количества непрореагировавшего Li2CO3 (при повышении скорости нагрева) интенсивность пика S4 возрастает и оказывает маскирующее действие на соседние, относительно слабые пики S3 и Sa-b. Как видно из таблицы 1, эти пики уверенно выделяются до скорости нагрева 20 °С/мин включительно и поэтому данную скорость можно принять в качестве предельной при проведении детального анализа кривых ДСК.
Если пики S1 - S4 связаны с разложением карбоната лития, то пик ДСК Sa-b пропорционален энтальпии перехода a®b и поэтому характеризует количество фазы α-LiFe5O8, накопленной за время нагрева реакционной смеси до температуры нахождения максимума этого пика (750-755) °С. Поскольку с повышением скорости нагрева сокращается общая длительность обжига реакционной смеси, то представляется естественным наблюдаемое понижение интенсивности этого пика (табл. 1). Из того факта, что десятикратное увеличение скорости нагрева приводит только к пятикратному снижению интенсивности пика Sa-b , можно сделать вывод о нелинейной зависимости между длительностью обжига и количеством образующегося пентаферрита лития. Если рассмотреть данные, приведенные в таблице 1 для режима охлаждения, то легко заметить что во время дальнейшего неизотермического нагрева от температуры 755 °С до 800 °С и последующего охлаждения количество пентаферритовой фазы продолжает возрастать. (Природу гистерезисного сдвига положения максимумов пиков Sa-b при нагреве и охлаждении мы не обсуждаем.) Из этого становится очевидным, что в процессе разложения карбоната лития формируется не только пентаферрит лития, но и какие-то промежуточные фазы, взаимодействие которых между собой при дальнейшем нагреве до Т=800 °С и последующем охлаждении приводит к образованию дополнительного количества пентаферритовой фазы. Т.к. при рентгенофазовом анализе не обнаружено оксида лития в чистом виде, то в качестве промежуточных фаз после завершения разложения карбоната лития наиболее вероятными представляются соединения типа твердых растворов лития в оксиде железа, а также нестехиометрические фазы пента- и ортоферрита лития. Конечно, нельзя исключать возможность образования и сохранения какой-то доли оксида лития в рентгенонеразличимой форме (аморфной либо мелкодисперсной).
Заключение
- Эндотермические пики S1 - S4 связаны с разложением карбоната лития, пик ДСК Sa-b характеризует количество фазы α-LiFe5O8. Интенсивность пиков S1 - S3, Sa-b уменьшается с повышением скорости нагрева, S4 - возрастает.
- Для проведения детального анализа кривых ДСК скорость нагрева 20°С/мин является предельной для четкого выделения всех эндотермических пиков.
- Зависимость между длительностью обжига и количеством образующегося пентаферрита лития нелинейна.
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации в рамках федеральной целевой программы «Научные и научно-педагогические кадры инновационной России на 2007-2013 годы».
Рецензенты
- Суржиков Анатолий Петрович, д.ф.-м.н., профессор, зам. директора по науке Института неразрушающего контроля Томского политехнического университета, г. Томск.
- Ищенко Александр Николаевич, д.ф.-м.н., старший научный сотрудник, зам. директора по НИР НИИ Прикладной математики и механики Томского государственного университета, т. Томск.
Библиографическая ссылка
Лысенко Е.Н., Власов В.А., Малышев А.В., Гальцева О.В. ВЛИЯНИЕ СКОРОСТИ НАГРЕВА РЕАКЦИОННОЙ СМЕСИ НА ТВЕРДОФАЗНОЕ ВЗАИМОДЕЙСТВИЕ ПРИ НЕИЗОТЕРМИЧЕСКОМ СИНТЕЗЕ LIFE5O8 // Современные проблемы науки и образования. – 2012. – № 5. ;URL: https://science-education.ru/ru/article/view?id=7105 (дата обращения: 20.04.2024).



