рН-метрический метод определения титруемой кислотности (ТК) основан на измерении рН после проведения аналитической реакции со специальным реагентом (слабым основанием), взятом в избытке по отношению к количеству нейтрализуемых определяемых кислот. Именно избыток слабого основания обеспечивает быстрое и полное превращение определяемых кислот в соответствующие соли.
Целью данной работы было изучение возможности применения слабого основания – гидрофосфата натрия ![]() для определения ТК в водных растворах. Этот реагент характеризуется достаточно высокой основностью и имеет ряд неоспоримых преимуществ перед другими реагентами:
для определения ТК в водных растворах. Этот реагент характеризуется достаточно высокой основностью и имеет ряд неоспоримых преимуществ перед другими реагентами:
1) использование с ![]() стандартного фосфатного буфера для настройки рН-метра позволяет увеличить точность измерения рН.
стандартного фосфатного буфера для настройки рН-метра позволяет увеличить точность измерения рН.
2) в литературе имеются подробные данные для оценки температурного коэффициента для определения ТК с фосфатным реагентом [1], [2], [3].
3) фосфатный реагент может выпускаться промышленностью в виде Таблеток по технологии для стандартного буферного раствора.
Для успешного применения многоосновного фосфатного реагента нами предложена теория действия его в водных растворах. Она основана на уравнении электронейтральности раствора, что позволяет установить оптимальный диапазон рН для аналитических целей и найти причину нарушения аналитической зависимости.
При определении ТК в растворе ![]() рН раствора определяется тремя равновесиями:
рН раствора определяется тремя равновесиями:
- аналитической реакции:
![]() , (1)
, (1)
- реакции гидролиза ![]() :
:
![]() , (2)
, (2)
-реакции диссоциации ![]()
![]() . (3)
. (3)
где ![]() - величина ТК.
- величина ТК.
В системе ![]() из-за избытка
из-за избытка ![]() и высокой его основности полнота прохождения реакции (1) близка к 100%, и протонизацией
и высокой его основности полнота прохождения реакции (1) близка к 100%, и протонизацией ![]() можно пренебречь. Малые величины
можно пренебречь. Малые величины ![]() по сравнению с исходной концентрацией
по сравнению с исходной концентрацией ![]() позволяют пренебречь влиянием изменения ионной силы раствора (I) на коэффициенты активности и считать концентрационные константы диссоциации постоянными величинами.
позволяют пренебречь влиянием изменения ионной силы раствора (I) на коэффициенты активности и считать концентрационные константы диссоциации постоянными величинами.
Условие электронейтральности раствора:
![]() , (4)
, (4)
где в квадратных скобках указаны равновесные концентрации (моль ![]() ),
), ![]() - величина ТК для
- величина ТК для ![]()
![]() , (5)
, (5)
![]() . (6)
. (6)
Используя уравнения для концентрационных констант диссоциации
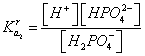 , (7)
, (7)
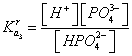 , (8)
, (8)
![]() . (9)
. (9)
и с учетом (5), (6) находим:
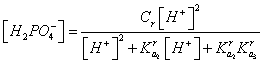 , (10)
, (10)
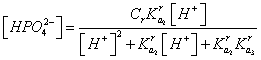 , (11)
, (11)
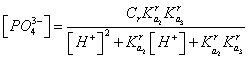 . (12)
. (12)
Из (5), (6), (9 - 12) и учитывая, что ![]() и в исследованной области рН 6,8 – 9,1, а
и в исследованной области рН 6,8 – 9,1, а ![]() и
и ![]() получаем:
получаем:
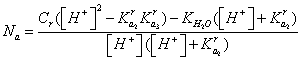 , (13)
, (13)
Чтобы найти оптимальный диапазон рН для определения ТК без титрования, рассчитаны коэффициенты активности ионов ![]() при ионной силе исходного водного раствора реагента
при ионной силе исходного водного раствора реагента ![]()
![]() по уравнению Дэвиса [3]:
по уравнению Дэвиса [3]:
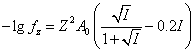 . (14)
. (14)
где ![]() - заряд иона,
- заряд иона, ![]() - константа, зависящая от температуры (при
- константа, зависящая от температуры (при ![]()
![]() ). Результаты расчета коэффициентов активности с помощью уравнения (Таблица 1).
). Результаты расчета коэффициентов активности с помощью уравнения (Таблица 1).
Таблица 1. Коэффициенты активности ионов ![]() в
в ![]() при
при ![]() .
.
|
| I | | ||
| 1 | 2 | 3 | ||
| 0,020 | 0,060 | 0,804 | 0,419 | 0,141 |
| 0,060 | 0,180 | 0,735 | 0,292 | 0,063 |
| 0,200 | 0,600 | 0,689 | 0,225 | 0,035 |
На основании термодинамических констант диссоциации ![]() [1],
[1], ![]() [4],
[4], ![]() [4] и коэффициентов активности (Таблица.1) рассчитаны концентрационные константы диссоциации (9-11) для выбранных условий:
[4] и коэффициентов активности (Таблица.1) рассчитаны концентрационные константы диссоциации (9-11) для выбранных условий: ![]() и
и ![]() , используя следующие уравнения:
, используя следующие уравнения:
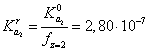 , (15)
, (15)
![]() , (16)
, (16)
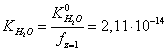 . (17)
. (17)
Величина рН исходного раствора реагента (![]() при
при ![]() и
и ![]() ) оказалась равной 9,1, что совпадает с экспериментально найденной [5].
) оказалась равной 9,1, что совпадает с экспериментально найденной [5].
Оптимальный для аналитических целей диапазон рН = (8,4 – 7,4) при ![]() = (0,62-4,94) ммоль экв
= (0,62-4,94) ммоль экв ![]() был определен экспериментально и подтвержден расчетом по уравнению:
был определен экспериментально и подтвержден расчетом по уравнению:
![]() , (18)
, (18)
где:
![]() , (19)
, (19)
![]() , (20)
, (20)
![]() - постоянная величина при постоянной ионной силе раствора и температуре.
- постоянная величина при постоянной ионной силе раствора и температуре.
Уравнение (18) соответствует линейной зависимости ![]() с наклоном, равным единице.
с наклоном, равным единице.
Если
![]() , (21)
, (21)
При условии (21) из (18) находим:
![]() , (22)
, (22)
где
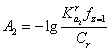 , (23)
, (23)
![]() - постоянная величина при постоянной ионной силе раствора и температуре.
- постоянная величина при постоянной ионной силе раствора и температуре.
При применении уравнения (18) для нахождения ![]() влияние температуры проявляется через зависимость константы
влияние температуры проявляется через зависимость константы ![]() от температуры. Это обусловлено зависимостью
от температуры. Это обусловлено зависимостью ![]() от температуры [1].
от температуры [1].
![]() , (24)
, (24)
Для исключения влияния температуры при определении ![]() рассчитаны
рассчитаны ![]() при разных температурах, соответствующие величины
при разных температурах, соответствующие величины ![]() (Таблица 2) и их температурный коэффициент
(Таблица 2) и их температурный коэффициент ![]() . Его правильность подтверждает значение
. Его правильность подтверждает значение![]() (Таблица.2), найденное Национальным Бюро Стандартов США для стандартного фосфатного буферного раствора.
(Таблица.2), найденное Национальным Бюро Стандартов США для стандартного фосфатного буферного раствора.
Таблица 2. Влияние температуры на константы ![]() и
и ![]() в аналитических уравнениях (18) и (22).
в аналитических уравнениях (18) и (22).
| | | I=0 | 0I=0,60 | |||||||
| | | | | | | | pH | | ||
| 15 | 0,5280 | 5,888 | 0,693 | 0,230 | 2,560 | 6,751 | 6,052 | 4,4 | 6,90 | 4,6 |
| 20 | 0,5070 | 6,166 | 0,690 | 0,228 | 2,704 | 6,729 | 6,030 | 6,88 | ||
| 3,0 | 4,6 | |||||||||
| 25 | 0,5115 | 6,310 | 0,689 | 0,225 | 2,804 | 6,715 | 6,016 | 6,86 | ||
| 3,2 | 2,6 | |||||||||
| 30 | 0,5161 | 6,456 | 0,685 | 0,221 | 2,921 | 6,698 | 5,999 | 6,85 | ||
![]()
![]()
Выводы
1. Предложена теория многоосновного фосфатного реагента с использованием 0,02 – 0,20М ![]() для рН-метрического определения ТК без титрования и отмечен ряд преимуществ этого реагента.
для рН-метрического определения ТК без титрования и отмечен ряд преимуществ этого реагента.
2. Получена зависимость рН от ![]() при небольшом избытке реагента по отношению к сумме определяемых ТК, важная для аналитических целей.
при небольшом избытке реагента по отношению к сумме определяемых ТК, важная для аналитических целей.
3. Рассчитан температурный коэффициент постоянных величин в зависимости рН от ![]() , необходимый для определения
, необходимый для определения ![]() .
.
СПИСОК ЛИТЕРАТУРЫ:
1. Робинсон Р., Стокс Р. Растворы электролитов/ Пер.с англ. под ред. Фрумкина А.Н. М.: Изд-во иностр. лит. 1963. – с. 541-601.
2. Турьян Я.И., Данильчук С.И., Лапшина Т.М., Макарова Л.М. А.с. СССР 1991. №1688159, Б.И. № 40 от 30.10.91.
3. Инцеди Я. Применение комплексов в аналитической химии / Пер. с англ. Петрухина О.М. и Спивакова Б.Я. М.: Мир. 1979. с.15.
4. Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия. 1989. – с.189, 298.
5. Швабе К. Основы техники измерения рН/ Пер. с нем. Под ред. Солодаря Л.С. М.: Изд-во иностр. лит. 1963. – с.328, 334.
Библиографическая ссылка
Хосроева Д.А., Курзанов А.Н., Турьян Я.И. РН-МЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ТИТРУЕМОЙ КИСЛОТНОСТИ С ИСПОЛЬЗОВАНИЕМ ГИДРОФОСФАТА НАТРИЯ // Современные проблемы науки и образования. – 2008. – № 3. ;URL: https://science-education.ru/ru/article/view?id=790 (дата обращения: 18.04.2024).



