Введение
Актуальной проблемой современной медицины является лечение и профилактика заболеваний печени. Строительным материалом клеток органа служат фосфолипиды, которые обладают гепатопротекторным эффектом, одновременно являясь детоксикантами и антицирротическими факторами [2].
Фосфатидилхолин, известный так же, как лецитин, является наиболее важным питательным веществом для поддержания активного состояния печени, а также универсальным строительным блоком для клеточных мембран и обладает антисклеротическим, нейропротекторным и гиполипидемическим действием, предотвращает образование желчных камней. Фосфолипиды, содержащиеся в лецитине, способствуют поддерживанию гомеостаза липидов в организме человека, а также препятствуют замещению печеночных клеток на холестазу [5].
Цель исследования
Известно, что лецитин в достаточных количествах содержится в клетках куриных яиц, поэтому целью настоящих исследований явилось изучение состава лецитина очищенного из яичных желтков, а также разработка оптимальных методик идентификации и количественного определения фосфолипидов, входящих в состав лецитина.
Материал и методы исследования
Объектом исследования является яичный лецитин, полученный на кафедре органической химии профессором Э. Т. Оганесяном и к. ф. н. М. М. Магоновым по модифицированной методике, отличающейся от прототипа тем, что в нем, во-первых, исключено применение солей кадмия; во-вторых, экстракция проводится индивидуальными малотоксичными растворителями (этиловый спирт, ацетон); технологическая схема реализуется на стандартном оборудовании с учетом требований к качеству, регламентируемому соответствующими НД [3].
Методы: химические (качественные реакции), гравиметрия, физико-химические (ТСХ).
Результаты исследования и их обсуждение
Суть методики получения лецитина из яичных желтков заключается в предварительной экстракции лецитина при низких температурах (-18–20 0С) ацетоном. Полученный экстракт подвергают многократной очистке поочередно этанолом и ацетоном. После удаления растворителей и упаривания готовый продукт представляет собой однородную массу плотной гелеобразной консистенции желтого цвета, легко растворимую в этаноле, хлороформе, умеренно – в жирных маслах и практически нерастворимую в воде очищенной и ацетоне.
Полученный лецитин неустойчив к воздействию света и высокой температуры.
С целью изучения состава полученного лецитина использовали метод ТСХ. Предварительно был проведен поиск оптимальной системы растворителей (подвижной фазы). Оказалось, что из 20 систем наиболее приемлемыми явились:
I) хлороформ – метанол (39:15);
II) хлороформ – этанол (39:15);
III) n-бутанол – ледяная уксусная кислота – вода (4:1:5);
IV) хлороформ – ацетон – метанол – ледяная уксусная кислота – вода (5:2:1:1:0,2).
Разделение предполагаемых фосфолипидов в лецитине проводили на пластинках марки «Сорбфил – УФ-254», нанося на линию старта 0,05 мкл 1 % хлороформного раствора изучаемого образца. При проявлении в парах йода проявляются семь пятен.
Результаты идентификации лецитина методом ТСХ представлены в таблице 1.
Таблица 1. Результаты идентификации лецитина методом ТСХ (проявитель – пары йода)
|
№ п/п |
Обнаруженное вещество |
Значение Rf |
|||
|
Системы растворителей |
|||||
|
I |
II |
III |
IV |
||
|
1 |
Фосфатидилхолин |
0,15 |
0,07 |
0,34 |
0,39 |
|
2 |
Фосфатидилэтаноламин |
0,30 |
0,18 |
0,27 |
0,35 |
|
3 |
Лизофосфатидилхолин |
0,80 |
0,83 |
0,89 |
0,64 |
|
4 |
Вещество «4» |
0,25 |
0,28 |
0,36 |
0,42 |
|
5 |
Вещество «5» |
0,28 |
0,45 |
0,48 |
0,53 |
|
6 |
Вещество «6» |
0,51 |
0,63 |
0,52 |
0,61 |
|
7 |
Вещество «7» |
0,71 |
0,98 |
0,74 |
0,78 |
Три пятна были идентифицированы, остальные («4»-«7») – нет, из-за отсутствия свидетелей.
Более четкого разделения веществ удалось добиться при использовании системы растворителей: хлороформ-этанол (39:5) (рис. 1).
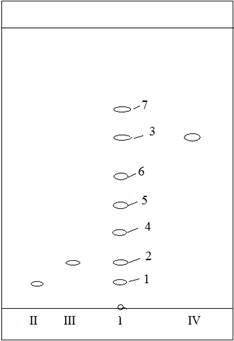
Рисунок 1. Хроматограмма лецитина в системе растворителей:
хлороформ-этанол (39:5)
Свидетели: II – Фосфатидилхолин
III – Фосфатидилэтаноламин
IV – Лизофосфатидилхолин
Полученные результаты позволяют предположить, что оптимальной подвижной фазой является система II, а также согласуются с литературными данными [4].
Кроме метода ТСХ для подтверждения подлинности фосфолипидов лецитина использовали химические реакции на функциональные группы и структурные элементы. Для анализа брали 5 % спиртовой раствор исследуемого лецитина.
Третичный амин и четвертичное аммониевое основание обнаруживали по появлению осадков после добавления раствора кадмия хлорида.
Сложноэфирную группу идентифицировали с помощью реакции образования гидроксамата железа (III) (красно-бурый осадок).
Остаток глицерина после щелочного гидролиза фосфолипидов и удаления выпавших в осадок жирных кислот из кислой среды обнаруживали с помощью реакции образования комплексной медной соли в аммиачной среде (синее окрашивание).
Остаток кислоты фосфорной после гидролиза идентифицировали реакцией взаимодействия саммония молибдатом в азотнокислой среде (желтый осадок).
Наличие холина подтверждали при нагревании гидролизата. Ощущался характерный запах триметиламина, который окрашивал смоченную водой очищенной красную лакмусовую бумагу в синий цвет.
Продукты окисления лецитина идентифицировали с помощью реактива Марки; на границе двух слоев жидкости появлялось красное окрашивание.
Сумму фосфолипидов также идентифицировали по стойкой водной эмульсии, а фосфатидилхолин – с помощью реакции осаждения ацетоном.
Кроме того, были установлены некоторые физические константы (табл. 2) с использованием фармакопейных методов для установления доброкачественности полученного лецитина [1].
Таблица 2. Некоторые числовые показатели яичного лецитина
|
№ п/п |
Числовые показатели |
Результаты |
|
1 |
Йодное число |
64,85±0,48 |
|
2 |
Кислотное число |
22,48±0,71 |
|
3 |
рН (потенциометрически) |
6,24±0,12 |
|
4 |
Потеря в массе при высушивании |
2,8% |
|
5 |
Зольный остаток |
3,6% |
|
6 |
Тяжелые металлы |
менее 0,001% |
|
7 |
Плотность |
1,332±0,014 |
Результаты, представленные в таблице 2, соответствуют требованиям ФС [6].
Предварительные исследования по поиску оптимального метода количественного определения лецитина с использованием титриметрических методов (неводное титрование, аргентометрия, нейтрализация в спиртовой среде) не дает достоверных и воспроизводимых результатов. Это объясняется тем, что лецитин – это комплекс фосфолипидов, и рассчитать правильный титр не представляется возможным. Поэтому оптимальным методом количественного определения фосфолипидов в полученном яичном лецитине является гравиметрия, основанная на минерализации лецитина до магния пирофосфата.
Методика. Около 1 г лецитина (точная навеска) помещают в колбу для определения азота вместимостью 500 мл, прибавляют 20 мл кислоты серной концентрированной и 3 мл кислоты азотной концентрированной. Смесь осторожно нагревают на сетке, на небольшом пламени до обесцвечивания раствора; для ускорения сгорания органического вещества к охлажденной смеси дополнительно прибавляют несколько раз малыми порциями кислоту азотную.
Остывший бесцветный раствор переносят в стакан, нейтрализуют концентрированным раствором аммиака (по метиловому красному), прибавляют несколько капель кислоты хлористоводородной, разведенной до кислой реакции, 10мл раствора аммония хлорида и нагревают раствор до 60 °С. К теплому раствору прибавляют 25 мл раствора смеси, состоящей из магния сульфата, аммония гидроксида, аммония хлорида и при постоянном помешивании 2,5 % раствора аммиака. Через 30 минут добавляют 20 мл концентрированного раствора аммиака и оставляют до полного осаждения. Через 12 часов смесь фильтруют через беззольный фильтр, осадок на фильтре промывают 8–10 раз 2,5 % раствором аммиака, фильтр осторожно сжигают, остаток прокаливают и взвешивают. Опыт повторяют трижды.
Содержание фосфора (X) в % рассчитывают по формуле:
Х%=а∙100%∙0,2783, (1)
где а – остаток после прокаливания (магния пирофосфат), г;
0,2783 – коэффициент пересчета на фосфор.
Результаты приведены в таблице 3.
Таблица 3. Результаты количественного определения фосфора в лецитине гравиметрическим методом
|
Навеска (г) |
Найдено магния пирофосфата (г) |
Найдено фосфора (г) |
Метрологические характеристики |
|
1,0035 |
0,1383 |
0,0385 |
SD=0,043 RSD=0,045
S t=2,45 ∆x=0,4
|
|
1,0009 |
0,1373 |
0,0382 |
|
|
1,0021 |
0,1365 |
0,0380 |
|
|
0,9982 |
0,1355 |
0,0377 |
|
|
1,0012 |
0,1368 |
0,0381 |
|
|
1,0027 |
0,1377 |
0,0383 |
|
|
0,9945 |
0,1338 |
0,0372 |
Полученные данные свидетельствуют о том, что исследуемый лецитин по количественному содержанию фосфора соответствует требованиям ФС, которого должно быть не менее 3,5 %.
С целью установления пригодности для аналитических целей разработанной методики гравиметрического определения фосфолипидов в яичном лецитине была проведена ее валидационная оценка по критериям: «Прецизионность», «Сходимость результатов определений» (статистика однородности выборки), «Число параллельных определений».
Фактор сходимости результатов двух параллельных определений L (P, n) при P=95 % иn=2, равен 2,77. В случае сходимости должно реализовываться неравенство:
|![]() -
-![]() |<L·S, (2)
|<L·S, (2)
где L – фактор, используемый при оценке сходимости результатов параллельных определений;
S – стандартное отклонение;
тогда:
L∙S=2,77∙0,026=0,07
а) |8,82-8,85|=0,03
б) |882-8,8|=0,02
Как видно из результатов 0,03<0,07 и 0,02<0,07.
Таким образом, результаты сходимы.
Число параллельных определений рассчитывается по формуле:
m=![]() , (3)
, (3)
где ∆Х – полуширина доверительного интервала величины;
εα–относительная ошибка результата отдельного определения;
![]() – среднее значение в %, равное 3,82 %.
– среднее значение в %, равное 3,82 %.
m=![]() =1,00
=1,00
Достаточно одного определения, так как ошибка при гравиметрическом определении (φ) равна 1 %.
Полученные результаты приведены в таблице 4.
Таблица 4. Результаты валидационной оценки количественного гравиметрического определения фосфора в лецитине очищенном
|
Определяемый критерий |
Полученные результаты |
Требования ГФ XII |
|
Прецизионность, SD
|
1,14% |
не более 2,8% |
|
Сходимость результатов двух определений |
0,05 0,08 |
0,12
|
|
Число параллельных определений |
1 |
_ |
Валидационная оценка методики количественного гравиметрического определения фосфора в яичном лецитине по критериям «Прецизионность», «Сходимость результатов определений», «Число параллельных определений» показала ее пригодность для аналитических целей.
Выводы
1. Изучен состав полученного лецитина с помощью метода ТСХ. Обнаружены: фосфатидилхолин, фосфатидилэтаноламин и лизофосфатидилхолин.
2. Разработаны методики идентификации входящих в лецитин фосфолипидов по функциональным группам.
3. Проведено количественное определение фосфолипидов по содержанию фосфора гравиметрическим методом.
4. С помощью валидационной оценки подтверждена пригодность методики количественного определения фосфора в яичном лецитине для аналитических целей.
Рецензенты:
Лазарян Джон Седракович, доктор фармацевтических наук, профессор, заведующий кафедрой токсикологической химии Пятигорского медико-фармацевтического института – филиала ГБОУ ВПО ВолгГМУ МЗ РФ, г. Пятигорск.
Попова Ольга Ивановна, доктор фармацевтических наук, профессор кафедры фармакогнозии Пятигорского медико-фармацевтического института – филиала ГБОУ ВПО ВолгГМУ МЗ РФ, г. Пятигорск.
Библиографическая ссылка
Арчинова Т.Ю., Манджиголадзе Т.Ю. ИЗУЧЕНИЕ СОСТАВА И АНАЛИЗ ЯИЧНОГО ЛЕЦИТИНА ХИМИЧЕСКИМИ И ФИЗИКО-ХИМИЧЕСКИМИ МЕТОДАМИ // Современные проблемы науки и образования. – 2013. – № 2. ;URL: https://science-education.ru/ru/article/view?id=9130 (дата обращения: 19.04.2024).



