Введение
Различия в стресс-реакции и устойчивости к стрессу у особей женского пола на разных стадиях эстрального цикла определяются разным содержанием гонадотропных гормонов, половых стероидов и глюкокортикоидов [1], опиоидных пептидов, вещества Р [11]. Важную роль в адаптации организма к стрессорному воздействию играют компоненты стресс-лимитирующих систем: энкефалины, вещество Р, пептид, вызывающий дельта-сон [3]. Уровень активных нейропептидов зависит от активности протеолитических ферментов, участвующих как в их процессинге, так и в инактивации [1]. Одним из ключевых ферментов процессинга ряда нейропептидов является карбоксипептидаза Н (КФ 3.4.17.10) (КПН), которая на последней стадии катализирует реакцию отщепления от пропептидов С-концевых основных аминокислот. Участие КПН в образовании активных форм пептидов определяет интерес к этому ферменту.
Цель исследования - изучение активности карбоксипептидазы Н в тканях самок крыс на разных стадиях эстрального цикла.
Материалы и методы исследования
Опыты проводили на самках белых беспородных крыс массой 180–250 г. Животных разделили на три группы: проэструс, эструс и диэструс. Стадию эстрального цикла определяли по влагалищным мазкам. В каждой группе выделили две подгруппы: стрессированную и контрольную. Контролем служили интактные животные. Для моделирования острого эмоционально-болевого стресса крысам в течение 2 ч в беспорядочном режиме подавали один из трех сигналов: вспышка света, звук, электрокожное раздражение. После воздействия стресса самок декапитировали непосредственно после воздействия (0 ч), через 0,5, 4 и 18 часов после стресса. Активность КПН определяли флюорометрическим методом по Fricker L.D., Snyder S.H. [12] при рН 5,6 по отщеплению дансил-Phe-Ala от дансил-Phe-Ala-Arg как разность в накоплении продукта реакции в пробах, не содержащих и содержащих гуанидиноэтилмеркаптоянтарную кислоту, и выражали в нмоль дансил-Phe-Ala образовавшегося за 1 мин инкубации в пересчете на 1 мг белка. Содержание белка в пробах определяли методом Lowry [10]. Отличия между средними значениями признаков определяли с помощью t-критерия Стьюдента, достоверными считали различия при p<0,05 [8]. Дисперсионный анализ проводили с помощью программы Statgraphics (версия 3.0) («STSC, Inc.», США) в режимах One-Way ANOVA и Multifactor ANOVA
Результаты исследования и их обсуждение
У контрольной группы животных в гипофизе и стриатуме активность карбоксипептидазы Н зависела и от стадии эстрального цикла (табл. 1).
Таблица 1. Активность КПН в тканях интактных самок крыс на разных стадиях эстрального цикла (нмоль дансил-фен-ала, образовавшегося за 1 мин инкубации на 1 мг белка; M ± m; n = 5÷6; о – р < 0,05, оо – р < 0,01, ооо – р < 0,001 относительно диэструса; х – р < 0,05, хх – р < 0,01, ххх – р < 0,001 относительно эструса).
|
Отдел |
Самки |
||
|
Стадии эстрального цикла |
|||
|
|
Проэструс |
Эструс |
Диэструс |
|
Гипофиз |
1,229±0,143´, оо |
0,690±0,048 оо |
0,445±0,040 |
|
Гипоталамус |
0,211±0,012 |
0,247±0,011 |
0,238±0,019 |
|
Стриатум |
0,168±0,015о |
0,195±0,012о |
0,153±0,013 |
|
Надпочечники |
0,071±0,004 |
0,067±0,009 |
0,091±0,012 |
|
Половые железы |
0,079±0,025 |
0,042±0,027 |
0,029±0,015 |
В гипофизе ферментативная активность была наиболее высокой в проэструсе, наиболее низкой – в диэструсе и промежуточной – в эструсе, причем активность в проэструсе была в 2,7 раза выше, чем в диэструсе. Активность КПН в стриатуме в проэструсе и эструсе выше, чем в диэструсе. В остальных исследованных отделах достоверных отличий не выявлено.
Существенные отличия, вероятно, связаны с более высоким уровнем синтеза и секреции биологически активных пептидов у самок крыс на этих стадиях полового цикла.
Динамика изменения активности фермента в эстральном цикле совпадает с динамикой изменения уровня секреции гонадотропных гормонов [1; 7], что может свидетельствовать о вовлечении КПН в процессинг предшественников гонадотропинов и, соответственно, в регуляцию эстрального цикла.
Воздействие острого эмоционально-болевого стресса продолжительностью 2 ч вызывало снижение активности КПН на стадии проэструс в гипофизе через каждый исследованный интервал времени после воздействия (рис. 1). Непосредственно после стресса активность фермента понижалась в 1,9 раза, через 30 мин – в 2,1 раза, а через 4 часа после воздействия в 3,1 раза. В гипоталамусе отмечено повышение активности фермента в проэструсе через 30 мин после стресса в 1,5 раза. В стриатуме наблюдалось увеличение активности карбоксипептидазы Н в проэструсе через 30 мин после стрессорного воздействия в 1,7 раза, в надпочечниках – через 4 ч в 1,4 раза.
Во время эструса в гипофизе активность КПН была достоверно ниже по отношению к норме непосредственно после воздействия (0 ч), через 4 и 18 ч после стресса в 1,9, 2,2 и 2 раза соответственно. В гипоталамусе на стадии эструс через 4 ч после действия стрессовых факторов наблюдалось снижение активности фермента в 1,2 раза. В стриатуме продолжительный эмоционально-болевой стресс приводил к снижению уровня ферментативной активности через 0 ч и 18 ч после воздействия в 1,4-1,6 раза. В надпочечниках на стадии эструса активность повышалась в 1,8 раз через 30 мин после эмоционально-болевого стресса.
В диэструсе наблюдалось увеличение активности КПН по отношению к контрольным животным в гипофизе через 0,5 ч после стрессирования в 2,2 раза, в гипоталамусе – через 0,5 и 18 ч, в стриатуме – через 4 ч.
Согласно данным двухфакторного дисперсионного анализа активность КПН при воздействии стресса длительностью 2 ч зависела от стадии эстрального цикла в гипофизе, гипоталамусе и надпочечниках, время после стрессирования достоверно влияло на ферментативную активность в гипофизе, гипоталамусе и стриатуме. Влияние взаимодействия стадии эстрального цикла и времени после действия стрессорных факторов продолжительностью 2 ч на активность КПН наблюдалось только в гипофизе самок крыс (табл. 2).
Полученные результаты свидетельствуют о том, что у самок опытных крыс активность КПН при действии острого эмоционально-болевого стресса в большей степени изменялась в гипофизе, гипоталамусе и надпочечниках – отделах, в которых синтезируются стресс-пептиды [2; 4; 9]. Эти данные подтверждают предположение о вовлечении КПН в процессинг предшественников биологически активных пептидов, участвующих в ответе на стресс, и, соответственно, в развитие стрессорных реакций и адаптации [5; 6].
У самок крыс острый стресс на стадиях проэструса и эструса вызывал преимущественно снижение активности КПН в гипофизе, гипоталамусе и стриатуме, а в диэструсе в этих отделах активность фермента повышалась. В надпочечниках во время эструса воздействие стресса приводило к увеличению ферментативной активности. Вероятно, что разнонаправленное изменение активности КПН на разных стадиях цикла при стрессе (снижение активности во время проэструса, эструса и повышение – в диэструсе) связано с различной устойчивостью животных к воздействию стрессовых факторов в течение эстрального цикла [1; 7].
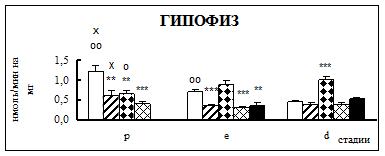
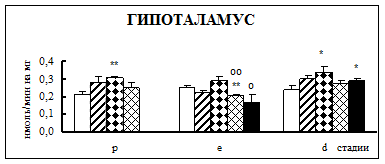
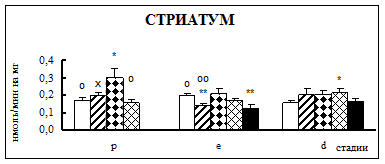


Рис. 1. Активность КПН в тканях крыс самок после воздействия стресса длительностью 2 ч (M ± m; n = 5÷6;* – р < 0,05, ** – р < 0,01, *** – р < 0,001 относительно нормы; о – р < 0,05, оо– р < 0,01, ооо – р < 0,001 относительно диэструса; х – р < 0,05, хх – р < 0,01, ххх – р < 0,001 относительно эструса)
Таблица 2. Дисперсионный анализ влияния взаимодействия времени после воздействия стресса (2 ч) и стадии эстрального цикла на активность КПН (значения отношения Фишера: FФ1 – влияние стадии эстрального цикла, FФ2 – влияние времени после воздействия стресса, FФ3 – влияние взаимодействия времени после воздействия стресса и стадии эстрального цикла)
|
Отдел |
FФ1 |
FФ2 |
FФ3 |
|
Гипофиз |
7,22** |
16,13*** |
6,45*** |
|
Гипоталамус |
5,42** |
4,35** |
1,17 |
|
Стриатум |
0,90 |
3,12* |
1,47 |
|
Надпочечники |
5,19** |
2,40 |
0,84 |
|
Яичники |
1,41 |
1,43 |
2,03 |
Таким образом, КПН, вероятно, принадлежит важная роль в определении отличий в ответной реакции на стресс, в адаптации и устойчивости к стрессирующему воздействию в зависимости от стадии эстрального цикла.
Рецензенты:
Микуляк Н.И., д.м.н., профессор, зав. кафедрой «Физиология человека» Медицинского института, Пензенский государственный университет, г. Пенза.
Моисеева И.Я., д.м.н., профессор, зав. кафедрой «Общая и клиническая фармакология» Медицинского института, Пензенский государственный университет, г. Пенза.
Библиографическая ссылка
Вишнякова Ж.С. ВЛИЯНИЕ ПРОДОЛЖИТЕЛЬНОГО ЭМОЦИОНАЛЬНО-БОЛЕВОГО СТРЕССА НА АКТИВНОСТЬ КАРБОКСИПЕПТИДАЗЫ Н В ТКАНЯХ САМОК КРЫС НА РАЗНЫХ СТАДИЯХ ЭСТРАЛЬНОГО ЦИКЛА // Современные проблемы науки и образования. – 2013. – № 6. ;URL: https://science-education.ru/ru/article/view?id=10821 (дата обращения: 18.04.2024).



