В настоящее время известно, что более 99% бактерий существуют в природных экосистемах не в виде свободно плавающих клеток, а в виде прикрепленных к субстрату биопленок [5]. Биопленки представляют собой сложные гетерогенные сообщества, ключевым структурным компонентом которых является внеклеточное полимерное вещество (матрикс), в то время как сами бактерии составляют лишь 5-35 % массы биопленки [1]. Матрикс представляет собой смесь таких компонентов, как липополисахариды, гликопротеины, протеогликаны, нуклеиновые кислоты и другие вещества, аналогичные по составу клеточным стенкам бактерий [5].
В растительно-бактериальных ассоциациях микробные ассоцианты способны проникать в корневые ткани и колонизировать корни растений с формированием биопленок, что, по мнению ряда исследователей, имеет существенное значение в увеличении сопротивляемости растений биотическим и абиотическим стрессам [2]. Микроорганизмы в биопленке существуют и ведут себя не так, как бактерии в культурной среде. Развитие нанотехнологий и появление сканирующей зондовой микроскопии позволило исследовать биопленки в их естественных состояниях [4]. Существует только два размера для каждой бактерии, имеющей форму палочки, а именно длина и диаметр. В этом легко убедиться, заглянув в Определитель бактерий Берджи. В случае АСМ иммобилизация бактерий на подложку приводит к появлению третьего размеров – длина, высота и ширина [3].
Целью настоящего исследования явилось изучение структуры биопленок ризобактерий Cucurbita pepo L. методом атомно-силовой микроскопии.
Методы исследования
Объектом исследования являлись бактерии, выделенные из ризосферы тыквы обыкновенной. Штаммы ризобактерий культивировали на плотных питательных средах: МПА (ООО «БиоХолд, Россия) и Эндо (HiMedia Laboratories Pvt. Limited, Индия) при 370 С. Исследование образцов проводили методом атомно-силовой микроскопии в полуконтактном режиме с использованием сканирующего зондового микроскопа Solver P47-PRO (NT-MDT, Россия). Были использованы полуконтактные зонды с золотым напылением серии NSG10 (NT-MDT, Россия), размером 95х30 мкм, с жесткостью 17 Н/м, радиусом закругления иглы 10 нм, резонансной частотой 271 кГц. Для более детального изучения архитектоники ризобактерий применяли два метода АСМ: полуконтактный и метод рассогласования. Полуконтактный метод использовали для получения дву- и трехмерных топографических изображений бактерий и определяли линейные размеры клеток (длину и ширину).
Обработку изображений выполняли в программе Debug Nova 1.1.0.1. 847 (NT-MDT, Россия), которая дает возможность редактировать полученные данные, а также представлять их в дву- (2D) и трехмерном (3D) формате. Статистическую обработку данных осуществляли с помощью программы «Statistica 6.0».
Результаты и обсуждение
АСМ-изображения, полученные при сканировании в полуконтактном режиме, позволили установить топографию и линейные размеры изучаемых бактерий.
Достоинством полуконтактного метода сканирования образца является то, что большую часть периода колебаний кантилевер не касается его поверхности и, следовательно, не повреждает исследуемый объект.
Установлено, что изученные бактерии представляли собой клетки палочковидной формы с закругленными концами. Средние значения морфометрических параметров ризобактерий составили 2,39±0,07 нм (длина), 1,37±0,09 нм (ширина), 1,35±0,08 нм (высота).


Рис. 1. АСМ-изображения поверхности биопленки ризобактерий, полученные при сканировании в полуконтактном режиме
На рис. 1 а видно, что среди отдельно расположенных бактериальных клеток находится матрикс в виде однородного массивного скопления.
Использование метода модуляции силы позволило оценить адгезивную способность бактерий, входящих в состав биопленки. Сила адгезии бактерий была достоверно больше (р˂0,05), чем сила адгезии матрикса и составила 49,2±1,1нН. Сила адгезии матрикса была равна 18,3±0,6 нН (р<0,05).
Метод рассогласования применялся для выявления дополнительных особенностей биопленки микроорганизмов, в частности, для изучения ультраструктуры поверхности ризобактерий. Этот метод основан на регистрации амплитуды колебаний кантилевера при сканировании поверхности объекта.
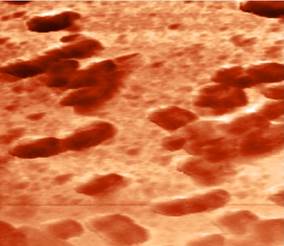
Рис. 2. АСМ- изображения поверхности биопленки ризобактерий, полученные при сканировании методом рассогласования
С помощью изображений, полученных методом рассогласования, было установлено, что изучаемые бактериальные клетки в момент исследования находились в процессе деления. Плотные скопления клеток, меньших по размеру, чем одиночные, указывают на завершение деления (рис. 2 а). На одной из клеток видно образование поперечной перетяжки (рис. 2 б).
В ходе исследования биопленок была проведена регистрация изменения амплитуды и сдвиг фазы колебаний кантилевера.
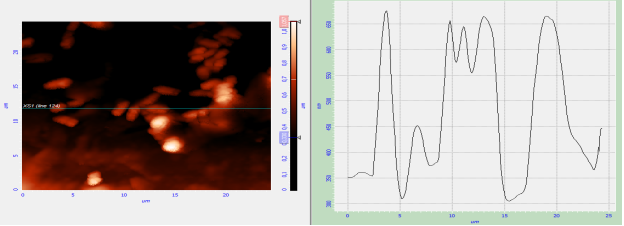
Рис. 3. Профиль фазового сдвига на выбранном участке изображения
Изменения фазы колебаний кантилевера связаны с взаимным расположением бактериальных клеток и матрикса, различиями в их линейных размерах и адгезивности. Из профиля фазового сдвига видно, что разница между высшей и низшей точками биопленки составляет 350 нм, что превышает высоту отдельной бактериальной клетки. Высота ризобактерий не превышала 1,35±0,08 нм, а выявленная толщина матрикса была равна 350 нм, следовательно, основным компонентом биопленки ризобактерий является матрикс.
Пространственные 3D-изображения биопленки позволили изучить поверхностные ультраструктуры с молекулярным разрешением в режиме реального времени и физиологических условиях (рис. 4).
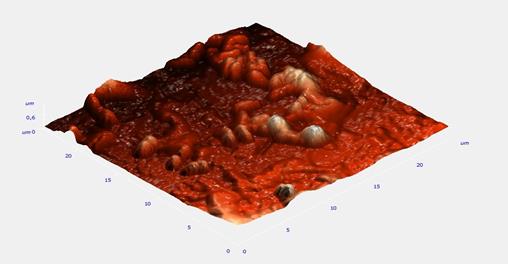
Рис. 4. Пространственное АСМ-изображение биопленки ризобактерий, полученное при площади сканирования 20 х 20 мкм2
Поверхность биопленки ризобактерий не является гладкой, матрикс имеет многочисленные неровности.
Таким образом, исследование биопленки методом атомно-силовой микроскопии позволило изучить ультраструктуру поверхности, морфометрические параметры бактерий и биопленки.
Выводы
1. Атомно-силовая микроскопия показала, что биопленка ризосферы Сucurbita pepo l. состоит из бактерий и матрикса. Толщина матрикса составляет 99% от общей толщины биопленки (350 нм).
2. Линейные размеры ризобактерий составили 2,39±0,07 нм в длину, 1,37±0,09 нм в ширину и 1,35±0,08 нм в высоту.
3. Адгезивная способность матрикса была достоверно меньше, чем адгезивная активность ризобактерий-18,3±0,6 нН и 49,2 ±1,1 нН соответственно (р<0,05) .
Рецензенты:
Золотухин В.В., д.б.н., профессор кафедры зоологии ФГБОУ ВПО «Ульяновский государственный педагогический университет им. И.Н. Ульянова», г. Ульяновск.
Артемьева Е.А., д.б.н., профессор кафедры зоологии ФГБОУ ВПО «Ульяновский государственный педагогический университет им. И.Н. Ульянова», г. Ульяновск.
Библиографическая ссылка
Артамонова М.Н., Пчелинцева Е.С., Костишко Б.Б., Потатуркина- Нестерова Н.И. СТРУКТУРА БИОПЛЕНКИ РИЗОСФЕРЫ CUCURBITA PEPO L. // Современные проблемы науки и образования. – 2014. – № 2. ;URL: https://science-education.ru/ru/article/view?id=12567 (дата обращения: 16.04.2024).



