Введение
Коклюш - острая бактериальная антропонозная инфекция дыхательных путей. Возбудителем болезни является грамотрицательная палочка Bordetella pertussis. Заболеваемость коклюшем в последний период времени, по данным эпидемиологических исследований, возрастает во всем мире, включая те страны, где уровень вакцинации достигает высоких показателей. Особо опасен коклюш, развивающийся у детей первых 6 месяцев жизни, которые либо не достигли вакцинального возраста, либо находятся в периоде вакцинации, и специфический иммунитет еще не успел сформироваться [2, 9, 17]. Источником инфекции для детей раннего возраста становятся подростки и взрослые [8, 10].
У детей раннего возраста, больных коклюшем, не только имеют место некоторые особенности течения болезни, но и наблюдается высокая частота развития угрожающих жизни состояний (остановка дыхания, коклюшная энцефалопатия), а также тяжелых осложнений - преимущественно заболеваний бронхолегочной системы [5, 16].
С целью демонстрации трудностей в диагностике и прогнозировании течения коклюша детей первого года жизни, приводим клинический случай данного заболевания у младенца с развитием комбинированного вторичного иммунодефицита и тяжелыми легочными осложнениями в условиях наслоения бактериальной инфекции.
Материалы и методы. Результаты клинического, патологоанатомического исследования ребенка, находившегося на лечении в отделении интенсивной терапии Львовской областной инфекционной клинической больницы (ЛОИКБ) с диагнозом «Коклюш, период спазматического кашля, тяжелая форма. Двухсторонняя бронхопневмония, правосторонний верхнедолевой ателектаз, спонтанный пневмоторакс слева. Гипоксически-токсическая энцефалопатия. Дыхательная недостаточность III ст. Сердечно-сосудистая недостаточность III ст.».
Результаты исследования и обсуждение. Девочка А., возрастом 1 месяц 4 дня, проживающая в одном из поселков Львовской области, в тяжелом состоянии госпитализирована в ЛОИКБ. Из анамнеза жизни известно, что ребенок родился от второй, нормально протекавшей беременности, путем кесарева сечения. Гестационный возраст новорожденного - 39 недель, масса при рождении - 3740 г , рост - 52 см. До начала болезни находилась на смешанном вскармливании (грудное молоко+адаптированная смесь «Малютка»). Ребенку не проводилась вакцинация противококлюшной вакциной, в связи с тем, что он не достиг соответствующего возраста.
Заболевание началось с сухого кашля. В 1-й день болезни ребенок осмотрен фельдшером, лечение не назначено. На 3-й день болезни, при повторном визите фельдшера, был назначен амброксола гидрохлорид. Несмотря на терапию отхаркивающим средством, кашель усиливался, приобрел приступообразный характер, на 8-й день болезни впервые наступил эпизод апноэ продолжительностью около 30 с. Родители обратились в Центральную районную больницу, и на следующий день ребенок реанимобилем был доставлен в Областную инфекционную клиническую больницу. По данным эпидемиологического анамнеза установлено, что у матери и у старшего ребенка (6-летнего возраста) в течение 3 недель наблюдался интенсивный навязчивый сухой кашель, более выраженный в ночное время суток.
Состояние при поступлении на стационарное лечение (9-й день болезни) оценивалось как очень тяжелое, тяжесть состояния обусловлена частыми (более 20-раз в сутки) приступами кашля спазматического характера с выделением слизистой мокроты, иногда завершавшиеся рвотой. Некоторые пароксизмы кашля сопровождались кратковременными апноэ продолжительностью 15-30 с. Сознание пациента было сохранено, ребенок был вялым, на осмотр врача - реагировал плачем. Температура тела находилась в пределах 36,6-37оС. Кожные покровы резко бледные, отмечалась мраморность конечностей, в области промежности и ягодиц - большие участки опрелостей. Выражена одутловатость лица, веки припухшие. Слизистые оболочки полости рта умеренно влажные, незначительная гиперемия небных дужек, задней стенки глотки. Периферические лимфатические узлы не были увеличены. Несмотря на применение оксигенотерапии (кислород в режиме свободного потока через маску) частота дыхания в покое составляла 54/мин., наблюдалась одышка смешанного характера, сатурация крови была в пределах 88-96 %. При аускультации над всей поверхностью легких на фоне жесткого дыхания выслушивались сухие хрипы. Тоны сердца чистые, звучные, ритмичные, ЧСС - 160-176 уд./мин. Постоянно отмечалась умеренная артериальная гипотензия - артериальное давление в среднем составляло 80/40 мм рт.ст. Живот был вздут, увеличен в объеме, при пальпации безболезненный. Печень выступала из-под реберной дуги на 3 см, эластичной консистенции, край ее заострен, поверхность гладкая. Селезенка выступала на 2 см из-под реберной дуги. Менингеальных симптомов не было выявлено. Стул 2 раза в сутки, желтого цвета кашицеобразной консистенции с примесью слизи и зелени. Диурез соответствовал количеству принятой жидкости.
Ребенок госпитализирован в отделение интенсивной терапии с диагнозом «Коклюш, период спазматического кашля. Тяжелая форма. Пневмония».
Диагноз подтвержден результатами серологических исследований: методом иммуноферментного анализа обнаружены антитела класса IgM к коклюшному токсину - 23,7 DU/мл, антитела класса IgG к коклюшному токсину - 17,24 DU/мл (результаты IgM, IgG считаются положительными при значениях превышающих 9 DU/мл). При бактериологическом исследовании слизи из ротоглотки (использовали среду казеиново-угольный агар, с добавлением крови) - бактерии Bordetella pertussis не были обнаружены.
В течение 1-го дня пребывания в больнице рентгенологически диагностировано двухстороннюю пневмонию. На 11-й день болезни у ребенка развился ателектаз верхней доли правого легкого (Рисунок 1), и пациент был переведен на искусственную вентиляцию легких аппаратом Leoni-2 (режим СРАР, PEEP 5 см вод.ст., FiO2 40-60 %). На 12-й день болезни у ребенка наступило ухудшение общего состояния: наросла тахикардия (178-210 уд./мин.), наблюдались снижение артериального давления до 60/40 - 80/40 мм рт.ст., повысилась температура тела до фебрильных значений. На 17-й день болезни у больного развился спонтанный левосторонний пневмоторакс (Рисунок 2).
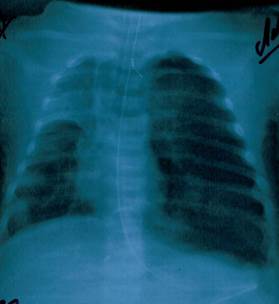
Рис. 1. Ателектаз легкого.
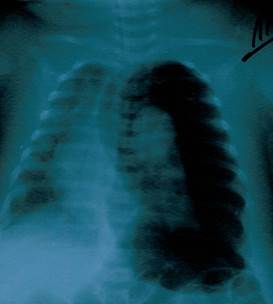
Рис. 2. Пневмоторакс.
При анализе гемограмм ребенка (табл.1) установлено анемию, характерный для коклюша лейкоцитоз с относительным и абсолютным лимфоцитозом. С ухудшением общего состояния ребенка (с 12-го дня болезни), отмечено нарастание количества нейтрофильных форм лейкоцитов и повышение СОЭ.
Таблица 1. Показатели гемограммы ребенка А. в динамике наблюдения.
|
Показатель |
День болезни |
|||
|
9 |
16 |
17 |
20 |
|
|
Гемоглобин, г/л |
125 |
100 |
92 |
100 |
|
Лейкоциты, (×109/л) |
31,7 |
18,3 |
29,2 |
17,8 |
|
Палочкоядерные, (%) |
12 |
16 |
20 |
13 |
|
Палочкоядерные, (×109/л) |
3,8 |
2,9 |
5,8 |
2,3 |
|
Сегментоядерные, (%) |
28 |
22 |
43 |
34 |
|
Сегментоядерные, (×109/л) |
8,9 |
4,0 |
12,6 |
6,1 |
|
Лимфоциты, (%) |
58 |
57 |
35 |
50 |
|
Лимфоциты, (×109/л) |
18,3 |
10,4 |
10,2 |
8,9 |
|
СОЭ, (мм/час) |
5 |
18 |
63 |
21 |
Еще несколько лет назад было установлено, что тяжесть течения коклюша у детей коррелирует с уровнем лейкоцитоза. Коклюшный токсин, кроме влияния на лимфоциты, приводит к повышению уровня и активации цАМФ, что способствует развитию легочной вазоконструкции. Лимфоцитарные агрегаты, в свою очередь, создают механическую обструкцию в малом кругу кровообращения. Таким образом, создаются условия для развития легочной гипертензии [15].
При исследовании некоторых показателей клеточного и гуморального иммунитета, отмечено повышение абсолютного количества В-лимфоцитов (CD22+) в 5,9 раза по сравнению с нормой. Анализ иммунограммы активизационных маркеров лимфоцитов выявил повышение уровней ранних маркеров активации (СD71+, CD25+), что является признаком общего вариабельного иммунодефицита, [4] хотя, по данным литературы, коклюшный токсин обычно снижает активность CD25+-клеток [11]. А также установлено повышение поздних маркеров активации CD HLA-DR+ и относительное - CD95+ (несущие рецептор активации апоптоза) (табл. 2).
Таблица 2. Результаты иммунологического обследования (лимфограмма) ребенка А.
|
Вид обследования |
Результат |
Норма |
||
|
% |
Абс. число, г/л |
% |
Абс. число, г/л |
|
|
Лейкоциты |
- |
32,6 |
- |
5,5-18 |
|
Лимфоциты |
57 % |
18,58 |
39,0-59,0 |
2,7-5,4 |
|
CD16+ -лимфоциты |
27 % |
5,02 |
8,0-17,0 |
0,3-0,7 |
|
CD22+ -лимфоциты |
32 % |
5,95 |
19,0-31,0 |
0,7-1,3 |
|
CD3+ -лимфоциты |
59 % |
10,96 |
60,0-85,0 |
2,3-7,0 |
|
CD4+ -лимфоциты |
31 % |
5,76 |
38,0-50,0 |
1,7-2,8 |
|
CD8+ -лимфоциты |
26 % |
4,83 |
18,0-25,0 |
0,8-1,2 |
|
CD4+/CD8+ |
|
1,19 |
|
1,5-2,9 |
|
CD71+ -лимфоциты |
21 % |
3,90 |
1-1,8 |
0,06-0,54 |
|
CD25+ -лимфоциты |
28 % |
5,20 |
7-12 |
0,08-0,72 |
|
CD HLA-DR+ -лимфоциты |
24 % |
4,46 |
4-9 |
0,07-0,72 |
|
CD95+ -лимфоциты |
26 % |
4,83 |
1-23 |
0,08-1,15 |
Результаты исследования крови ребенка свидетельствуют об относительном и абсолютном Т- и В- лимфоцитозе, что подтверждается и данными литературы. Уровни субпопуляций Т-лимфоцитов (CD3+, CD4+, CD8+) остаются высокими в течение всего острого периода болезни, однако функциональная их способность нарушена [6]. Также наблюдалось снижение индекса иммунорегуляции, что свидетельствует о превалировании супрессорных форм лимфоцитов. Имеются литературные данные о том, что у большинства детей первого года жизни во время болезни не происходит изменений в соотношении Т-хелперы/специфические Т-киллеры [1]. Кроме того, следует учитывать, что уровень Т-хелперов у младенцев значительно ниже, чем у детей старшего возраста и взрослых [14].
По данным литературы, у детей первого года жизни, у которых течение коклюша осложняется пневмонией на 1-2 неделе периода спазматического кашля, как и в данном случае, отмечается повышение среднего уровня IFN γ [13]. Такая особенность объясняется большей чувствительностью клеток, которые продуцируют данный цитокин, и повышенной проницаемостью сосудов (улучшает процесс попадания цитокина в кровь) у детей младшего возраста [6]. Кроме того, дендритные клетки детей возрастом 2 месяцев, которые были инфицированы B.pertussis (или привиты полноклеточной противококлюшной вакциной), могут продуцировать IFN-γ в количествах, которые соответствуют уровням взрослого человека, и обеспечить полноценный иммунный ответ по Th1-типу [14]. Тяжесть течения болезни коррелирует с показателями интерлейкина-1β - при тяжелом течении коклюша он выделяется в большем количестве. Так, у детей первого года жизни, при осложненном течении коклюша, уровень IL1β увеличивается в среднем в 1,5 раза по сравнению с неосложненным течением (а у детей старше 5 лет - в 5 раз) [6]. У больной А. уровень IL1β превышает норму в 2,3 раза.
Показатели IL2 у детей первого года жизни, у которых течение коклюша осложнено пневмонией, могут вызывать превышение нормальных показателей в 50 раз [6]. У ребенка А. выявлено превышение уровня этого цитокина в 1,9 раза.
Уровень IL10 у пациента находился на верхней границе нормы, а, по данным других исследований [13] у больных коклюшем детей, не зависимо от периода болезни, выявляют уровни IL10, которые стабильно ниже, чем у здоровых. Будучи продуктом Th2-лимфоцитов, IL10 способен уменьшать выделение IFNγ и обладает противовоспалительным эффектом, а следовательно, способствует более быстрому выздоровлению. В случае коклюша таких процессов не происходит, и воспалительный процесс в бронхах длится более 3 мес., что способствует развитию пневмонии, свидетельствует о незавершенности инфекционного воспаления, и, очевидно, способствует длительному клиническому течению болезни [6, 13] (табл. 3).
Таблица 3. Результаты иммунологического обследования ребенка А.
|
Показатель |
Результат |
Норма |
|
Интерферон γ, (пг/мл) |
9,8 |
0-10 |
|
IL-1β, (пг/мл) |
10,1 |
3,9-4,9 |
|
IL-2, (пг/мл) |
19,2 |
6,5-12,0 |
|
IL-10, (пг/мл) |
31,3 |
1,35-31,0 |
С 1-го дня стационарного лечения этиотропная терапия проводилась двумя антибиотиками - макролидом и цефалоспорином III поколения (азитромицин – 10 мг/кг/сут., цефтриаксон – 80 мг/кг/сут.) в течение 5 ней. С 6-го дня болезни, в связи с развитием осложнений, антибиотикотерапия была изменена: использован β-лактамный карбапенем (меропенем - 20 мг/кг/сут.), в течение 4 дней, и антибиотик ряда гликопептидов (ванкомицина гидрохлорид - 10 мг/кг/сут.) до завершения лечения.
Для подавления кашлевого рефлекса и предупреждения апноэ ребенок получал литическую смесь (из расчета по аминазину - 1 мг/кг/сут.), бутамирата цитрат (3,4 мг/сут.), а после переведения ребенка на ИВЛ – пипекурония бромид (0,05 мг/кг). А также отхаркивающее средство (амброксола гидрохлорид – 0,9 мл/сут.), эуфиллин – 6 мг/сут., инфузийная терапия (60 мг/кг/сут.), пробиотик, антикоагулянт прямого действия (500 ЕД). Торакальным хирургом было проведено дренирование левой плевральной полости. Ребенок консультирован пульмонологом, невропатологом.
Несмотря на проводимое лечение, состояние ребенка прогрессивно ухудшалось, усиливались явления дыхательной и сердечной недостаточности. На 20 день болезни у ребенка наступила клиническая смерть.
Результаты патологоанатомического исследования подтвердили клинический диагноз. При аутопсии и гистологическом исследовании некроптатов было установлено двустороннюю крупноочаговую сливную бронхопневмонию. Характер интраальвеолярного экссудата был фибринозным (с различным соотношением фибрина и клеточных элементов) или гнойным. Гнойное воспаление сопровождалось образованием абсцессов, а в отдельных очагах - распространением воспаления на соединительно-тканные септы - что расценено как секвестрирующая пневмония (рис. 3).
Особенностью поражения легких в данном случае было сочетание воспаления с участками некроза легочной ткани с колониями микробов, чаще без клеточной реакции, реже с нагноением по периферии. Альтеративные изменения паренхимы сопровождались некротическим бронхитом и бронхиолитом. Их морфологические особенности соответствуют поражениям, обусловленным грам-отрицательной бактериальной флорой, выделенной посмертно из легочной ткани – Enterobacter aerogenes.
Воспалительные и альтеративные изменения в легких обнаруживались на фоне циркуляторных нарушений. Причиной расстройств кровообращения был острый тромбофлебит внутриорганных вен с периваскулярным воспалением и тромбоартериит с обширными геморрагическими инфарктами. Нарушения лимфообращения сопровождались дилатацией лимфатических сосудов с агрегацией в их просвете лимфоцитов, макрофагов и тканевого детрита.
Наличие фокальной эмфиземы можно рассматривать и как результат изменений в бронхах, и как компенсаторную реакцию в условиях столь массивного повреждения легких (рис.3).
Пневмонию определяют как одно из самых частых осложнений при коклюше. Этиология их разнообразна: они могут быть вызваны как активацией эндогенной флоры, так и внутрибольничной инфекцией на фоне коклюшной анергии. По мнению исследователей, морфологические изменения в тканях легких позволяют сделать вывод о том, что причиной пневмоний, в большом количестве случаев становятся энтеробактерии. В данном наблюдении, при бактериологическом исследовании посева гнойного экссудата, из ткани легких выделена бактерия Enterobacter aerogenes.
При гистологическом исследовании тимуса обнаружены коллапс долек, отсутствие в них деления на корковый и мозговой слои за счет их делимфатизации, наличие кистозно измененных тимических телец, содержащих детрит и мелкие петрификаты (рис. 4). Морфологическая картина соответствует акцидентальной инволюции тимуса IV cт., что клинически соответствует иммунодепрессивному состоянию у ребенка. Этот факт подтверждается прижизненными изменениями иммунограммы, тяжелым течением основного заболевания с развитием осложнений, связанных с присоединением условно-патогенной флоры.
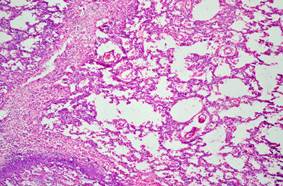
Рис. 3. Микропрепарат легкого. ×125
Секвестрирующая пневмония. Фокальная эмфизема.
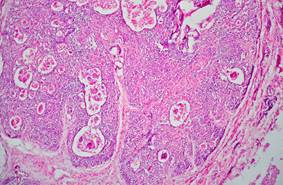
Рис. 4. Микропрепарат тимуса. ×125
Акцидентальная инволюция тимуса IV cт.
Результаты патологоанатомического исследования тимуса совпадают с литературными данными: акцидентальную инволюцию тимуса IV-V степени выявляют практически у всех детей первого года жизни, у которых коклюш завершился летально. Отсутствие кортикального слоя тимуса свидетельствует о тяжелом иммунодепрессивном состоянии у детей грудного возраста [3, 7].
Выводы. В данном случае мы представили течение коклюша с развитием тяжелых легочных осложнений, которые обусловлены сочетанием нескольких факторов: формированием комбинированного вторичного иммунодефицита и наслоением бактерийной инфекции, присоединившейся вследствие длительного применения ИВЛ.
Можно предполагать, что своевременная диагностика, адекватная антибактериальная терапия с первых дней заболевания, могли улучшить прогноз течения болезни у ребенка. Однако, как свидетельствуют данные отечественной и зарубежной литературы, смертность среди детей раннего возраста, больных коклюшем, остается на высоком уровне, представляя собой актуальную проблему современной детской инфектологии. Коклюш у детей первых месяцев жизни требует дальнейшего изучения, разработки новых, более эффективных способов профилактики и лечения болезни.
Рецензенты:
Добрянский Д.А., д.м.н., профессор кафедры факультетской и госпитальной педиатрии Львовского национального медицинского университета им. Д.Галицкого, г.Львов.
Зинчук А.Н., д.м.н., профессор, заведующий кафедры инфекционных болезней Львовского национального медицинского университета, г.Львов.
Библиографическая ссылка
Надрага А.Б., Томашова С.А., Дыбас И.В. ОСЛОЖНЕННОЕ ТЕЧЕНИЕ КОКЛЮША У МЛАДЕНЦЕВ (КЛИНИКО-ПАТОЛОГОАНАТОМИЧЕСКОЕ ИССЛЕДОВАНИЕ) // Современные проблемы науки и образования. – 2014. – № 3. ;URL: https://science-education.ru/ru/article/view?id=13169 (дата обращения: 24.04.2024).



