Рак молочной железы (РМЖ) занимает первое место в структуре заболеваемости и смертности от злокачественных новообразований у женщин во всём мире. В России в 2011 г. число впервые выявленных случаев РМЖ достигло 57 534, умерло от данного заболевания 23 320 женщин. При этом отмечается неуклонный прирост заболеваемости. За период с 2003 года по 2013 год он составил около 27% [7]. В связи с чем не теряет своей актуальности поиск новых методов лечения данной онкологической патологии.
Патоморфоз опухолей под действием неоадъювантной полихимиотерапии (ПХТ) является одним из показателей доказательности ее адекватности. Оценка патоморфоза опухолей в зарубежной литературе проводится по различным критериям, которые необходимо учитывать [8]. Этому вопросу на протяжении многих лет были посвящены наши исследования. В основу последних были положены критерии Г.А. Лавниковой, которые нами были дополнены. Для повышения эффективности химиотерапии больных РМЖ использовались методы введения химиопрепаратов на естественных средах организма (крови, лимфе, костном мозге), что достоверно улучшало результаты лечения [1; 3]. Под действием неоадъювантной химиотерапии на естественных средах и в различных модификациях в раковых опухолях был отмечен общий стереотипный комплекс морфологических изменений в виде дистрофических и некробиотических процессов, нарушения апоптоза и митотической активности клеток, усиления воспалительных и иммунологических реакций с развитием в итоге различной степени фиброза и уменьшением площади паренхиматозного компонента опухоли [7]. В последние годы все большее внимание начинают привлекать к себе методы иммунотерапевтического воздействия на опухолевые заболевания. Если в основу химиотерапии изначально заложено токсическое воздействие на здоровые и малигнизированные клетки, то иммунотерапия осуществляет эффект посредством активации собственных механизмов защиты организма [4]. Сочетание химиотерапии с иммунотропными веществами может значительно снижать токсический и иммуносупрессивный эффект цитостатиков [2]. К числу иммунокорригирующих препаратов относится рекомбинантный ФНО-Т, который представляет собой уникальное соединение – гибридную молекулу двух биологически активных агентов – цитокина фактора некроза опухолей и гормона тимозина. Препарат обладает прямым противоопухолевым действием in vitro и in vivo на различных линиях опухолевых клеток. По спектру цитотоксического и цитостатического действия на опухолевые клетки препарат соответствует фактору некроза опухоли-альфа (ФНО) человека, однако рекомбинантный ФНО-Т имеет в 100 раз меньшую общую токсичность, чем ФНО, обладает способностью угнетать ангиогенез в противоположность ФНО, сохраняя при этом способность повышать проницаемость эндотелия сосудов, запускать процесс апоптоза опухолевых клеток, активировать каскад химических реакций коагуляционной системы крови [8] (рис. 1) [6].
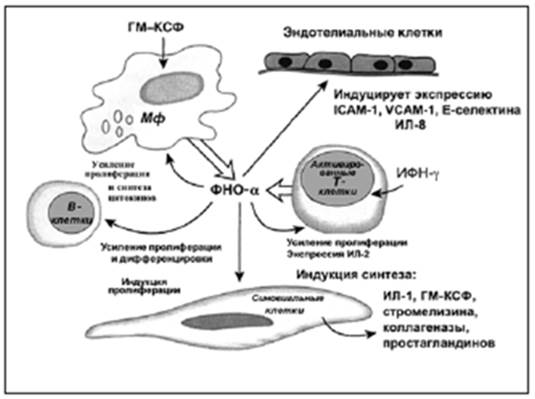
Рис. 1. Схема биологических эффектов воздействия ФНО-α на различные клетки.
Благодаря входящему в состав ФНО-Т тимозину-α1 рекомбинантный ФНО-Т способен оказывать воздействие на Т–клеточное звено иммунной системы, которое играет ключевую роль в противоопухолевом иммунитете, а также участвует в реакциях гуморального иммунитета [5]. По данным литературы, после инъекции рекомбинантного ФНО-Т в течение суток вокруг опухоли развивается местная воспалительная реакция, которая внешне проявляется в виде очага гиперемии, слегка болезненного, без инфильтрации в месте введения препарата, благодаря чему непосредственно рядом с опухолью увеличивается интенсивность кровотока и облегчается доставка вводимых системно химиопрепаратов к опухолевому очагу [2; 8]. Помимо этого, под воздействием рекомбинантного α-фактора некроза опухолей тимозин-α1 происходит активация как общего, так и местного иммунитета (прежде всего активируются макрофаги, цитотоксичность которых оказалась тесно связана с наличием молекул фактора некроза опухолей на их поверхности, а процесс созревания/активации этих клеток связан с ответом на рекомбинантный ФНО-Т) [8].
Цель. Целью настоящего исследования явилось изучение влияния рекомбинантного ФНО-Т, введенного перитуморально, на эффективность химиотерапии при местно-распространенном РМЖ, частоту и выраженность побочных явлений, в частности лейкопении, анемии, тромбоцитопении и др., а также оценка морфологических изменений в опухоли и перитуморальной ткани и определение зависимости эффективности лечения больных от их гормонального статуса (RE и RP +/-) и Her2/neu-статуса.
Материалы и методы. Исследование проводилось на базе отделения химиотерапии № 1 ФГБУ «РНИОИ» МЗ РФ. Основными критериями включения больных РМЖ IIB-IIIB стадии были: ECOG≤1, нормальные показатели общеклинических исследований, отсутствие отдаленных метастазов. За период с апреля 2012 года по октябрь 2013 года в исследование было включено 82 больных местно-распространенным РМЖ IIB-IIIB стадии, в возрасте от 29 до 69 лет; средний возраст 53,3±1,1 года. В отличие от стандартного подкожного метода введения рекомбинантного ФНО-Т нами было предложено вводить рекомбинантный ФНО-Т перитуморально, поскольку, проанализировав механизмы действия препарата, мы предполагали получить более выраженный эффект, максимально воздействуя непосредственно на зону опухоли и перитуморальной ткани, местный иммунитет. Непосредственно перед употреблением в 2 флакона (по 100 000 МЕ) добавляли по 1 мл воды для инъекций. После разведения препарат вводился перитуморально. В основную группу вошли 30 пациенток, которым проводилась системная неоадъювантная ПХТ в режиме FAC (5-фторурацил 500 мг/м2 + доксорубицин 50 мг/м2 + циклофосфан 500 мг/м2; интервал между курсами 21 день) или в режиме РА (паклитаксел 175 мг/м2 + доксорубицин 50 мг/м2; интервал между курсами 21 день) в комбинации с перитуморальным введением рекомбинантного ФНО-Т по 200000 МЕ в 1-е сутки (за 30 минут до введения цитостатиков) и далее 1 раз в день во 2–5-е сутки каждого курса ПХТ. В контрольной группе наблюдались 52 пациентки, которым проводилась стандартная неоадъювантная ПХТ в тех же режимах, но без рекомбинантного ФНО-Т. Основная и контрольная группы больных по стадиям заболевания и по характеристикам менструальной функции были сопоставимы (табл. 1).
Таблица 1
Клиническая характеристика больных основной и контрольной групп
|
Группы больных |
Стадия |
Менструальная функция |
|||||
|
IIB |
IIIA |
IIIВ |
Сохранена |
Менопауза (годы) |
|||
|
1-5 |
5-10 |
>10 |
|||||
|
Основная (кол-во, %) |
5 16,7% |
11 36,7% |
14 46,6% |
13 43,3% |
7 23,3% |
5 16,7% |
5 16,7% |
|
Контрольная (кол-во, %) |
10 19,2% |
15 28,8% |
27 51,9% |
20 38,5% |
7 13,5% |
18 34,6% |
7 13,4% |
По данным иммуногистохимического исследования больные основной и контрольной групп тоже были сопоставимы (табл. 2).
Таблица 2
Иммуногистохимическая характеристика опухолей больных основной и контрольной групп
|
Группы больных |
Люминальный А |
Люминальный В (HER-2-) |
Люминальный В (HER-2+) |
СErb-B2-сверхэкспрессирующий |
Базально-подобный |
|
Основная (кол-во, %) |
4 13,3% |
12 40% |
4 13,3% |
8 26,7% |
2 6,7% |
|
Контроль-ная (кол-во, %) |
5 9,6% |
22 42,3% |
8 15,4% |
12 23,1% |
5 9,6% |
В основной группе было проведено от 2 до 4 курсов ПХТ каждой пациентке. В группе контроля было проведено от 2 до 6 курсов каждой больной.
Результаты. Нами было выявлено, что объективный противоопухолевый эффект чаще наблюдался в основной группе больных, чем в контрольной (80% и 71,1% соответственно; p≤0,05), в том числе за счет увеличения частоты полной регрессии в 2,2 раза: 16,6% против 7,7%. Стабилизация была достигнута у 20% больных в группе с применением рекомбинантного ФНО-Т и у 23,1% пациентов в группе со стандартной ПХТ без рекомбинантного ФНО-Т. Прогрессирование заболевания (появление отдаленных метастазов в кости) на этапе неоадъювантной терапии было выявлено у 5,8% больных группы контроля, двум из них в связи с этим хирургический этап лечения выполнить не удалось. Прогрессирования среди больных основной группы зарегистрировано не было (рис. 2).
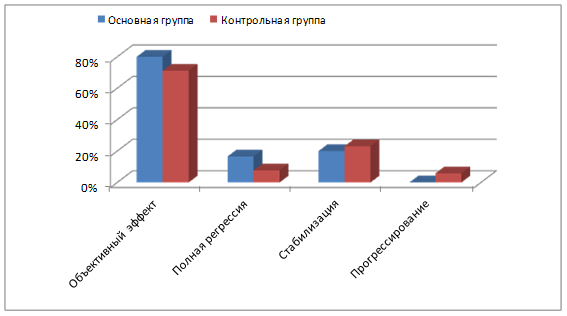
Рис. 2. Характеристика клинического эффекта неоадъювантного лечения у больных основной и контрольной групп.
В основной и контрольной группе больных наблюдались побочные эффекты низкой и средней степени выраженности (рис. 3).
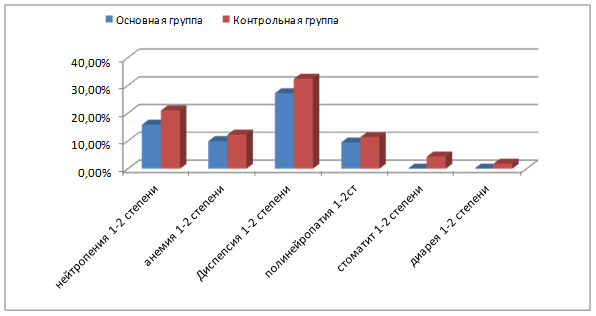
Рис. 3. Характеристика побочных реакций неоадъювантного лечения у больных основной и контрольной групп.
Выявлены специфические для рекомбинантного ФНО-Т побочные явления: у всех больных основной группы отмечалась реакция на его введение в виде очага гиперемии 0-1 степени слегка болезненного, без инфильтрации в месте введения препарата; а также у 4 (16%) пациенток отмечалось повышение температуры тела от 37,2 до 37,8 °С через 6-12 часов после введения рекомбинантного ФНО-Т со снижением до нормальной температуры в течение 24 часов без применения жаропонижающих средств. Местная реакция возникала, как правило, через 6-12 часов после введения препарата, а продолжительность ее варьировала от 24 часов (на 1-2 курсе ПХТ) до 48 часов (при последующих курсах ПХТ). По интенсивности данные нежелательные явления расценивались как слабые, т.е. не нарушали повседневной активности больных, легко переносились. При оценке рецепторного статуса больных с генерализацией заболевания на этапах лечения отмечалось преобладание тройного негативного типа рака молочной железы: у 4 из 5 больных (80%) основной группы и у 10 из 15 больных (66,7%) контрольной группы, что соответствует международным данным. Морфологическое исследование опухолевой ткани и перитуморальной зоны основной группы показало, что в опухоли под действием рекомбинантного ФНО-Т были выявлены следующие изменения. Отмечали выраженный фиброз стромального компонента опухоли, дистрофические, апоптотические и некробиотические процессы в раковых клетках; миксоматоз стромы; встречали мелкие очаги некроза; по периферии опухоли иногда можно было видеть нерезко выраженную лимфоцитарную инфильтрацию (рис. 4).
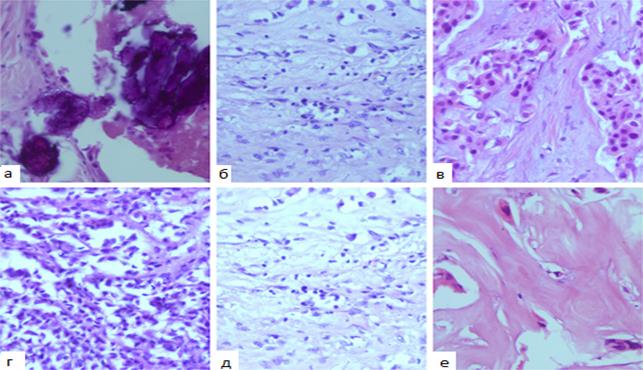
Рис. 4. Морфологические изменения в опухоли после применения рекомбинантного ФНО-Т: а) обширные поля петрификатов на фоне фиброзной ткани; б, д) очаговая лимфоплазмоцитарная инфильтрация; в, г) дистрофические изменения раковых клеток; е) одиночные раковые клетки в фиброзной строме (окраска гематоксилином и эозином; увеличение х400).
В основной группе отмечалось статистически достоверное увеличение числа лечебного патоморфоза III-IV степени по сравнению с контрольной группой: 10 (33,2%) и 9 (17,34%) случаев соответственно (p≤0,05) (рис. 5).
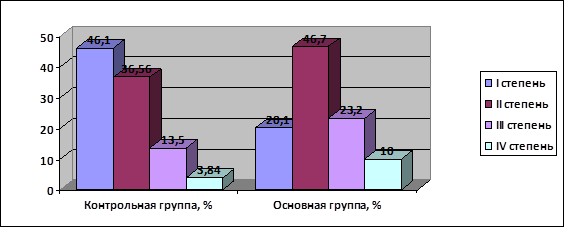
Рис. 5. Степени терапевтического патоморфоза опухоли после курсов НАХТ в основной и контрольной группах больных.
Все пациентки основной группы были прооперированы, никаких послеоперационных осложнений, связанных с использованием рекомбинантного ФНО-Т, не наблюдалось. В настоящее время общая выживаемость больных в основной группе составила 28,4±1,1 мес., в группе контроля – 26,1±1,4 мес.; бессобытийная выживаемость в группе с применением рекомбинантного ФНО-Т – 26,9±1,3 мес., в группе сравнения – 22,9±1,2 мес.
Заключение. Таким образом, проведенное исследование показало, что перитуморальное применение рекомбинантного ФНО-Т обладает хорошей переносимостью. Оно позволяет увеличить эффективность терапии больных местно-распространенным РМЖ, снизить частоту и степень выраженности системных побочных реакций, сократить сроки предоперационной терапии, достигнуть увеличения числа лечебного патоморфоза III-IV степени.
Рецензенты:
Шихлярова А.И., д.б.н., профессор, главный научный сотрудник Южного научного центра РАН, г. Ростов-на-Дону;
Франциянц Е.М., д.м.н., профессор, руководитель лаборатории изучения патогенеза злокачественных опухолей ФГБУ «РНИОИ» МЗ РФ, г. Ростов-на-Дону.
Библиографическая ссылка
Владимирова Л.Ю., Непомнящая Е.М., Подзорова Н.А., Мягкова В.С., Рядинская Л.А. НЕКОТОРЫЕ КЛИНИКО-МОРФОЛОГИЧЕСКИЕ АСПЕКТЫ ПЕРИТУМОРАЛЬНОГО ПРИМЕНЕНИЯ РЕКОМБИНАНТНОГО ФАКТОРА НЕКРОЗА ОПУХОЛИ-ТИМОЗИН-α1 ПРИ МЕСТНО-РАСПРОСТРАНЕННОМ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ // Современные проблемы науки и образования. – 2015. – № 2-1. ;URL: https://science-education.ru/ru/article/view?id=17382 (дата обращения: 19.04.2024).



