Выяснение границ адаптивных возможностей различных функциональных систем организма является одной из актуальных проблем современной экспериментальной и теоретической биологии. Известно, например, что при снижении температуры тела гомойотермного животного разные в отношении филогенетического возраста структуры мозга отключаются при различных температурах [6]. Древние в филогенетическом отношении структуры обычно более устойчивы к чрезвычайным воздействиям. Эволюционные преобразования происходят таким образом, что новые приобретения сочетаются с сохранением ранних механизмов. Это означает, что филогенетически молодые структуры должны содержать в латентной форме древние механизмы адаптации. И значит, при определенных условиях (например, при гипотермии) эти древние механизмы могут включаться и в филогенетически молодые структуры. Гипотермические состояния используются в качестве нейропротекторного средства при различных гипоксических патологиях [7]. Механизмы нейропротекторного действия гипотермии не вполне ясны. В последнее время особое внимание практиков привлекает поверхностная гипотермия, при которой температура тела понижается всего на несколько градусов [8]. Несмотря на столь незначительное снижение температуры тела, потребление кислорода мозгом снижается существенно [4].
В настоящей работе предпринята попытка путем экспериментального вмешательства вызвать активацию адаптивных механизмов в мозге млекопитающих (крыс). Нами исследована электрическая активность мозга крыс при изменении температуры тела на фоне введения в организм разобщителя окислительного фосфорилирования 2,4-динитрофенола (создает дефицит АТФ в клетках), а также диметилформамида (аналога адаптогена-мочевины).
У интактных животных спонтанная электрическая активность мозга (ЭЭГ) прекращается полностью при температуре тела 18–20°С [1]. При этом сердце еще бьется и кровообращение, видимо, на каком-то уровне сохраняется. Однако дыхание становится очень редким – примерно одно дыхательное движение в минуту против 80 дыхательных движений при 37°С. Возможно, что прекращение генерации биопотенциалов нейронами мозга происходит вследствие недостаточного снабжения мозга кислородом из-за резкого подавления дыхания при низких температурах тела. Другой причиной прекращения электрической активности мозга может быть прямое действие (подавление) низких температур на активный транспорт ионов в нейронах, в результате чего ионные насосы оказываются неспособными противостоять пассивной утечке ионов. В результате ионные градиенты могут выровняться, и генерация биопотенциалов станет невозможной.
Первое предположение можно было бы проверить, переводя животное на искусственное дыхание при низких температурах тела. Второе предположение может быть проверено с помощью веществ, создающих дефицит АТФ (топливо для ионных насосов) в клетках. В настоящей работе был использован 2,4-динитрофенол – классический разобщитель окислительного фосфорилирования.
Степень разобщающего эффекта ДНФ (ксенобиотика анионного типа) в изолированных митохондриях зависит от соотношения в среде его ионизированной и неионизированной форм [3]. Как известно, снижение потенциала на мембранах митохондрий разобщителем окислительного фосфолирования ДНФ при концентрациях в среде не выше 0,1 мМ обусловлено увеличением протонной проницаемости митохондриальных мембран [3]. Длительное применение ксенобиотика сопровождается усилением митохондриального дыхания, уменьшением скорости формирования активных форм кислорода в микросомальной редокс-цепи, снижением уровня гидропероксидов липидов и карбонильных соединений в сыворотке крови и микросомах печени, а также увеличением их средней продолжительности жизни [5].
Методика исследования
Животные. Опыты проведены на 12 крысах-самцах линии «Вистар» весом 180–200 г, содержащихся на обычном рационе в условиях вивария.
Наркоз. Все опыты проведены на животных наркотизированных тиопенталом в дозе 40 мг на 1 кг веса тела.
Гипотермия. Снижение температуры тела осуществляли с помощью полиэтиленовых мешков, наполненных битым льдом. Наркотизированное животное помещали на мешки со льдом и периодически измеряли температуру тела в прямой кишке ртутным термометром. Время охлаждение составляло около 1,5 ч, а время согревания до нормотермии — около 1 ч. Электроды. ЭЭГ регистрировали с помощью нихромовых электродов диаметром 0,3 мм. Электроды имплантировали в соматосенсорную кору в область (примерные координаты (АР + 1, D2) и (AP + D3), у поверхности коры. Заземляющий электрод вживляли в носовую кость. 2,4 –ДНФ и диметилформамид вводили внутрибрюшинно в дозе 20 мг и 3мМ на 100 г веса тела.
Регистрация ЭЭГ. Регистрация ЭЭГ осуществлялась с помощью четырехканального усилителя биопотенциалов, собранного в лаборатории биофизики биологического факультета ДГУ. Сигнал с выхода усилителя подавался на аналого-цифровой преобразователь (АЦП) ЛА-И24USB фирмы «Руднев—Шиляев». С АЦП сигнал подавался на компьютер и записывался на жестком диске. Частота оцифровки составляла 800 Гц. Длина записи 33 с (около 20 000 точек). Регистрацию производили по мере снижения температуры тела через каждые 2оС. После достижения критической температуры тела, когда ЭЭГ становилась изоэлектрической, охлаждение прекращали и начинали согревание. Для этого под тело животного подкладывали грелку с теплой водой. ЭЭГ регистрировали по мере повышения температуры тела через каждые 2оС.
Анализ ЭЭГ. После конвертирования данные обрабатывали в программе STATISTIKA методами статистического анализа временных рядов. Строили графики самой ЭЭГ (2,5-секундные (2000 точек), отрезки ЭЭГ. Спектральная плотность выражалась в процентах от общей мощности в диапазоне частот от 0 до 15 Гц, принятой за 100%.
Результаты исследования
На рисунке 1 приведены электроэнцефалограммы мозга крыс при различных температурах тела в цикле «охлаждение – согревание» с введением 2,4-ДНФ. Видно, что по мере снижения температуры тела ЭЭГ закономерно изменяются – частота колебаний и их амплитуда постепенно уменьшаются, и, наконец, при температуре тела около 17–18°С ЭЭГ становится практически изоэлектрической (плоской). При согревании животного после глубокой гипотермии изменения ЭЭГ претерпевают обратные изменения, но с некоторым гистерезисом.
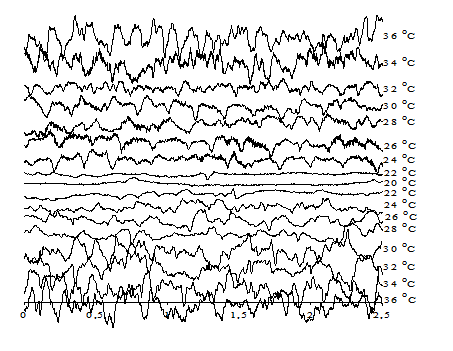
Рис. 1. ЭЭГ крысы при охлаждении и последующем согревании при введении 2,4-ДНФ в дозе 20 мг/100 г живого веса тела
Введение разобщителя в организм животного перед охлаждением повышает температуру тела, при которой исчезает электрическая активность мозга. В среднем эта температура для ЭЭГ составляет 20,5±0,3°С. При этом ПО исчезает при 18,4±0,2°С. Это значит, при температуре 21,5°С в нейронах мозга еще сохраняются градиенты ионов, достаточные для генерации потенциалов действия. Однако для этого нужен мощный наружный стимул. Ниже 18,4°С градиенты, видимо, исчезают, так как прямое раздражение коры уже не генерирует ответ. Эти результаты указывают на то, что дефицит энергии АТФ существенно влияет на температуру, при которой исчезает функциональная активность клеток мозга.
Ранее нами было показано, что мочевина и некоторые ее аналоги снижают критическую температуру при внутрибрюшном введении [1] крысам.
Введение диметилформамида в организм животного перед охлаждением приводит к заметному снижению критической температуры, при которой прекращается электрическая активность мозга. ЭЭГ исчезает при введении диметилформамида при 15°С, ПО исчезает при 12°С (рис. 2).
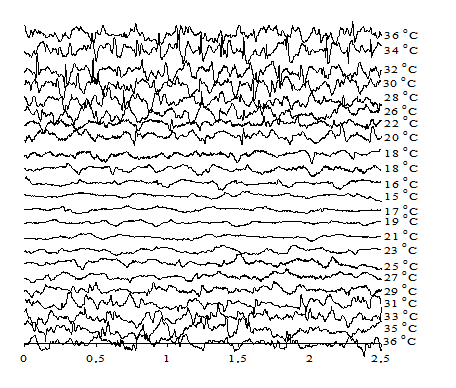
Рис. 2. ЭЭГ крысы при охлаждении и последующем согревании при введении диметилформамида в дозе 3 мМ/100 г живого веса тела
Этот результат указывает на то, что диметилформамид либо каким-то способом активирует процессы генерации АТФ в нейронах мозга, либо снижает пассивную проницаемость плазматической мембраны нейронов для потенциалопределяющих ионов (в первую очередь для ионов натрия). Для формулирования рабочей гипотезы в данном случае не хватает экспериментальных данных о возможном влиянии диметилформамида на ферментативные процессы в нейронах или на пассивную проницаемость биомембран.
Другое объяснение влияние диметилформамида на критическую температуру в мозге крыс может состоять в том, что диметилформамид влияет на осмотические процессы в мозге при низкой температуре ткани. Известно, что при глубокой гипотермии может развиваться отек мозга, что подавляет электрическую активность нейронов [2]. Вещества, нормализующее осмотическое давление в клетках мозга, могут, видимо, оказывать влияние на предельно низкие температуры, при которых функционирование нейронов прекращается. Для проверки этих гипотез необходимы дальнейшие исследования.
Таким образом, нами получены результаты, указывающие на возможность снижать температуру «биологического нуля» посредством введения в организм диметилформамида. Выяснение биофизических механизмов этого эффекта расширит наши представления о механизмах адаптаций животных к экстремальным условиям.
Рецензенты:
Габибов М.М., д.б.н., профессор, зав. каф. анатомии, физиологии, гистологии ДГУ, ГОУ ВПО «Дагестанский государственный университет», г. Махачкала;
Омаров К.З., д.б.н., Федеральное государственное бюджетное учреждение науки «Прикаспийский институт биологических ресурсов Дагестанского научного центра Российской академии наук», г. Махачкала.
Библиографическая ссылка
Пиняскина Е.В., Абдурахманов Р.Г., Пиняскина Е.В. ВЛИЯНИЯ 2,4-ДИНИТРОФЕНОЛА И ДИМЕТИЛФОРМАМИДА НА ЭЭГ КРЫС ПРИ ГИПОТЕРМИИ // Современные проблемы науки и образования. – 2015. – № 5. ;URL: https://science-education.ru/ru/article/view?id=21696 (дата обращения: 18.04.2024).



