Меланома кожи является одной из наиболее неблагоприятно протекающих и плохо поддающихся лечению злокачественных опухолей. При этом от многих других опухолей ее отличает доказанная иммуногенность вследствие экспрессии различных, в частности раково-тестикулярных антигенов, которые изучены и описаны в литературе [9]. Особенности инфильтрации опухоли лимфоцитами, макрофагами, плазматическими клетками, оценка ее роли в прогрессии или регрессии опухоли, ее возможное прогностическое значение привлекают внимание ряда авторов [1]. Характеристика иммунологического микроокружения рассматривается как важный прогностический признак при иммунотерапии меланомы [3; 6]. В аспекте взаимодействия опухоли и организма опухоленосителя представляет особый интерес состояние перитуморальной области меланомы [4; 10].
Основными критериями при установлении стадии и расчете прогноза заболевания являются такие морфологические характеристики меланомы, как глубина инвазии по Кларку и толщина опухоли по Бреслоу. Первый критерий определяет уровень распространения злокачественного процесса в нижележащие слои дермы и основан на анатомическом строении кожи. Толщина опухоли по Бреслоу характеризует наибольший вертикальный размер меланомы в миллиметрах.
Целью данной работы является исследование особенностей лимфоцитарного состава опухолевой ткани и перитуморальной области меланомы кожи с различной толщиной опухоли по Бреслоу и глубиной инвазии по Кларку.
Материалы и методы
Объектом изучения были фрагменты ткани опухоли и перитуморальной области, а также кровь 30 пациентов с меланомой кожи (18 женщин и 12 мужчин в возрасте от 31 до 82 лет), госпитализированных в отделение опухолей кожи, мягких тканей и молочной железы № 2 Ростовского научно-исследовательского онкологического института с октября 2014 по июль 2015 г. У 3 больных патологический очаг локализовался на верхних конечностях, у 11 на нижних, у 2 на волосистой части головы, у 12 на туловище, у 2 на лице. По морфологической форме преобладала узловая меланома с толщиной от 1 до 15 мм по Бреслоу и II-V уровнем инвазии по Кларку. Одна пациентка имела отдаленные метастазы в легкие, у четверых больных установлено метастатическое поражение регионарного коллектора. Все случаи заболевания были первичными, неоадъювантного лечения не проводилось. Больным было выполнено хирургическое лечение в объеме широкого иссечения опухоли с пластикой местными тканями (15), свободным кожным лоскутом (10), встречными кожно-жировыми лоскутами (1), ротационным кожно-жировым лоскутом (3), серповидным кожно-жировым лоскутом (1). Пациентам с наличием метастазов в регионарных лимфатических узлах дополнительно проводилась лимфодиссекция. Исследование факторов общего и локального клеточного иммунитета проводили не позднее, чем через час после хирургического лечения на свежем послеоперационном материале и крови, взятой перед проведением операции. Кровь у больных брали из локтевой вены в пробирку с антикоагулянтом (ЭДТА). Удаленные опухоли подвергались патоморфологическому исследованию; кроме того, отдельные фрагменты опухолевой ткани и перитуморальной зоны (ПЗ, визуально неизменной ткани, прилежащей к опухоли) гомогенизировали с помощью дезагрегирующего устройства BD Medimachine. В крови и в гомогенатах тканей определяли популяционный и субпопуляционный состав лимфоцитов на проточном цитометре FACSCantoII (BD) с панелью антител T-, B-, NK (CD45, CD3, CD4, CD8, CD19, CD16/56), дополнительно изучали количественное содержание Т-регуляторных (T-regs) клеток (CD4+CD25+CD127dim). Несмотря на то что наиболее распространенным методом определения последних является подсчет клеток с фенотипом CD4+CD25brightFoxP3+, в литературе есть данные о приемлемости для этой цели фенотипа CD4+CD25+CD127dim [2; 7].
Результаты выражали в процентах от общего количества лимфоцитов, а для T-regs в процентах от CD3+CD4+ клеток. Статистическую обработку данных выполняли с помощью параметрических и непараметрических методов (t-критерий Стьюдента, критерий Уилкоксона, метод непрямых разностей).
Результаты
Результаты исследования субпопуляционного состава лимфоцитов крови, опухоли и перитуморальной зоны по всей группе больных представлены в табл. 1 и на рис. 1. Следует отметить, что не у всех больных в тканевых образцах были выявлены лимфоциты в количестве, достаточном для проточной цитофлюориметрии. Так, из 30 образцов опухолей лимфоциты были обнаружены в 23, а в перитуморальной области – только в 13 образцах.
Таблица 1
Сравнительная характеристика субпопуляционного состава лимфоцитов крови, опухоли и перитуморальной зоны при меланоме кожи (%)
|
Лимфоциты |
Образцы тканей |
||
|
Опухоль (n=23) |
Перитуморальная зона (n=13) |
Кровь (n=30) |
|
|
CD3+ |
89,1±1,8* ** |
81,9±2,5* |
69,3±2,36 |
|
CD3+CD4+ |
43,0±2,4 ** |
51,9±3,9* |
42,7±2,1 |
|
CD3+CD8+ |
37,8±2,6* ** |
22,7±2,0 |
22,8±1,4 |
|
CD19+ |
2,9±0,46* |
2,6±0,73* |
10,7±0,94 |
|
CD16/56+ |
5,7±1,6* ** |
12,4±2,7 |
17,7±1,7 |
|
T-regs от CD4+ |
18,6±2,4* ** |
10,1±2,2 |
6,73±0,27 |
Примечание. * - статистически достоверные отличия от показателей крови; ** - статистически достоверные отличия от показателей перитуморальной зоны (р<0,05).
Как видно из табл. 1, наблюдается ряд различий лимфоцитарного состава опухоли и ее окружения от соответствующих показателей крови. Так, уровень Т-лимфоцитов в опухоли статистически достоверно выше, чем в крови, за счет CD3+CD8+ клеток, а содержание В- и NК-лимфоцитов – ниже. В опухоли отмечено накопление T-regs, количество которых в процентах от CD3+CD4+ клеток оказалось в 3 раза выше, чем в крови, хотя по общему уровню CD3+CD4+ лимфоцитов кровь и опухолевая ткань не имели статистически достоверных различий.
Состав лимфоцитарных популяций и субпопуляций ткани перитуморальной зоны демонстрирует ряд отличий от показателей как крови, так и опухолевой ткани (табл. 1, рис. 1). По сравнению с кровью в ней выявлено статистически значимо больше CD3+ клеток за счет CD3+CD4+ и меньше В-(CD19+) лимфоцитов. По сравнению с тканью опухоли перитуморальная область содержит меньше CD3+ и CD3+CD8+ лимфоцитов, а также T-regs на фоне более высокого уровня CD3+CD4+ клеток. В перитуморальной зоне выявлено также статистически достоверно более высокое содержание CD16/56+ клеток, чем в опухоли: происходит постепенное снижение их уровня от периферической крови через перитуморальную зону к ткани опухоли, причем такая направленность противоположна наблюдаемой для T-regs (рис. 1).
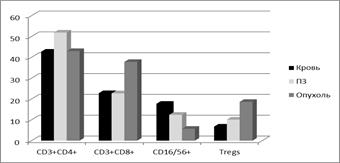
Рис. 1. Процентное содержание лимфоцитов некоторых субпопуляций в крови и в тканях меланомы и ее перитуморальной области
Для анализа показателей иммунного статуса у больных с различным уровнем инвазии меланомы по Бреслоу были выделены 3 группы больных: с инвазией 1-3, 3-10 и больше 10 мм. Сравнительная характеристика их иммунологических показателей приведена в табл. 2, на рис. 2.
Таблица 2
Показатели общего и локального иммунитета у больных меланомой кожи при разной толщине опухоли по Бреслоу (%)
|
Лимфоциты |
Толщина опухоли, образцы тканей |
||||||||
|
1-3 мм (n=9) |
3-10 мм (n=15) |
Больше 10 мм (n=6) |
|||||||
|
опухоль |
ПЗ |
кровь |
опухоль |
ПЗ |
кровь |
опухоль |
ПЗ |
кровь |
|
|
CD3+ |
94,9± 0,7* **• |
88,9± 0,7*º |
65,9± 5,1 |
90± 1,5*• |
81,1±5,5 |
72± 3,4 |
80,0± 5,9• |
76,4± 2,8º |
69,2± 3,9 |
|
CD3+ CD4+ |
48± 5,2 |
61,1± 5,2*º |
37,8± 3,4 |
43,5± 2,9 |
53± 8,3 |
42,5± 3,5 |
36,6± 5,5* ** |
47,1± 5,2º |
45,2± 3,4 |
|
CD3+ CD8+ |
39,9± 4,6* ** |
21,6± 3,6 |
24,8± 2,7 |
38,2± 3,2* ** |
22,1±3,0 |
22,1± 2,1 |
38,3± 8,6* |
21,1± 3,9 |
19,2± 2,0 |
|
CD16/ 56+ |
1,4± 2,3*• |
4,4± 2,3*º |
16,8± 2,9 |
4,1± 1,0*• |
13,5±5,3 |
18,1± 3,1 |
12,8± 5,3• |
18,6± 3,3º |
17,5± 1,9 |
|
CD19+ |
1,3± 0,6*• |
3,5± 2,8* |
12,0± 2,8 |
3,9± 0,7*• |
2,7± 1,1* |
9,2± 1,0 |
2,1± 0,3* |
1,6± 0,7* |
12,2± 2,7 |
|
T-regs от CD4+ |
12,4± 3,2 |
11,9± 5,6 |
7,2± 0,5 |
21,3± 3,5* |
5,5± 1,9 |
6,4± 0,5 |
19,6± 5,2* |
14,0± 5,1 |
6,4± 0,4 |
Примечание. * - статистически достоверные отличия от показателей крови; ** - статистически достоверные отличия от показателей перитуморальной зоны; • - статистически достоверные различия между группами (опухоль); º - статистически достоверные различия между группами (перитуморальная зона) (р<0,05).
Как видно из табл. 2, не наблюдается статистически достоверных различий исследуемых показателей в крови, кроме уровня лимфоцитов, который был выше при минимальной глубине инвазии опухоли (30,9±2,3, 23,7±1,5 и 21,9±2,6% соответственно; р<0,05).
В ткани опухоли и перитуморальной зоны обнаружены различия: при нарастании инвазии уменьшается количество Т-лимфоцитов и повышается содержание NК-клеток. Различия по уровню T-regs в опухоли статистически недостоверны, но выявлена тенденция к их более высокому содержанию в опухолях с более глубокой инвазией. При инвазии 1-3 мм 4 из исследованных показателей в опухолевой ткани отличаются от крови: содержание Т-лимфоцитов, в частности CD3+CD8+, было выше, а уровни CD16/56+ и CD19+ ниже, чем в крови. При инвазии 3-10 мм к аналогичным различиям добавляется статистически значимо более высокое по сравнению с кровью содержание T-regs, а максимальная глубина инвазии сопровождается более низким уровнем в опухолевой ткани CD3+CD4+ лимфоцитов при высоком проценте T-regs; количество NК-клеток не отличается от показателя крови. Подобные различия прослеживаются и в перитуморальной зоне: так, при минимальной инвазии в ней содержится статистически достоверно больше CD3+ и CD3+CD4+ лимфоцитов и меньше NК-клеток, чем при меланоме с инвазией свыше 10 мм (табл. 2).
При сравнении факторов локального иммунитета у больных с различной инвазией по Кларку выявлены подобные закономерности: в опухоли находится больше Т-клеток, чем в крови, преимущественно за счет CD3+CD8+ и T-regs, и меньше CD19+ и CD16/56+ (табл. 3). В перитуморальной зоне отмечено повышение уровней CD3+CD4+ лимфоцитов по сравнению с кровью, хотя не во всех группах статистически достоверно подтвержденное.
Таблица 3
Показатели общего и локального иммунитета у больных меланомой кожи при разной глубине инвазии опухоли по Кларку (%)
|
Лимфоциты |
Глубина инвазии, образцы тканей |
||||||||
|
III (n=15) |
IV (n=8) |
V (n=4) |
|||||||
|
опухоль |
ПЗ |
кровь |
опухоль |
ПЗ |
кровь |
опухоль |
ПЗ |
кровь |
|
|
CD3+ |
90,7± 1,6* |
84,3± 3,6* |
67,2± 3,1º |
92,9± 1,0* |
82± 7,6 |
78,7± 1,9º |
77,4± 6,9 |
75,2± 3,6 |
67,8± 4,7º |
|
CD3+ CD4+ |
49,4± 2,8• |
56,7± 5,9* |
42,3± 3,4 |
34,9± 2,6*• |
50,9± 10,6 |
44,9± 2,4 |
39,0± 4,3• |
47,9± 7,2 |
39,0± 6,3 |
|
CD3+ CD8+ |
35,5± 3,0* **• |
22,6± 2,9 |
20,5± 1,6º |
47,3± 3,7* **• |
19,4± 1,1* |
28,3± 2,8º |
33,3± 9,1 |
22,0± 5,3 |
18,1± 2,1º |
|
CD16/ 56+ |
3,9± 1,0*• |
9,2± 4,0* |
21,4± 2,8º |
2,1± 0,6* |
13,5± 6,5 |
11,3± 1,5º |
16,4± 5,5• |
19,7± 4,4 |
18,1± 2,1º |
|
CD19+ |
3,1± 0,6* |
3,4± 1,5* |
10,6± 1,5 |
2,7± 1,1* |
1,3± 0,9* |
9,4± 0,9 |
2,3± 0,3* |
2,1± 0,7* |
12,6± 3,4 |
|
T-regs от CD4+ |
20,6± 3,4* ** |
9,33± 2,9 |
7,0± 0,3 |
14,1± 3,5 |
9,2± 5,6 |
6,1± 0,3 |
20,6± 6,7* |
11,9± 6,5 |
6,8± 0,4 |
Примечание. * - статистически достоверные отличия от показателей крови; ** - статистически достоверные отличия от показателей перитуморальной зоны; • - статистически достоверные различия между группами (опухоль); º - статистически достоверные различия между группами (кровь) (р<0,05).
Отмечен ряд различий между группами в зависимости от степени инвазии по Кларку: при III степени в опухоли наблюдался более высокий уровень CD3+CD4+ лимфоцитов по сравнению с IV и V степенью, а уровень CD3+CD8+ клеток был максимальным в опухолях с IV степенью инвазии. Сходная картина наблюдалась и в крови: у больных с IV степенью инвазии содержание CD3+CD8+ было статистически значимо выше, а CD3+CD4+ ниже, чем при III степени инвазии; однако при инвазии V степени не наблюдалось отличий от III (табл. 3).
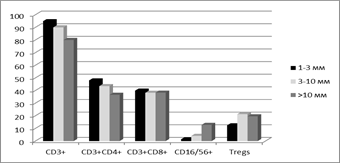
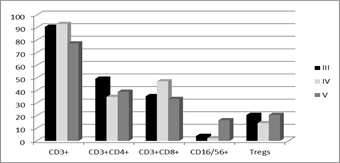
На рис. 2 представлено сравнение исследованных факторов локального клеточного иммунитета в ткани меланомы кожи с различной глубиной инвазии по Бреслоу и по Кларку: показаны как сходные закономерности, так и различия.
 А
А
 Б
Б
Рис. 2. Процентное содержание лимфоцитов некоторых субпопуляций в ткани меланомы при различной толщине опухоли по Бреслоу (А) и глубине инвазии по Кларку (Б)
Так, при более глубокой инвазии опухоли по обоим критериям отмечено снижение уровня CD3+ и CD3+CD4+ клеток и повышение содержания CD16/56+ лимфоцитов. При этом наблюдались разноречивые данные по количеству CD3+CD8+ клеток, демонстрирующему различия только при сравнении опухолей с различной глубиной инвазии по Кларку и по Т-regs, содержание которых было высоким вне зависимости от ее нарастания (рис. 2Б).
При сопоставлении иммунологических показателей в ткани поверхностных и узловых форм меланомы кожи также выявлен ряд различий, менее выраженных для крови, чем для опухолевой ткани. Так, в крови отмечено статистически достоверно более высокое количество лимфоцитов у больных с поверхностной формой меланомы кожи, чем с узловой (33,3±2,8 и 23,6±1,2% соответственно; р<0,05). В ткани опухоли у тех же больных выявлено по сравнению с узловой формой меланомы более высокое содержание Т-лимфоцитов (93,6±0,9 и 88,1±2,1% соответственно) и более низкое NК-клеток (0,9±0,1 и 6,4±1,8% соответственно), а также T-regs (10,6±3,3 и 19,8±2,5% соответственно); для данных показателей различия статистически достоверны (р<0,05) (рис. 3).
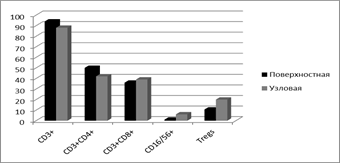
Рис. 3. Процентное содержание лимфоцитов некоторых субпопуляций в ткани меланомы при ее различных формах
Итак, в опухолевой ткани меланомы кожи присутствуют Т-лимфоциты обеих основных субпопуляций, потенциально обладающие способностью к распознаванию антигенов, продукции цитокинов, а также цитотоксичостью (CD3+CD4+ и CD3+CD8+); однако их наличие не реализуется в виде противоопухолевого действия. Причина этого, по-видимому, состоит в том, что, несмотря сходное процентное содержание CD3+CD4+ клеток в крови и в ткани меланомы, уровень их минорной субпопуляции T-regs в последней значительно выше, тогда как CD3+CD4+ концентрируются в перитуморальной области. Можно предположить избирательность миграции T-regs в опухолевую ткань вследствие взаимодействия их мембранных рецепторов с хемокинами, что описано в литературе на примере рака яичника [5] и желудка [8]. Неожиданной находкой явился низкий уровень NК-клеток в ткани меланомы с меньшей глубиной инвазии и его повышение при более глубоком прорастании. Однако с учетом значительного уровня в ней T-regs и данных литературы об их ингибирующем действии в отношении естественных киллеров [2], можно предположить, что их присутствие в опухоли препятствует проявлению цитолитической активности последних.
Рецензенты:
Каймакчи О.Ю., д.м.н., ассистент кафедры онкологии с курсом онкологии и детской онкологии ФПК и ППС ГБОУ ВПО «РостГМУ» Минздрава России, г. Ростов-на-Дону;
Голотина Л.Ю., д.м.н., профессор, ассистент кафедры онкологии с курсом онкологии и детской онкологии ФПК и ППС ГБОУ ВПО «РостГМУ» Минздрава России, г. Ростов-на-Дону.
Библиографическая ссылка
Златник Е.Ю., Бахтин А.В., Кочуев С.С., Новикова И.А., Селютина О.Н., Непомнящая Е.М., Пржедецкий Ю.В., Позднякова В.В., Захарова Н.А. ФАКТОРЫ ЛОКАЛЬНОГО КЛЕТОЧНОГО ИММУНИТЕТА ПРИ МЕЛАНОМЕ КОЖИ // Современные проблемы науки и образования. – 2015. – № 5. ;URL: https://science-education.ru/ru/article/view?id=21801 (дата обращения: 19.04.2024).



