Дисплазия тазобедренного сустава (ДТС) является одним из самых распространенных заболеваний костно-мышечной системы у детей, в основе которого лежат механизмы генетически обусловленной неполноценности компонентов тазобедренного сустава (ТБС) [4, 6, 16]. Манифестация ДТС различна и обусловлена генетической природой изменений различных типов соединительной ткани (хрящевой, костной, опорной) [1, 2, 3]. Актуальность ДТС в настоящее время несомненна, в пользу данного факта свидетельствуют неутешительные прогнозы в отношении распространенности диспластического коксартроза во взрослой мировой популяции и постоянный рост рынка эндопротезов ТБС. Конкретные этиологические факторы обязательного развития ДТС в настоящее время не выявлены, что свидетельствует о мультифакториальной природе заболевания. Однако исследования с экспериментальной доказательной базой некоторых врачей-ортопедов и ученых [27] определили ряд условий, способствующих реализации клинической его картины: генетическая предрасположенность отдельных семей [31], ягодичное предлежание плода, женский пол [17], неблагоприятные факторы при вынашивании плода [9]. Кроме того, в крови детей с ДТС также отмечали повышенное содержание гормона релаксина (предполагается его ответственность за развитие слабости капсульно-связочного аппарата) [15].
Цель
Проанализировать условия формирования проксимального отдела бедренной кости у детей при дисплазии.
Методы
В обзоре рассматриваются исследования авторов, посвященные изучению роли генетических факторов в развитии ДТС, а также биомеханические условия развития торсионно-вальгусной деформации проксимального отдела бедренной кости (ТВД ПОБК).
Результаты
В основе всех проявлений ДТС ключевая роль принадлежит генетическим изменениям нативной структуры опорной соединительной ткани (кость, хрящ, капсула и связки), что констатировано рядом исследований. Так, Zervas и соавт. (1983) выявили несколько примеров фамильной ДТС, возникших в результате транслокации хромосом, кодирующих структуру гиалинового хряща [32]. В свою очередь Carter&Wilkinson (1992) предположили наличие, возможно, двух групп генов, ответственных за проявления ДТС. Так, первая группа генов кодировала диспластические изменения вертлужной впадины, а вторая группа – слабость капсульно-связочного аппарата сустава [14].
Wynne-Davies с соавт. [31], предположили существование наследственно обусловленной группы множества генетических аллелей, ответственных за недоразвитие костных компонентов ТБС. В том числе они были ответственны за латентные варианты течения заболевания, диагностированные в позднем возрасте. Другая группа генетических аллелей, обусловливающих слабость капсулы и связок сустава, ответственна за случаи развития ДТБС у детей до 1 года.
В настоящее время раскодированы некоторые мутации в генах коллагена I и II типов (COL1A1, HOXB9, COL2A1), а также минорных коллагенов и протеогликанов, которые обусловливают диспластичность сустава, слабость капсульно-связочного аппарата [25, 21].
Сущность генетических изменений сводится к нарушению функций нормальной костной, хрящевой и связочной соединительной ткани. Так, мутации генетических локусов коллагена I типа отвечают за потерю прочности, опорности суставных поверхностей, также нарушают пролиферацию и дифференцировку нормальных остеобластов и остеокластов, вследствие чего происходит недоразвитие костных компонентов ТБС, нарушение процессов обызвествления хрящевой модели. Данные нарушения обусловливают недоразвитие вертлужной впадины, ее малую глубину. Проксимальный отдел бедра также претерпевает значительные изменения: потеря прочности и опороспособности вызывает размягчение в ростковых зонах эпифиза с его последующей деформацией в виде удлинения и вальгизации шейки, а также формированием торсионно-вальгусных деформаций.
Мутации коллагена II типа и базовых протеогликанов в гиалиновом хряще снижают его прочность, способность к обратимым изменениям, гидратированности. Все это предрасполагает к потере функциональности хрящевых поверхностей ТБС, а также способствует развитию дистрофических изменений в хрящевой губе, снижению контактности головки бедра и вертлужной впадины. Это приводит к соскальзыванию головки бедра по мелкой впадине, а также косвенно стимулирует удлинение шейки.
Весь организм человека зависит от законов физики, поэтому различные силы тяжести и линии контактного стресса на тазобедренный сустав формирует его уникальную форму. Ребенок, вставший на ноги и начавший ходьбу, принципиально изменяет распределение нагрузки на проксимальный отдел бедра. Именно этот новый биомеханический статус формирует окончательный тип диспластической деформации (торсионно-вальгусная деформация проксимального отдела бедренной кости). В многочисленных литературных источниках даны объяснения тем или иным изменениям, происходящим при формировании проксимального отдела бедра [24, 13].
Так, эксперименты некоторых авторов [10] рассматривают ТВД ПОБК как неудачный результат соотношения биомеханических параметров (силовых линий нагрузки и нагружаемых поверхностей проксимального отдела) с использованием индекса стресса сустава. Данные ученые с 1993 г. занимались конструированием модели силовых линий в ТБС, с помощью которой доказали важное значение нарушения статико-кинематической функции при дисплазии [10, 20, 19, 33].
Клиническая апробация данной модели показала, что пиковое напряжение на область головки бедра при ДТБС гораздо выше, нежели в норме [29]. Индекс пикового напряжения (рис. 1) в области латеральной части впадины негативный в норме и позитивный в диспластичном ТБС [23].
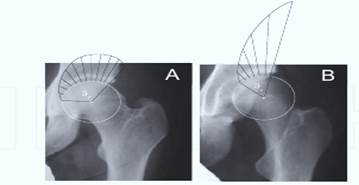
Рис. 1. Линии напряжения во фронтальной поверхности, длина линий отражает степень стресса: А – площадь нагрузки головки ТБС в норме; В – площадь нагрузки головки бедра при дисплазии
Однако не только изменение линий напряжения играет важную роль в появлении деформаций ПОБ. Традиционными биомеханическими моделями, показывающими изменение ТБС при дисплазии, являются двумерные модели-схемы с расчетом сил напряжений [7, 12]. Именно дисбаланс сил напряжений при дисплазии, которые зависят от состояния мышц-абдукторов и массы тела, является решающим в формировании ТВДБ ПОБК.
Согласно данной модели вес тела человека равномерно распределен на обе нижние конечности (рис. 2). Центр тяжести расположен между ТБС, его сила равномерно воздействует на них (вектора силы тяжести вертикальны и проходят через центр головки бедра). Стабильность и центрация головки в ТБС обеспечиваются взаимодействием противоположно направленных сил. Сила тяжести, направленная вниз, – вектор К (определяется массой тела человека и величиной рычага а – расстояние от общего центра массы до центра вращения головки) создает вращательный момент вокруг центра головки. Противодействующая сила (момент противодействия М) создается мышцами-абдукторами. Сила мышц-абдукторов дополнительно создает обратный вращательный момент вокруг центра головки, который уступает по силе и рычагу вектору К.
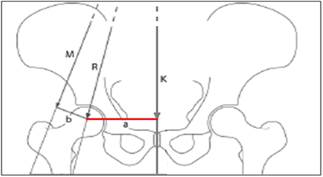
Рис. 2. Двумерная модель расчета напряжений в ТБС: моменты сил, действующих на нормальный ТБС (пояснение в тексте)
Таким образом, для поддержания стабильности в нормальном ТБС сила мышц-абдукторов должна быть кратной массе тела. Величина действующих сил в ТБС зависит от соотношения моментов сил а/b, т.е. момента силы, создаваемого весом человеком и рычагом а, и моментом силы мышц-абдукторов – вектор b [12, 11]. При ДТС принципиальными моментами являются нарушение биомеханики в суставе и перераспределение сил, обеспечивающих центрацию головки и стабильность в ТБС (рис. 3).
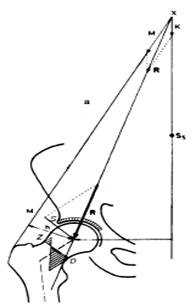 а)
а)  б)
б)
Рис. 3. Распределение сил напряжений в нормальном ТБС (а) и при ТВД ПОБ (б), где S – сила трения, D – сила сжатия, Z – сила напряжения, h – плечо момента сил абдукторов; M – момент сил мышц-абдукторов; K – сила тяжести массы тела; R – результирующая сила (Maquet, 1985; Pauwels, 1973)
При ТВД ПОБК плечо h момента сил мышц-абдукторов M короче, чем в нормальном ТБС (рис. 3 а). Таким образом, мышечное усилие в диспластичном суставе должно быть больше для поддержания баланса и противодействия силе К, также сила абдукторов М приближена к вертикали при вальгизации шейки бедра. В результате угол, образованный векторами сил К и М, становится более острым, что удлиняет вектор результирующей R. Результирующая оказывает большее воздействие на край вертлужной впадины (рис. 3 б), что снижает площадь распределения нагрузки в диспластичном ТБС на единицу поверхности впадины и суставной губы, концентрируя отдельные силы напряжения точечно по суставным образованиям, провоцируя артрит. Однако при ТВД ПОБК вектор результирующей R направлен ближе к оси шейки, что создает условия для преобладания сил сжатия в проксимальном отделе бедра.
Обсуждение
В большинстве случаев при упоминании «дисплазия тазобедренных суставов» многочисленные авторы подразумевают ацетабулярную дисплазию [8, 30, 22, 28, 18, 26], уделяя скромное внимание деформации проксимального отдела бедра (ПОБК). Однако ряд исследований, посвященных проблеме ДТС у детей, обнаруживает большое количество случаев «дисплазии бедра». Так, В.Д Макушин с соавт. (2010) при изучении 859 суставов у детей отметил суставы с преобладанием бедренного компонента патологии в 72,1% случаев (619 суставов), в то время, как ацетабулярная дисплазия отмечена в 27,9% случаев (240 суставов) [5]. ТВД ПОБК является одним из компонентов диспластичного сустава, которая, на наш взгляд, заслуживает отдельного внимания.
Заключение
Таким образом, генетические мутации в соединительной опорной ткани, возникающие при дисплазии, способствуют нарушению первоначальной структуры сустава, увеличивая его склонность к анатомическим деформациям как вертлужной впадины, так и проксимального отдела бедра. Данные изменения особенно хорошо заметны при возрастающей роли биомеханического фактора (ходьба), факторов окружающей среды. Несмотря на общие выявленные закономерности биомеханики, имеются различия действия сил в каждом ТБС у всех индивидуумов, что связано с уникальными особенностями анатомии, состоянием мышечной ткани и уровнем тренированности мышц, образом жизни (повышенными физическими нагрузками и т.д.). Особая роль при ДТС принадлежит ТВД ПОБК как фактору, определяющему нестабильность ТБС за счет не только костно-хрящевых структур, но и мягкотканых компонентов.
Рецензенты:
Норкин И.А. д.м.н., профессор, директор ФГБУ «Саратовский научно-исследовательский институт травматологии и ортопедии» Минздрава России, г. Саратов;
Пучиньян Д.М., д.м.н., профессор, главный научный сотрудник отдела фундаментальных и клинико-экспериментальных исследований ФГБУ «Саратовский научно-исследовательский институт травматологии и ортопедии» Минздрава России, г. Саратов.
Библиографическая ссылка
Бахтеева Н.Х., Зоткин В.В., Сертакова А.В., Юсупов К.С. ФОРМИРОВАНИЕ ПРОКСИМАЛЬНОГО ОТДЕЛА БЕДРЕННОЙ КОСТИ У ДЕТЕЙ ПРИ ДИСПЛАЗИИ // Современные проблемы науки и образования. – 2015. – № 5. ;URL: https://science-education.ru/ru/article/view?id=22397 (дата обращения: 19.04.2024).



