В условиях интродукции, особенно в климатической зоне средней полосы, возобновление этих видов традиционными способами затруднено [3]. В связи с этим, необходимым является поиск методов размножения лилий, позволяющих не только размножить ценные декоративные растения, но и сохранить их в природе. При выборе стратегии сохранения биоразнообразия редких, исчезающих видов растений многими исследователями показана эффективность методов биотехнологии в сравнении с традиционными способами их размножения [8].
С помощью метода культуры ткани ранее были успешно размножены многие редкие виды лилий: L. martagon L. [6], L. ledebourii (Baker) Boiss [4] и некоторые другие. При использовании эксплантов, представлявших собой ткани либо фрагменты генеративного побега лилий, большинство исследователей отмечали появление регенерантов путем образования адвентивных почек из каллуса, тогда как для сохранения генотипов редких и исчезающих растений предпочтительны методы, позволяющие избежать сомаклональной изменчивости у регенерантов. Необходимость изучения ранних стадий морфогенеза лилий в культуре in vitro с помощью гистологического анализа объясняется тем, что первичные процессы органогенеза в тканях эксплантов, как правило, определяют их дальнейший путь морфогенеза [6]. При использовании флоральных эксплантов редких видов лилий в культуре in vitro исключается возможность повреждения или гибели материнских растений в природе.
Цель исследования – определить особенности регенерации и реализации морфогенетического потенциала различных типов эксплантов, выделенных из цветков 3-х редких видов рода Lilium L. в зависимости от минерального состава питательной среды и внесенных регуляторов роста.
Объекты и методы
Объектами для введения в культуру in vitro являлись три вида из р. Lilium, произрастающие в азиатской части России: L. cernuum Kom..L. distichum Nakai, L. pumilum Delile. L. cernuum и L. distichum получены из природных популяций Дальнего Востока. L. pumilum собрана из окрестностей села Б. Голоустное (западное побережье о. Байкал). Исследования по микроразмножению данных объектов проведены в лаборатории биотехнологии Центрального сибирского ботанического сада. Эксплантами служили различные ткани и органы, выделенные из неокрашенных бутонов трех видов лилий: 1. Поперечные срезы оси соцветия, толщиной 1,5-2 мм; 2. Фрагменты цветоложа такой же толщины; 3. Пыльник с тычиночной нитью и с частью цветоложа. Экспериментальные работы с использованием метода культуры тканей проводили по общепринятым методикам [2]. Для стерилизации бутонов проводили их обработку 96 %-м этанолом в течение 1 мин, далее их обжигали в пламени спиртовки, после чего выдерживали 5 минут в 0,1 %-м водном растворе HgCl2 (0.1%), а затем 4 раза промывали в стерильной дистиллированной воде.
Для инокуляции и культивирования эксплантов использовали две питательные среды: МS [7] и N6 [5] модифицированные нами и обозначенные – МSm и N6m. Модификация состояла в том, что концентрация сахарозы была увеличена до 4%, содержание микросолей и органических компонентов в данных средах было идентично среде MS. Концентрации и компонентный состав макросолей в каждой из сред соответствовал их базовому уровню. Для получения полутвердой питательной среды применяли агар-агар марки «Bacto agar» в концентрации 4-6 г/л. Значение рН сред = 5.7-5,8, продолжительность одного пассажа составляла 3-4 недели. Дальнейшее изучение морфогенетических потенций эксплантов тканей и органов цветков у данного вида лилии было проведено на 4 вариантах питательных сред MSm и N6m, содержавших регуляторы роста 2,4 Д и БАП как по отдельности, так и в комбинации друг с другом.
На всех этапах культивирования растения выращивались: а) при искусственном освещении 40 мкмоль∙м -2/сек-1, 16 часовом фотопериоде и температуре 22 ± 24° С; б) для лучшей адаптации перед высадкой ex vivo растения - регенеранты выдерживали 1-1,5 месяца в световом термостате фирмы Rumed (Германия) при + 7° С.
Гистологическое изучение тканей регенерантов было выполнено на постоянных препаратах, для дифференцированной окраски на ДНК-РНК ткани окрашивали метиловым зеленым и пиронином. Готовые препараты и образцы тканей просматривали на микроскопе “Axiolab” фирмы “Zeiss” в центре коллективного пользования ЦСБС.
Результаты и обсуждение
Предварительные эксперименты показали, что морфогенетическая реакция вышеуказанных типов эксплантов тканей и органов цветка 3 видов лилий отсутствовала при их инокуляции на среды MSm и N6m без регуляторов роста. Использование таких эксплантов у лилий, как ось соцветия или ткани цветоложа, являющихся органами осевой природы, часто еще не закончивших развитие и не утративших своих морфогенетических способностей, как правило, приводит к образованию микролуковичек непрямым путем, т. е. путем каллусогенеза [9]. В процессе развития регенерантов важно исключить эту стадию, чтобы получить растения-регенеранты идентичные исходному генотипу. Перед нами стояла задача подобрать такие типы эксплантов, которые представляли бы собой индивидуальные органы, выделенные с частью побега, имеющие наибольшую регенерационную способностью без образования каллуса.
Гистологическое изучение тканей эксплантов генеративной сферы L. pumilum, L. cernuum было проведено с целью построения прогнозируемой модели морфогенеза регенерантов, исключающей возможность возникновение сомаклональной изменчивости. Начальные стадии морфогенеза у данных видов лилий in vitro были отмечены образованием скоплений меристематических клеток у эксплантов, выделенных из тканей и органов цветков. На постоянных препаратах делящиеся группы клеток, находящиеся в субэпидермальном слое эксплантов были выявлены благодаря дифференцированной окраске, начиная с 20-25 дня инокуляции, и представляли собой мелкие клетки с хорошо различимыми ядрами, образовывавшие шаровидные структуры, включающие васкулярные элементы (рис.1). Подобные меристематические структуры были отмечены ранее многими исследователями – [6], [10] на ранних стадиях морфогенетического развития эксплантов луковичных растений в культуре in vitro. В нашем эксперименте эти центры адвентивного побегообразования в дальнейшем давали начало эндогенно образующимся микролуковицам лилий.
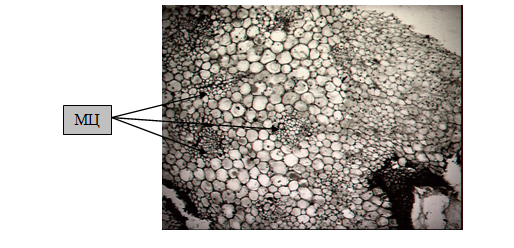
Рис.1. Заложение меристематических центров (МЦ) в паренхиме цветоложа L. pumilum, инокулированного на среду N6m-1, увеличение × 250
Отмечено, что образование микролуковичек происходило на всех типах эксплантов, выделенных из цветков 3 видов лилий в большинстве случаев по пути адвентивного побегообразования (гемморизогенеза) как на средах МSm, так и на средах N6m. Минеральная основа среды для инициации, а также концентрация ауксина 2,4- Д оказывали существенное влияние на образование микролуковичек у различного типа эксплантов, взятых из тканей и органов цветка L. pumilum, L.cernuum и L. distichum. Процесс образования побегов и микролуковичек у всех изученных видов лилий происходил более интенсивно на вариантах среды N6m, чем на средах MSm (табл. 1).
Таблица 1
Влияние минерального состава среды и концентрации 2,4- Д на тип морфогенетической реакции и интенсивность регенерации (шт. микролуковиц на эксплант) у эксплантов тканей и органов цветка Lilium cernuum, L. distichum, L. pumilum, n=24
|
Виды лилий, типы эксплантов |
Варианты питательных сред |
|||
|
MSm-1 |
MSm-2 |
N6m-1 |
N6m-2 |
|
|
0,2 мг/л БАП+ 0,2 мг/л 2,4 Д |
0,2 мг/л БАП+ 0,8 мг/л 2,4 Д |
0,2 мг/л БАП+ 0,2 мг/л 2,4 Д |
0,2 мг/л БАП+ 0,8 мг/л 2,4 Д |
|
|
1. Фрагм. цветоложа а) L.cernuum |
1,0 ± 0,13 По,К |
1,29±0,17 По,К |
2,33±0,25 Сэ,К |
2,72±0,23 По |
|
б) L. distichum |
0,25±0,09 По |
0,42±0,10 К |
1,04±0,15 По |
1,75 ±0,17 По |
|
в) L. pumilum |
2,30±0,24 К |
3,4±0,29 К |
3,8±0,30 По |
4,2±0,30 По |
|
2. Срез оси соцветия: а) L.cernuum |
- |
- |
0,5±0,13 К |
- |
|
б) L. distichum |
- |
- |
- |
- |
|
в) L. pumilum |
- |
- |
- |
0,75±0,21 По,К |
|
3. Тыч. нить с пыльн. и фрагм. цветоложа: а) L.cernuum |
2,0±0,24 По |
1,72,0±0,25 По |
3,21±0,27 По |
3,51±0,22 По |
|
б) L. distichum |
1,04±0,15 По |
1,20±0,20 По |
1,70±0,23 По |
3,80±0,33 По |
|
в) L. pumilum |
2,70±0,31 По |
3,10±0,27 По |
3,80±0,30 Сэ |
4,12±0,30 По |
Примечание :– - отсутствие морфогенетической реакции; По – прямой органогенез; К – каллусогенез; Сэ – соматический эмбриогенез
В нашем эксперименте наличие в среде ауксинов и цитокининов и их взаимодействие могло обеспечивать интенсивную индукцию гемморизогенеза как прямым, так и непрямым путем, т.е. путем дедифференциации и каллусогенеза. Каллусообразование отсутствовало только у одного типа эксплантов, а именно, у тычиночных нитей с пыльником и фрагментом цветоложа на всех четырех вариантах сред. Как известно, интенсивность образования каллуса пропорциональна величине раневой поверхности экспланта [1]. Очевидно, что при использовании тычиночных нитей с пыльником и фрагментом цветоложа ткани экспланта данного типа менее всего оказались подвержены поранению. Кроме того, меристематические структуры, как показал гистологический анализ в данной работе, закладывались именно в субэпидермальном слое.
При добавлении к среде N6m ауксина 2,4 Д в сочетании с цитокинином БАП в равных концентрациях (0,2 мг/л) примерно у 20 % эксплантов L. cernuum, представлявших собой тычиночные нити, объединенные с тканью цветоложа и с пыльником, было зафиксировано появление биполярных образований, имевших как зародышевую почечку, так и зародышевый корень, что позволило идентифицировать их как соматические эмбриоиды (рис.2).
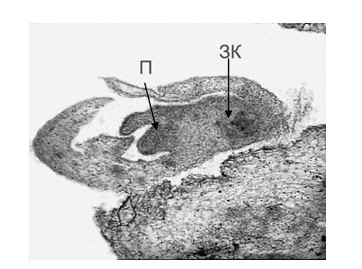
Рис.2. Образование соматического эмбриоида через 40 дней культивирования тычиночной нити с пыльником и тканью цветоложа L. pumilum на среде N6m + 0,2 мг/л 2,4 Д + 0,2 мг/л БАП; П – почечка; ЗК – зародышевый корень, увеличение ×50
Только в том случае, когда в составе питательной среды концентрация ауксина и цитокинина была одинакова, было отмечено образование соматических эмбриоидов у 2-х видов лилий: L.cernuum и L. distichum (рис.3). Таким образом, очевидно, именно низкая концентрация (0,2 мг/л) ауксина 2,4 Д в составе питательной среды N6m способствовала образованию соматических эмбриоидов как прямым (L. pumilum), так и непрямым путем (L. cernuum).
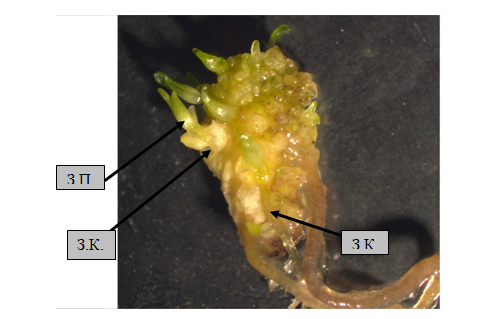
Рис.3. Образование соматических эмбриоидов из ткани цветоложа L. cernuum на среде N6m с добавлением 0, 2 мг/л 2,4 Д и 0,2 мг/л БАП: ЗК – зародышевый корень; ЗП – зародышевая почечка; увеличение ×10
На этапе адаптации полученных микролуковичек 3 редких видов лилий к условиям ex vitro для увеличения их размеров и лучшей укореняемости была произведена холодовая обработка регенерантов, для чего полученные микролуковицы лилий содержались в световом термостате при + 70 в течение от 1 до 1,5 месяца. После адаптации и высадке микролуковиц ex vitro в стерильный песок процент погибших растений составлял не более 5-7 %.
Таким образом, результаты показали, что совместное действие БАП и 2,4 Д обеспечивают регенерацию микролуковичек по пути прямого органогенеза или соматического эмбриогенеза. Нежелательной дедифференциации тканей эксплантов при каллусообразовании можно избежать при введении в культуру in vitro эксплантов, объединяющих в себе пыльник с тычиночной нитью и с частью цветоложа. Интенсивность регенерации, измеряемая по количеству микролуковичек, образующихся у различного типа эксплантов, взятых из тканей и органов цветка L. pumilum, L.cernuum и L. distichum зависела от минеральной основы среды, концентрации 2,4 и была больше на среде N6m-2. Гистологический анализ тканей и органов цветка L. pumilum и L. cernuum показал, что начальным этапом морфогенеза при культивировании in vitro данных типов эксплантов, следует считать образование меристематических зон и элементов проводящей системы, развивающихся в дальнейшем в адвентивные побеги. Изучены морфогенетические потенции цветоложа, околоцветников, тычиночных нитей лилий как перспективных эксплантов для сохранения данных видов в природе с помощью методов культуры тканей. При использовании способа размножения фрагментами бутонов in vitro исключается возможность повреждения или гибели растения, являющегося донором экспланта.
Заключение
Установлено, что в культуре тканей и органов цветков видов L. distichum, L. pumilum, L. cernuum возможна реализация процессов как адвентивного органогенеза, соматического эмбриогенеза, так и каллусогенеза. 2. Изучены морфогенетические потенции цветоложа, околоцветников, тычиночных нитей лилий как перспективных эксплантов для сохранения данных видов в природе с помощью методов культуры тканей. Наибольшая регенерационная способность к образованию микролуковичек у всех 3 видов лилий была отмечена у тычиночных нитей с пыльником и фрагментом цветоложа, культивировавшихся на среде N6m, включавшей 0,8 мг/л 2,4 Д и БАП в концентрации 0,2 мг/л. 3. Определен тип эксплантов, представляющий собой сопряженную систему: пыльник – тычиночная нить – ткань цветоложа, с помощью которой получены регенеранты путем прямого органогенеза и соматического эмбриогенеза без фазы каллусообразования. При использовании способа размножения фрагментами бутонов in vitro исключается возможность повреждения или гибели растения, являющегося донором экспланта.
Таким образом, разработана технология клонального микроразмножения 3 видов лилий Сибири и Дальнего Востока от стерильной культуры до растений - регенерантов с использованием в качестве эксплантов тканей и органов цветка.
Рецензенты:Новикова Т.И., д.б.н., зав. лаборатории биотехнологии ЦСБС СО РАН, г. Новосибирск;
Дорогина О.В., д.б.н., профессор, зав. лаборатории интродукции редких и исчезающих видов растений ЦСБС СО РАН, г. Новосибирск.
Библиографическая ссылка
Набиева А.Ю. РАЗМНОЖЕНИЕ В КУЛЬТУРЕ IN VITRO LILIUM CERNUUM KOM., LILIUM DISTICHUM NAKAI. И LILIUM PUMILUM DELILE ПРИ ИСПОЛЬЗОВАНИИ ЭКСПЛАНТОВ ТКАНЕЙ И ОРГАНОВ ЦВЕТКА // Современные проблемы науки и образования. – 2015. – № 6. ;URL: https://science-education.ru/ru/article/view?id=23357 (дата обращения: 19.04.2024).



