Язва (ulcus) — дефект кожи или слизистой оболочки, для которой характерно хроническое течение без склонности к спонтанному заживлению либо периодическое рецидивирование. Среди многочисленных гнойно-некротических заболеваний нижних конечностей трофические язвы занимают особое положение ввиду их широкого распространения и сложности лечения. «Язвы голени представляют истинный крест хирургов по своему громадному упорству и трудности излечения», — писал Спасокукоцкий С.И. ещё в начале прошлого века. Однако и по сей день эта проблема не потеряла своей актуальности [1, 4].
Хронические, длительно незаживающие раны (трофические язвы) нижних конечностей встречаются у 2 % трудоспособного населения в индустриально развитых странах. В пожилом возрасте их частота достигает 4 – 6 % [2, 3, 6].
С учетом демографических показателей можно констатировать, что в России не менее 5 млн. человек страдают трофическими язвами нижних конечностей, резистентными к консервативной терапии [5, 7].
У 81% больных, наличие трофических язв приводит к ухудшению качества жизни, которое проявляется в наличии постоянных или периодически возникающих болевых ощущений, ограничении подвижности, органических и косметических нарушениях.
Цель исследования: изучить эффективность лечения трофических язв с помощью аутотрансплантации жировой ткани в эксперименте.
Задачи исследования:
1. Получить модель трофической язвы венозной этиологии в эксперименте.
2. Оценить эффективность аутотрансплантации жировой ткани в лечении трофических язв в эксперименте.
Материалы и методы.
Объекты исследования: в виварии выполнена серия экспериментов, на 20 кроликах линии Шиншилла, старше 4-х месячного возраста обоего пола с массой тела от 3,0 килограмм.
Проведенные процедуры: всем кроликам двух групп изначально моделировалась трофическая язва по патенту РФ № 2510083 от 2014 г., с авторским добавлением, для получения трофической язвы именно венозной этиологии, которая включала в себя дополнительную перевязку v. femoralis (бедренной вены). Далее после получения трофической язвы венозной этиологии, очищения и появления вялой грануляции, кролики были разделены на две группы. Контрольной группе, из 10 кроликов, применялась системная лекарственная терапия включающая в себя ежедневные перевязки с обработкой трофической язвы раствором антисептика – диоксидина, и наложением асептической повязки с мазью левомеколь. Основной группе кроликов, состоящая так же из 10 кроликов, на фоне аналогичной системной лекарственно терапии, была проведена аутотрансплантация жировой ткани в область трофической язвы.
Для оценки эффективности лечения каждые 3 дня учитывалась клиническая картина раневого процесса, а так же выполнялось определение объём дефицита мягких тканей в зоне трофической язвы. Измерение объёма осуществлялось следующим способом: при помощи инсулинового шприца с гелем «катеджель с лидокаином», заполняли трофическую язву, обязательно после предварительной санации, при этом высчитывали то количество мл, которое входит в раневой дефект; далее зная что в 1 мл = 1000 мм3, высчитывали объем трофической язвы в мм3.
Результаты и обсуждение:
Моделирование трофической язвы проводили следующим способом:
1. За 15 минут до операции с целью премедикации экспериментальным животным вводили атропина сульфат в дозе 0,05 мг/кг подкожно.
2. После предварительной обработки кожи в асептических условиях, под наркозом (с помощью препарата золетил 100 - 15 мг/кг в/м), на выбритом от шерсти участке кожи, на внутренней поверхности бедра, проводился оперативный доступ – к v. femoralis (бедренной вены), с последующей ее перевязкой. Контроль на гемостаз. Послеоперационная рана послойно ушита. Наложена асептическая повязка.
3. Далее после предварительной обработки кожи и гидропрепаровки раствором лидокаина 5 мг, в асептических условиях, на выбритом от шерсти участке кожи, выполнено иссечение кожи по задненаружной поверхности верхней трети бедра кролика, до поверхностной фасции в виде круга (что приближено к форме клинического проявления трофической раны) диаметром 50 мм, площадью около 1962,5 мм2.
4. На поверхности дна образованной раны производили рассечение поверхностной фасции поперечными и продольными, взаимоперпендикулярными разрезами.
5. По краям раны накладывали кисетный шов, для создания картины нарушения микроциркуляции, стягивали, доводя рану в диаметре до 30 мм, площадью около 706,5 мм2.
6. В целях удержания краев раны и предотвращения их сближения накладывали кожно-фасциальные узловые швы. Контроль на гемостаз. Наложена асептическая повязка.
7. Смена асептической повязки проводились через день.
Полученная модель позволила через 2 недели сформировать трофическую язву венозной этиологии в эксперименте со всеми характерными для нее признаками: отек нижней конечности, где была перевязана бедренная вена; имеется рана со скудным фибринозно-гнойным отделяемым, дно раны покрыто участками фибрина, вялыми грануляциями. Кожа вокруг раны отечна, несколько гиперемирована (рис. 1).
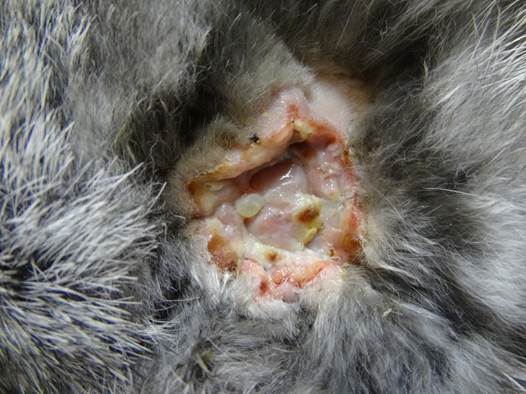
Рис. 1 Трофическая язва венозной этиологии полученная в эксперименте.
Далее, после получения трофической язвы с элементами нагноения, проводилась специфическая консервативная терапия, направленная на очищение раны, которая включала в себя ежедневные перевязки с обработкой 3% перекисью водорода и раствором антисептика (диоксидин 1%). После очищения трофической язвы, кролики были разделены на 2 группы.
Контрольная группа из 10 кроликов получала консервативную терапию, которая включала в себя ежедневную обработку трофической язвы 1% раствором диоксидина и наложением асептической повязки с мазью левомеколь.
Основной группе так из 10 кроликов, на фоне той же самой консервативной терапии, было проведено аутотрансплантация жировой ткани (липофиллинг).
Аутотрансплантация жировой ткани проводилась следующим образом:
1. За 15 минут до операции с целью премедикации экспериментальным животным вводили атропина сульфат в дозе 0,05 мг/кг под шкуру.
2. После предварительной обработки кожи в асептических условиях, под наркозом (с помощью препара золетил 100 - 15 мг/кг в/м), кроликов укладывали на спину, выбривали паховую область.
3. Далее проводили разметку места введения канюль в донорских (паховая область) и реципиентных зонах (трофическая язва), а также лучи-трассы экскурсии канюль при липофилинге в реципиентных зонах.
4. После обработки операционного поля, производили проколы на шкуре до 1,5 мм с помощью глазного скальпеля, отступив 3–5 см от границы донорской зоны.
5. Производили тумесценцию донорской зоны раствором Кляйна 40 мл, 15-минутная экспозиция для реализации сосудосуживающего эффекта адреналина. Стандартный раствор Кляйна (Klein) состоял из физиологического раствора (0,9 % – 1000 мл), лидокаина (10% – 2 мл) и адреналина (0,1% – 1 мл).
6. Затем при помощи липоаспирационной канюли до 1,2 мм в диаметре осуществляли осторожную туннелизацию с минимальным усилием. Предшествующая тумесценция способствовала беспрепятственному и легкому проникновению липоаспирационной канюли в ткани донорской зоны. Шприцы для микролипоаспирации были не более 20 мл, а отрицательное давление в них было минимальным. Отрицательное давление создавалось путем оттягивания поршня разового шприца, присоединенного к аспирационной канюле. Получали первичный липоаспират.
7. Первичный липоаспират в дальнейшем подвергали отмыванию с помощью 5 % раствора глюкозы. В результате получали отмытый от эритроцитов липоаспират.
8. Через проколы на коже, в реципиентной зоне, до 1,5 мм инъекционную канюлю до 1,2 мм в диаметре с тупым концом проводили до конца каждого маркированного луча и вводили липоаспират на выходе, постепенно извлекая канюлю путем одновременного надавливания на поршень шприца. Веерообразно проводя до 3 введений взвеси с одного прокола в мягкие ткани вокруг язвы, создавая перифокальный валик до 0,5 см толщиной. Расстояние между лучами-каналами не превышало 2–3 мм. Так же вводили веерообразно липоаспират и непосредственно под язвенный дефект (рис. 2, рис. 3).
9. После извлечения канюли луч-трассу канала мягко массировали через шкуру. Затем накладывали асептическую раневую повязку.
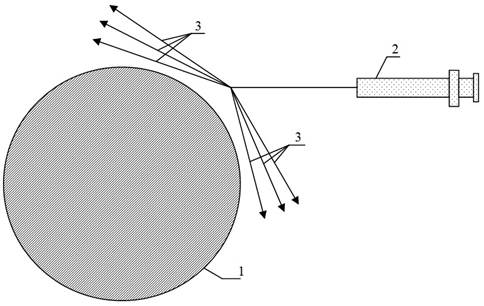
Рис. 2. Направления введения жировой ткани в мягкие ткани вокруг трофической язвы. (1 - трофическая язва; 2 - инъекционная канюля до 1,2 мм в диаметре с тупым концом; 3 - лучи-трассы введений жировой ткани с одного прокола в мягкие ткани вокруг трофической язвы.)
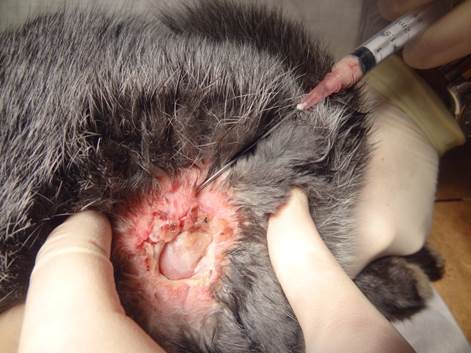
Рис. 3 Аутотрансплантация жировой ткани в эксперименте.
Клиническое течение в двух группах, значительно отличались друг от друга.
Основная группа (на 9-е сутки после липофилинга): дно трофической язвы заполнена яркой грануляцией, гиперемии, отека вокруг язвенного дефекта нет. Отмечается краевая эпителизация раны. Объём раны в среднем уменьшился на 25%.
Основная группа (на 21-е сутки после липофилинга): 100% эпителизация раны, нормотрофический рубец.
Контрольная группа (на 9-е сутки): дно трофической язвы заполнена вялой грануляцией, отмечается выраженная гиперемия, отёчность вокруг язвенного дефекта. Отмечается незначительная краевая эпителизация раны. Объём раны в среднем уменьшился на 13%.
Контрольная группа (на 21-е сутки): дно трофической язвы заполнена грануляцией, гиперемия и отёчность вокруг язвенного дефекта несколько меньше. Отмечается краевая эпителизация раны. Объём раны в среднем уменьшился на 48%.
Проведено изменение объём трофических язв после второго этапа оперативного вмешательства в динамике (табл. 1).
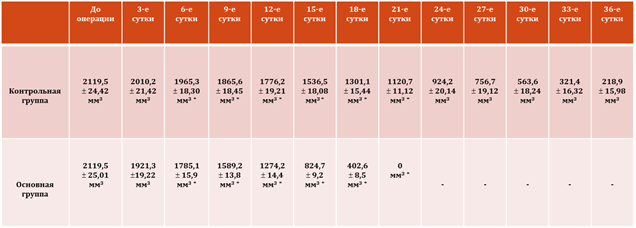
Примечание: * - р<0,05.
Табл. 1. Изменение объём трофических язв в группах сравнения.
Выводы:
Применения методики аутотрансплантации жировой ткани при лечении трофических язв венозной этиологии в эксперименте, привело к сокращению периода заживления трофической язвы.
Рецензенты:
Черданцев Д.В., д.м.н., профессор, зав. кафедрой и клиникой хирургических болезней им. А.М. Дыхно, ГБОУ ВПО «Красноярский государственный медицинский университет им. проф. Войно-Ясенецкого, г. Красноярск;
Здзитовецкий Д.Э., д.м.н., профессор, зав. кафедрой и клиникой хирургических болезней им. проф. Ю.М. Лубенского, ГБОУ ВПО «Красноярский государственный медицинский университет им. проф. Войно-Ясенецкого, г. Красноярск.
Библиографическая ссылка
Гуликян Г.Н., Карапетян Г.Э., Пахомова Р.А., Кочетова Л.В. ЛЕЧЕНИЕ ТРОФИЧЕСКИХ ЯЗВ МЕТОДОМ АУТОТРАНСПЛАНТАЦИИ ЖИРОВОЙ ТКАНИ В ЭКСПЕРИМЕНТЕ // Современные проблемы науки и образования. – 2015. – № 6. ;URL: https://science-education.ru/ru/article/view?id=23754 (дата обращения: 19.04.2024).



