В настоящее время оксидативный стресс рассматривается как совокупность процессов, вызывающих повреждение молекул, клеток и тканей собственного организма в результате избыточного образования окислителей – свободных радикалов. С процессами оксидативного стресса напрямую связан и стресс психоэмоциональный – основа развития многих психических расстройств. Установлено, что избыточное образование свободных радикалов, обладающих высокой реакционной способностью и запускающих оксидативный стресс, является общим патогенетическим механизмом в развитии физического перенапряжения, эмоциональных и поведенческих нарушений [1]. Показано, что при физическом перенапряжении в крови увеличивается число инициаторов свободно-радикального окисления [8], усиливается генерация свободных радикалов активных форм кислорода, перекисей липидов; снижается энергообеспечение клеток за счет процессов окислительного фосфорилирования [9].
В этой связи актуальной проблемой является направленный поиск фармакологических субстанций, обладающих способностью корригировать одновременно как процессы оксидативного, так и психоэмоционального стресса.
В Башкирском государственном медицинском университете (БГМУ) на протяжении многих лет ведется поиск биологически активных веществ среди новых производных пиримидина (ПП), в частности, синтезированных под руководством д.фарм.н. В. А. Катаева [2]. Пиримидины – шестичленные гетероциклы, имеющие плоскую молекулу с двумя атомами нитрогена, которые находятся в положении 1,3. Известно, что пиримидины (структурные элементы нуклеиновых кислот) обладают иммуномодулирующей активностью, которая направлена на все звенья системы иммунитета: факторы неспецифической защиты, клеточное и гуморальное. Помимо этого, они проявляют антикатаболические, анаболические, кардиотонические и гепатопротектерные свойства, таким образом, обладая патогенетической значимостью для выраженных иммунопротективных эффектов. Производные пиримидинов низкотоксичны и не накапливаются в организме, обладая при этом достаточно высокой скоростью выведения. Исследования, проведенные в Центральной научно-исследовательской лаборатории БГМУ, показали, что в ряду ПП, содержащих тиетановый цикл (тиетанурацилы – ТУ), есть соединения, обладающие высокой антиоксидантной активностью in vitro [4] и являющиеся перспективными соединениями для коррекции окислительного стресса in vivo [5]. Наряду с детальным изучением способности этих соединений корригировать процессы оксидативного стресса, также представляет интерес определение их способности к регуляции психоэмоционального стресса.
С учетом изложенного, целью нашего исследования явилось изучение влияния производных пиримидина и тиетанурацила на оксидативный и психоэмоциональный стресс у лабораторных животных.
Материалы и методы
В работе использованы новые производные пиримидина и тиетанурацила, синтезированные в Башкирском государственном медицинском университете, условно обозначенные под номерами: I (5-гидрокси-6-метилурацил), IX (5-гидрокси-6-метил-1-(тиетанил-3)урацил) , X (6-метил-5-морфолинометил-1) (тиетанил-3) урацил.
Эксперимент проводился на 50 белых нелинейных крысах массой 200–220 г. Животные подвергалась плавательной физической нагрузке (ФН) по методике, предложенной Рыловой М. Л. и Burgin et al [6,10]. Плавание максимальной длительности сопровождается тяжелой мышечной работой и не случайно служит наряду с другими неблагоприятными физическими и химическими факторами для создания у животных состояния психоэмоционального напряжения и оксидативного стресса. Животные были разделены на пять групп. Первая группа – интактные животные (контроль), вторая – ежедневно испытывала ФН, третья испытывала физическую нагрузку и получала субстанцию I (I+ФН), четвертая испытывала физическую нагрузку и получала соединение IX (IX+ФН), пятая подвергалась физической нагрузке и получала производное тиетанурацила (X+ФН). Соединения вводились внутрижелудочно в виде суспензии на 2 % крахмальной слизи в дозе 50 мг/кг в течение 24 дней.
О развитии стрессорных реакций судили по изменениям массы надпочечников и количества лейкоцитов периферической крови с помощью общепринятой методики [3].
Для оценки оксидативного стресса измеряли процессы перекисного окисления липидов (ПОЛ) в гомогенатах печени и мозга крыс, методом регистрации железоиндуцированной ХЛ [7] на приборе ХЛ-003 (Россия). Интегральными параметрами ХЛ являются светосумма свечения и максимальная интенсивность свечения: светосумма свечения (S) характеризует способность липидов к окислению, максимальная интенсивность свечения (I max) зависит от интенсивности накопления гидроперекисей липидов. Кроме того, интенсивность ПОЛ измеряли по содержанию одного из продуктов перекисного окисления –малонового диальдегида (МДА) как продукта, реагирующего с тиобарбитуровой кислотой (набор реактивов для определения ТБК-активных продуктов «АБК-Агат»).
Уровень психоэмоционального стресса определяли посредством оценки поведенческих реакций лабораторных животных в тесте открытое поле [6].
Статистическая обработка полученных результатов проводилась на персональном компьютере в программе «Statistica for Windows (release 10.0)». Рассчитывали среднее значение (М) и стандартную ошибку средней (m). Группы сравнивались при помощи t-критерия Стьюдента для независимых переменных и непараметрического критерия Манна – Уитни.
Результаты исследования
Изменение массы надпочечников является одним из показателей развития стрессорных реакций на фоне ФН. При ФН увеличивалась масса надпочечников, и возрастало общее количество лейкоцитов крови лабораторных животных (табл.1).
Таблица 1
Масса надпочечников и общее количество лейкоцитов крови лабораторных животных на фоне ФН и под влиянием ПП и ТУ
|
Масса надпочечников(г) |
Количество лейкоцитов (х109/л) |
|
|
Контроль |
0,034±0,007 |
4,152±1,706 |
|
ФН |
0,075±0,009* |
6,631±1,557*
|
|
ФН+I |
0,056±0,006 |
3,297±1,315
|
|
ФН+IX |
0,053±0,012 |
4,075±1,209
|
|
ФН+X |
0,038±0,012 |
2,76±1,075
|
Примечание: * – различия, достоверные с контрольной группой животных; (при р< 0,05).
При введении ПП и ТУ масса надпочечников сохранялось на уровне, близком к контролю. Физическая нагрузка приводила к росту количества лейкоцитов. На фоне введения ПП и ТУ количество лейкоцитов крови у лабораторных животных соответствовало таковым значениям интактных животных.
Физическая нагрузка вызывала у лабораторных животных усиление процессов ПОЛ, определяемое методом регистрации железоиндуцированной ХЛ и ТБК-активных продуктов. В гомогенатах печени лабораторных животных, подвергнутых ФН, наблюдалось увеличение светосуммы ХЛ по сравнению с интактными животными. Введение в течение 24 дней анализируемых субстанций препятствовало развитию реакций ПОЛ. Влияние исследуемых соединений на ХЛ гомогенатов печени и мозга и уровень ТБК-активных продуктов в гомогенатах мозга, печени представлены в таблице 2.
Таблица 2
Влияние субстанций на показатели хемилюминесценции в гомогенатах мозга и печени (условные единицы), ТБК-активных продуктов в гомогенатах мозга, печени
|
Группа |
ХЛ гомогената печени |
ХЛ гомогената мозга |
ТБК-активные продукты в печени (мкмоль/л) |
ТБК-активные продукты в мозге (мкмоль/л) |
||
|
S |
I max |
S |
I max |
|||
|
Контроль |
12,640 ±2,627 |
6,300 ±1,448 |
15,360 ±5,560 |
6,710 ±1,315 |
0,408 ±0,060 |
0,346 ±0,023 |
|
ФН |
15,730 ±3,256* |
10,460 ±3,29* |
47,170 ±3,741* |
19,330 ±0,089* |
0,486 ±0,095* |
0,554 ±0,141* |
|
ФН +I |
9,330 ±0,577 |
4,560 ±1,145 |
12,740 ±2,086 |
4,760 ±0,572 |
0,372 ±0,041 |
0,278 ±0,039 |
|
ФН +IX |
8,130 ±2,558 |
6,200 ±1,473 |
30,670 ±1,050* |
10,430 ±2,154* |
0,350 ±0,041 |
0,304 ±0,042 |
|
ФН +X |
24,860 ±2,975* |
7,630 ±0,379 |
5,870 ±0,551* |
5,230 ±0,306 |
0,312 ±0,055 |
0,292 ±0,061 |
Примечание: * – различия, достоверные с контрольной группой животных; (при р< 0,05).
Как видно из таблицы, введение субстанций животным снижало интенсивность ХЛ. Снижение светосуммы и максимальной светимости хемилюминесценции свидетельствует о том, что ПП обладают протективной способностью относительно образования перекисных липидных радикалов в ткани мозга и печени.
Результаты исследования оксидативного стресса в гомогенатах мозга и печени, полученные методом регистрации хемилюминесценции, в целом подтвердились при оценке содержания ТБК-активных продуктов, характеризующих состояние процессов перекисного окисления липидов. Уровень концентрации ТБК-активных продуктов (МДА) в гомогенатах печени и мозга животных, получавших ФН, увеличивался. Введение же ПП способствовало сохранению этого показателя на уровне контроля. Соединения I, IX и X препятствовали увеличению содержания МДА в тканях мозга и печени у животных.
Исследование психоэмоционального состояния лабораторных животных, получающих физическую нагрузку, выявило нарушение в структуре поведенческих реакций. Снижался коэффициент подвижности и уменьшалась общая ориентировосно-исследовательская активность. При этом росла эмоциональная тревожность. Применение ПП предохраняло животных от торможения поведенческих реакций, вызванных ФН. Под воздействием ПП и ТУ ориентировочно-исследовательская деятельность животных возрастала в сравнении с группой животных, получающих физическую нагрузку (рисунок).
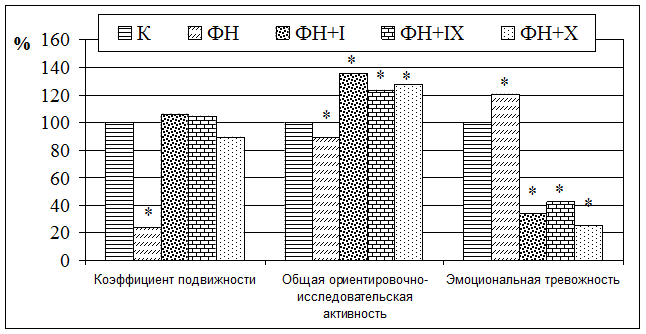
Изменение поведенческих реакций у лабораторных животных при физической нагрузке (ФН) под влиянием производных пиримидина (ПП)
Примечание: * – различия, достоверные с контрольной группой животных; (при р< 0,05).
Как видно по рисунку, после введения субстанций коэффициент подвижности сохранял значения контрольной группы, а общая ориентировочно-исследовательская активность возрастала: животные интенсивно перемещались по горизонтальной плоскости поля. Повысилось число заглядываний в норки. Одновременно снижалась эмоциональная тревожность.
Подводя итоги проведенного исследования, можно сделать следующее заключение. ФН вызывает развитие оксидативного стресса, отражающегося в усилении реакций ПОЛ в гомогенатах мозга и печени лабораторных животных. Введение ПП и ТУ снижает интенсивность ХЛ и ТБК реагирующих продуктов (МДА) в гомогенатах печени и мозга, что свидетельствует о замедлении ПОЛ. Модель ФН в эксперименте также вызывает психоэмоциональный стресс, сопровождаемый нарушением поведенческих реакций. Введение исследуемых ПП и ТУ лабораторным животным на фоне ФН сохраняет поведенческую активность.
Таким образом, исследуемые соединения предохраняют животных одновременно как от оксидативного, так и психоэмоционального стресса, обусловленных физической нагрузкой. Выявленные свойства исследуемых ПП и ТУ позволяют рассматривать их в качестве кандидатов в лекарственные средства для коррекции негативных последствий стрессорных воздействий.
Библиографическая ссылка
Петрова И.В., Катаев В.А., Баймурзина Ю.Л., Мочалов К.С., Фархутдинов Р.Р. ВЛИЯНИЕ ПРОИЗВОДНЫХ ПИРИМИДИНА И ТИЕТАНУРАЦИЛА НА ОКСИДАТИВНЫЙ И ПСИХОЭМОЦИОНАЛЬНЫЙ СТРЕСС У ЛАБОРАТОРНЫХ ЖИВОТНЫХ // Современные проблемы науки и образования. – 2016. – № 2. ;URL: https://science-education.ru/ru/article/view?id=24332 (дата обращения: 20.04.2024).



