Для эффективной коррекции ишемических и реперфузионных повреждений сердца необходимо создание транспортных систем для адресной доставки фармакологических препаратов в зоны повреждения.
Одним из направлений в этом аспекте является разработка транспортных контейнеров для фармацевтических препаратов на основе использования липосом. Одной из важнейших особенностей липосом является их способность накапливаться и оставаться в зонах инфаркта в результате проявления эффекта «пассивного нацеливания» [5].
Ранее нами было показано, что при гипоперфузии изолированного сердца во время тотальной нормотермической ишемии происходит накопление липосом в клетках миокарда, которые распределяются во внутриклеточных органеллах. Поглощение и внутриклеточное распределение липосом зависит от состава липидного состава наночастиц [2]. При изучении физиологических параметров миокарда показано, что эффект гипоперфузии изолированного миокарда липосомальными препаратами проявлялся в восстановлении сократительной и насосной функций сердца и восстановлении коронарного протока [3, 6]. Протективный эффект наблюдался не только при использовании липосом, нагруженных антиоксидантами, но и пустых липосом.
Так как липосомальные формы антиоксидантов на функциональном уровне проявляют выраженное протективное действие при реперфузионных повреждениях сердца, представляет интерес изучение этого эффекта на ультраструктурном уровне.
Цель работы: выявить характер ультраструктурных изменений в миокарде изолированного сердца крыс после ишемической гипоперфузии пустыми липосомами и липосомами нагруженными эмоксипином и дигидрокверцетином.
Материалы и методы
Приготовление липосом
Липидную часть липосом формировали из смеси яичного лецитина и холестерина в молярном отношении 7:5. Эмоксипин в виде водного раствора добавляли на этапе гидратации липидной пленки при получении мультиламелярных везикул. Липосомы готовили методом экструзии (экструдер Lipex Biomembranes Inc., Канада) с использованием поликарбонатных фильтров (Costar, США) с диаметром пор 30 нм. Перед использованием липосомы разбавляли физиологическим раствором до концентрации 10 мг/мл. Дигидрокверцетин добавляли в липидную смесь в концентрации 25 мг/мг липида.
Размер и заряд полученных частиц измеряли при помощи прибора Zetasizer Nano ZS90 (UK).
Перфузия изолированного сердца
Исследование проводили на изолированных сердцах крыс Wistar с массой тела 350±20 г. Для исключения влияния сезонных колебаний на устойчивость сердца к повреждающему действию ишемии-реперфузии, все эксперименты проводились в осенне-зимний период. Сердца извлекали у животных под этаминаловым наркозом (45 мг/кг) и помещали в «ледяной» (2-4°С) раствор Кребса-Хензеляйта до полной остановки спонтанных сокращений. Далее производили ретроградную перфузию сердца методом Langendorff в течение 10 мин перфузионным раствором, насыщенным карбогеном (95% О2+5% СО2) при 37°С. На 10 минуте перфузии регистрировали коронарный проток. Через 10 минут сердца подвергали 30-минутной нормотермической тотальной ишемии, во время которой осуществляли гипоперфузию изучаемыми препаратами со скоростью 0,1 мл/мин. После ишемии возобновляли перфузию по Langendorff. На 5 минуте реперфузии регистрировали объем коронарного протока. Затем сердца снимали с системы перфузии и использовали для ультраструкурных исследований. В качестве группы сравнения (ФР) использовали сердца с ишемической гипоперфузией физиологическим раствором. Сердца опытных групп гипоперфузировали «пустыми» липосомами (группа ПЛ), липосомами, содержащими эмоксипин (группа ЭМЛ), и липосомами с дигидрокверцетином (группа ДГЛ). Для группы контроля использовали сердца после 40 минутной непрерывной перфузии по Лангендорфу. Конечная концентрация липосом в среде для гипоперфузии составила 10 мг/л в пересчете на липиды. Концентрация эмоксипина и дигидрокверцетина в составе липосомальной композиции составляла 0,25 мг/мл.
В каждой группе использовали по 6 сердец.
Ультраструктурные исследования
По окончании ишемической экспозиции, выполняли 10 минутную реперфузию миокарда оксигенированным раствором Кребса-Хензеляйта. Затем сердце вновь помещали в «ледяной» раствор Кребса-Хензеляйта и после полной остановки сокращений отрезали верхушку миокарда. Выделенный фрагмент разрезали на кусочки объемом 1 мм3 и фиксировали в 3% растворе глутарового альдегида на 0,1М фосфатном буфере в течение 1,5 ч при температуре 4оС с постфиксацией в 1% растворе OsO4 на том же буфере в течение 1 ч 10 мин при 25о С. Обезвоживание проводили при комнатной температуре в восходящих концентрациях этанола. Затем пробы переносили в 100 % ацетон. Для заливки использовали эпоксидную смесь Аралдит (Fluka). Вначале образцы помещали в смесь Аралдит/ацетон (1:1) на 2 часа, а затем пропитывали смолой в течение 12 часов. После пропитки и переноса в свежую порцию смолы проводили полимеризацию при 60о С в течение 24 ч. Ультратонкие срезы изготавливали на ультратоме LKB-Nova (Щвеция), далее их контрастировали раствором уранила ацетата и цитратом свинца (по Рейнолдсу). Просмотр осуществляли в электронном микроскопе Libra 120 (Carl Zeiss) при ускоряющем напряжении 80 Кв в Центре коллективного пользования приборами и оборудованием "Высокие технологии и аналитика наносистем» НГУ.
Статистическую обработку полученных данных осуществляли с помощью программы Statistica 6.0. Рассчитывали средние значения и ошибку среднего. При статистической обработке использовали t-критерий Стьюдента; различия между величинами показателей считали достоверными при р<0,05.
Результаты и обсуждение
Размер и заряд липосом
Полученные липосом имели средний диаметр частиц 67 нм и zeta-потенциал поверхности – 2,62 мВ.
Коронарный проток
Таблица 1
Объем коронарного протока сердца (М±m): исходные значения (Исх) и на 5 минуте реперфузии (РП)
|
Группы |
||||
|
ФР |
ПЛ |
ЭМЛ |
ДГЛ |
|
|
Исх. |
11,0±0,6 |
11,4±0,5 |
11,6±0,7 |
11,0±0,5 |
|
РП |
4,5±0,3*+ |
14,0±0,4*+ |
16,1±0,7*+ |
15,4±0,5*+ |
*- р<0,05 по сравнению с ФР, +- р<0,05 по сравнению с исходными значениями.
Через 30 минут ишемической реперфузии физиологическим раствором на 5 мин реперфузии наблюдали снижение объема коронарного протока приблизительно на 41% относительно исходных значений (табл. 1). В случае гипоперфузии липосомальными препаратами наблюдали противоположный эффект – достоверное увеличение коронарного протока.
Мофологические изменения после ишемической гипоперфузии и репефузии
Группа контроль
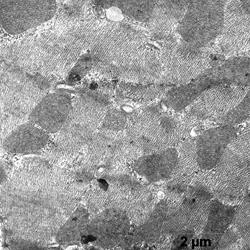
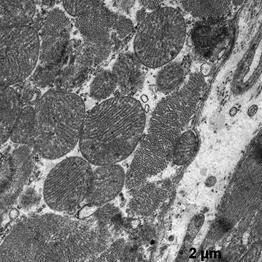
Электронномикроскопическое исследование кардиомиоцитов крыс в группе показало: в кардиомиоцитах фибрилы упорядочены относительно продольной оси клеток, между которыми располагаются плотно упакованные конгломераты митохондрий, в основном округлой и овальной формы (рис. 1). В саркоплазме, между митохондриями и миофибрилами, а также между филаментами видны везикулы незернистой саркоплазматической сети. Трубочки Т-системы на продольных срезах располагаются на уровне Z- полос, к ним с двух сторон примыкают цистерны саркоплазматической сети (рис. 1а, б). В околоядерной зоне находится большое количество митохондрий с поперечными кристами и везикулы саркоплазматической сети. Ядра кардиомиоцитов, большей частью, овальной формы с небольшими инвагинациями ядерной мембраны. Гетерохроматин расположен тонким слоем вдоль нуклеолеммы, а также равномерно распределяется в виде глыбок по всей нуклеоплазме. У полюсов ядер располагается комплекс Гольджи, представленный вытянутыми цистернами, мелкими пузырьками и вакуолями. В большей части в области комплекса Гольджи, реже в саркоплазме встречаются единичные секреторные гранулы на разных стадиях созревания (рис.1б).

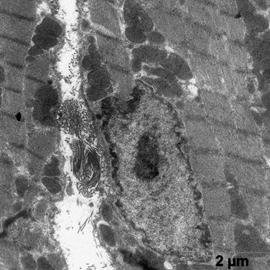
а б
Рис.1. Ультраструктура миокарда в группе контроль
Группа ФР
Ультраструктурные изменения клеток после ишемической гипоперфузии физиологическим раствором носили мозаичный характер: на одном и том же образце наблюдали участки с хорошей сохранностью ткани и участки с высокой степенью тканевой деструкции. В этих участках наблюдали значительное расширение цистерн эндоплазматического ретикулума с их частичной деструкцией, глыбчатый распад миофибрилл, анизотропия дисков, повреждение Z-полос саркомерв. В Т-системе наблюдалось увеличении общего количества канальцев и цистерн. Ядра клеток приобретали полигональную форму, хроматиновые глыбки были крупнее по сравнению с контрольной группой и располагались в виде ободка вблизи кариолеммы (рис. 2а). Появляются просветлённые участки цитоплазмы между миофибриллами (рис. 2б). Миофибриллы расположены более рыхло. Наблюдаются группы гранул, различной плотности (рис. 2а, б). Митохондрии приобретали округлую форму и содержали электронно-плотные включения. У единичных митохондрий наблюдали появление спирально расположенных крист (рис. 2в). В цитоплазме клеток присутствовали многочисленные лизосомы различной плотности, что свидетельствует о напряжении обменных процессов.
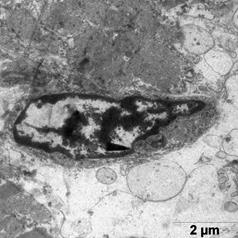

а б
в
Рис. 2. Ультраструктура миокарда послу ишемической гипоперфузии пустыми липосомами
Группа ПЛ.
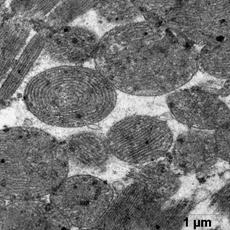
Ультраструктурные изменения клеток в этой группе были менее выражены относительно группы ФР. Отмечена высокая сохранность митохондрий - их формы и расположения крист, наличие плотного матрикса (рис.3а). В некоторых клетках наблюдали отдельные митохондрии с признаками набухания.
Отмечали незначительное расширение энтоплазматического ретикулума вблизи Т-системы, без его деструкция.
После ишемической гипоперфузии пустыми липосомами, по сравнению с контрольной группой, наблюдали расширение перикапилярного пространства (рис. 3 б).
В цитоплазме клеток эндотелия наблюдали большое количество вакуолей и микропиноцитозных пузырьков с различной электоронной плотности, что является свидетельством интенсификации процессов выведения (рис. 3 б).
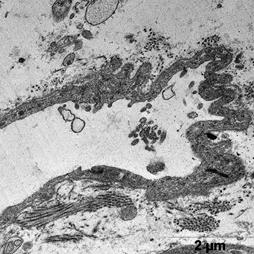
а б
Рис. 3. Ультраструктура миокарда после ишемической гипоперфузии пустыми липосомами
Группа ДГЛ
В этой группе отмечена меньшая ультраструктурная сохранность клеток миокарда, по сравнению с группой ПЛ. Наблюдали участки разрушения крист в митохондриях (рис. 4а, б). Ядра кардиомиоцитов приобретали неправильную полигональную форму с увеличенным количеством хроматина, который располагался по периметру кариолеммы (рис. 4в). Кроме того, отмечено появление глыбок хроматина внутри ядра. В клетках хорошо развит зернистый эндоплазматический ретикулум, что свидетельствует о синтетической их активности.
Наблюдаемое усиление пиноцитоза в эндотелии капилляров (рис. 4б, в), указывает на напряжение обменных процессов.

а б
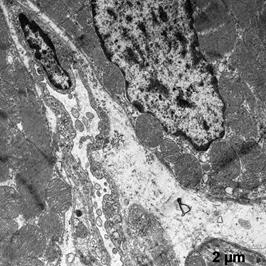
в
Рис. 4. Ультраструктура миокарда после ишемической гипоперфузии липосомами с дегидрокверцетином
Группа ЭМЛ
В этой группе наблюдали появление ядер округлой полигональной формы с множеством ламел, с большими активными ядрышками, большим количеством хроматина расположенного широкой полосой под кариолеммой, внутривенная часть ядра также содержала плотный хроматин (рис. 5а, б). Отмечены многочисленные рибосомы в виде отдельных конгломератов и в составе развитого зернистого ЭПР (рис 5а). Часто встречались лизосомы разной плотности, много митохондрий с разрушенными кристами (рис 5а). Отмечаются скопления секреторных гранул натрийуретического пептида на сосудистых полюсах, что свидетельствует об активации секреторной активности данных клеток (рис. 5в). Наблюдали очаги набухания в цитоплазме с элементами дефрагментации (рис. 5г). Филаменты более рыхлые и менее электронно-плотные. В цитоплазме эндотелиальных клеток наблюдали появление пиноцитозных пузырьков.
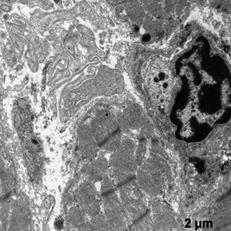
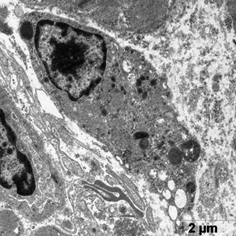
а б
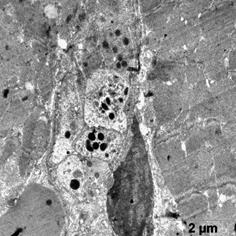
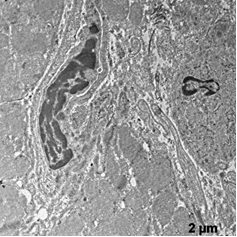
в г
Рис. 5. Ультраструктура кардиомиоцитов после ишемической гипоперфузии липосомами с эмоксипином
Представленные результаты указывают на отсутствие прямой зависимости между уровнем ультраструктурной сохранности миокарда и функциональной активностью сердца при реперфузии. Так, ранее было показано, что, в отношении сократительной активности, липосомальные композиции с антиоксидантами обладают более выраженным защитным эффектом по сравнению с пустыми липосомами [3]. Однако на ультраструктурном уровне в группе ПЛ наблюдали наилучшую сохранность субклеточных структур по сравнению с группами ЭМЛ и ДГЛ.
Известно, что ультраструктурные изменения кардиомиоцитов коррелируют с биохимическими и физиологическими показателями работы сердца как органа [1, 4, 7]. Однако характер корреляции может иметь как прямую зависимость, так и обратную. Такая реакция может быть обусловлена сложностью протекающих процессов имеющих различные временные характеристики. Биохимические и физиологические реакции клеток протекают одновременно с морфологическими перестройками и тесто взаимосвязаны между собой, но их скорость значительно выше, чем изменения ультраструктуры. В нашем случае худшая структурная сохранность клеток в группах ДГЛ и ЭМЛ, относительно ПЛ, может рассматриваться как морфологическое отражение более интенсивной работы миокарда и большей функциональной нагрузкой на клетки в период реперфузии.
Таким образом, полученные результаты показали, что ультраструктурные перестройки клеток миокарда при ишемической гипоперфузии сердца с последующей реперфузией зависят от состава липосомальной композиции.
Библиографическая ссылка
Мухамадияров Р.А., Сергеевна Е.А., Зинчук С.Ф., Зинчук В.Г., Плотников М.Б. ВЛИЯНИЕ ИШЕМИЧЕСКОЙ ГИПОПЕРФУЗИИ ИЗОЛИРОВАННОГО СЕРДЦА ПУСТЫМИ ЛИПОСОМАМИ И ЛИПОСОМИ С АНТИОКСИДАНТАМИ НА УЛЬТРАСТРУКТУРУ МИОКАРДА // Современные проблемы науки и образования. – 2016. – № 2. ;URL: https://science-education.ru/ru/article/view?id=24357 (дата обращения: 20.04.2024).



