В настоящее время большая подкожная вена (БПВ) остается наиболее востребованным сосудом, используемым в качестве коронарного шунта во время операций прямой реваскуляризации миокарда [3].
Для операции аортокоронарного шунтирования (АКШ) необходимо использовать участки большой подкожной вены бедра (БПВ) без фиброзно-стенотических и дилатационных изменений [1; 2]. Интраоперационно выявить такие участки достаточно сложно, и нет возможности оценить внутрипросветные изменения в эксплантируемой вене. Современное ультразвуковое исследование позволяет избежать этих негативных моментов и воздержаться от эксплантации некачественных участков вен [4; 5]. В конечном итоге такие подходы позволяют использовать участки БПВ с качественными нативными свойствами, что обеспечивает более длительное функционирование венозных шунтов (ВШ) у больных с ИБС. Определение УЗИ-параметров, определяющих хорошее качество будущего ВШ, является актуальной научной и клинической задачей.
Цель
Оптимизация выбора качественных участков аутовен для КШ.
Материалы и методы
В соответствии с поставленной целью с 2015 по 2016 год в ФЦСХХ г.Челябинск выполнялась ультразвуковая оценка БПВ перед их эксплантацией для КШ у 50 пациентов. Средний возраст пациентов был 63,7±1,3 года, среди них было 40 мужчин и 10 женщин. У всех пациентов было многососудистое поражение коронарного русла с критическими проявлениями ИБС, подтвержденное ангиографическими исследованиями. Конкурирующих сопутствующих патологий у больных не было. Всем пациентам планировалось выполнение КШ в условиях искусственного кровообращения с использованием аутоартериальных и аутовенозных шунтов. Кроме клинической оценки БПВ (венозный анамнез, осмотр, пальпация), был использован УЗИ-метод оценки их качества с помощью цифрового ультразвукового сканера Acuson X 300 с использованием конвексного мультичастотного датчика, работающего в диапазоне 2,5-5 Мгц, и линейного мультичастотного датчика, работающего в диапазоне 5-10 Мгц (или на ультразвуковом сканере экспертного уровня Philips IU 22 с использованием конвексного мультичастотного датчика, работающего в диапазоне 1,5-5 МГц и линейного мультичастотного датчика, работающего в диапазоне 3-9 МГц). Данные приборы позволяли проводить исследование в реальном масштабе времени с получением изображения в режимах серой шкалы, спектральной доплерографии, цветного доплеровского картирования потоков крови и энергетического доплера.
Основными задачами ультразвуковой диагностики являлись: определение проходимости вен, получение информации о варианте строения венозного русла нижних конечностей, получение характеристик сосудистой стенки и просвета вены, оценка строения и функции венозных клапанов, измерение диаметра вен, регистрация патологических вено-венозных сбросов, разметка БПВ.
Для определения шунтопригодности большой подкожной вены (БПВ) при ультразвуковом исследовании (УЗИ) в обязательном порядке оценивали такие параметры, как: ангиоархитектоника, наличие внутрипросветных включений, диаметр, толщина и структура стенки, состояние клапанного аппарата. В обязательном порядке исследовали структуру окружающих тканей.
Наиболее важными ультразвуковыми критериями, позволяющими сделать заключение о возможности забора БПВ в качестве материала для аортокоронарного шунтирования, являлись следующие:
- отсутствие врожденных аномалий развития магистральных глубоких вен нижних конечностей, БПВ и её крупных ветвей, других ангиодисплазий (гемангиомы и т.д.);
- проходимость магистральных глубоких вен (окклюзия и значительное ограничение проходимости магистральных глубоких вен являются противопоказанием для операций на поверхностных венах);
- проходимость БПВ (просвет вены должен быть изначально свободный от любых дополнительных включений - тромбов, флеболитов, соединительнотканных тяжей и перегородок и т.д.);
- прямолинейность хода БПВ (извитость вены, наблюдающаяся чаще всего при варикозной болезни, повышает риск тромбоза шунта в ближайшем послеоперационном периоде);
- диаметр БПВ не менее 2,0 мм и не более 4,0 мм (при АКШ очень важна сопоставимость диаметра коронарной артерии и используемого для ревакуляризации венозного шунта - слишком маленький диаметр вены может не обеспечить потребности миокарда в кислороде, а слишком большой диаметр вены, помимо технических трудностей при наложении анастомоза с артерией меньшего диаметра, создает условия для тромбоза шунта в ближайший послеоперационный период);
- отсутствие каких-либо изменений структуры стенки БПВ (различных локальных и протяженных утолщений, постфлебитических признаков и т.д.);
- отсутствие изменений структуры окружающих БПВ тканей (выявление признаков отека, липодерматосклероза подкожной клечатки, рубцовых изменений и т.п. может стать препятствием для резекции вен).
Обследование вен нижних конечностей проводили в горизонтальном и вертикальном положении пациента для выявления трудно фиксируемых патологических венозных сбросов. Исследование венозной системы выполнялось на всем протяжении и не ограничивалось зонами стандартных диагностических точек. Обязательным условием было обследование обеих нижних конечностей. Для визуализации основного ствола большой подкожной вены на бедре и голени ультразвуковой датчик смещали в дистальном направлении по медиальной поверхности бедра до коленного сустава, а затем по медиальной поверхности голени до медиальной лодыжки. Исследование периферической венозной системы включало оценку изменений кровотока под действием функциональных проб. Проба дистальной (по отношению к уровню сердца) компрессии была направлена на оценку проходимости участка вены между зоной компрессии и зоной локации. В случаях проходимости вены, в ответ на компрессию при исследовании в цветовом доплеровском режиме происходило усиление цветового заполнения просвета (в спектральном доплеровском режиме отмечалось возрастание амплитуды кровотока, соответствующее моменту компрессии). При полной обструкции просвета вены подобного возрастания не происходило.
В процессе исследования мы проводили маркировку на коже проекции хода БПВ на бедре и голени с целью облегчения её выявления и выбора места доступа к ней для последующей качественной её эксплантации.
Результаты
С помощью ультразвука в предоперационном периоде нами было изучено 400 сегментов БПВ у 50 больных. В отличие от клинических приемов, ультразвуковое исследование позволило выявить у пациентов 130 (32,5%) аномалий строения БПВ. Морфология изменений строения БПВ подробно представлена в таблице.
|
Область |
Аномалия |
Количество |
|
Проксимальная часть бедра |
Норма |
78 |
|
Проксимальная часть бедра |
Удвоение ствола БПВ |
18 |
|
Проксимальная часть бедра |
Малый диаметр |
4 |
|
Проксимальная часть бедра |
Рассыпной тип строения |
0 |
|
Дистальная часть бедра |
Норма |
74 |
|
Дистальная часть бедра |
Удвоение ствола БПВ |
16 |
|
Дистальная часть бедра |
Малый диаметр |
10 |
|
Дистальная часть бедра |
Рассыпной тип строения |
0 |
|
Проксимальная часть голени |
Норма |
45 |
|
Проксимальная часть голени |
Удвоение ствола БПВ |
40 |
|
Проксимальная часть голени |
Малый диаметр |
12 |
|
Проксимальная часть голени |
Рассыпной тип строения |
3 |
|
Дистальная часть голени |
Норма |
73 |
|
Дистальная часть голени |
Удвоение ствола БПВ |
15 |
|
Дистальная часть голени |
Малый диаметр |
9 |
|
Дистальная часть голени |
Рассыпной тип строения |
3 |
Наиболее часто встречающейся аномалией строения БПВ было удвоение основного ствола аутовены в 22,25% случаев.Следующим по частоте встречаемости был малый диаметр БПВ у 8,75% больных, и рассыпной тип строения встречался в 1,5% случаев. Аномалии развития БПВ по большей части наблюдались в проксимальной части голени и составили 42,31%, в дистальной трети голени 20,77%, в проксимальном отделе бедра 16,92%, в дистальной части бедра - 20%.
Ультразвуковые особенности диагностики удвоения магистрального ствола БПВ и малого её диаметра представлены на рисунках 1, 2.
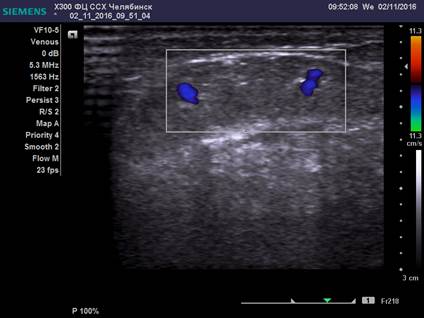
Рис. 1. Ультразвуковая картина удвоения ствола БПВ
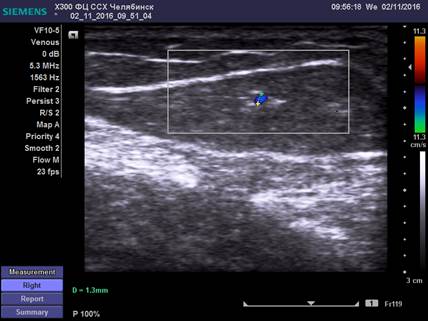
Рис. 2. Ультразвуковая картина малого (неадекватного) диаметра БПВ
Это нам позволило выбрать у всех больных качественные участки БПВ достаточной длины, качества стенок и адекватного её диаметра на протяжении одной конечности.
Обсуждение
В итоге такой метод исследования позволил в дооперационном периоде выявить неподходящие для КШ участки БПВ, тем самым обеспечив эксплантацию качественных по нативным свойствам аутовен для КШ. Эксплантированные на основании этих методик фрагменты БПВ были использованы при операции АКШ у 50 пациентов. Полученные нами данные подтверждают необходимость дальнейших исследований по выбору максимально благоприятных участков подкожных вен для коронарного шунтирования, что согласуется с мнением и других авторов [2; 4].
Выводы:
1. Клинические методы не позволяют достаточно точно определить пригодные для КШ участки БПВ.
2. Аномальные участки БПВ по УЗИ-параметрам не следует использовать в качестве коронарного шунта.
3. У больных ИБС, которым при АКШ планируется использование аутовен, необходимо проводить УЗИ-исследование БПВ по предложенным нами параметрам.
Библиографическая ссылка
Семагин А.А., Леонтьев С.Н., Андриевских И.А. ОСОБЕННОСТИ УЛЬТРАЗВУКОВОГО ОПРЕДЕЛЕНИЯ КАЧЕСТВЕННЫХ УЧАСТКОВ БОЛЬШОЙ ПОДКОЖНОЙ ВЕНЫ БЕДРА ДЛЯ АОРТОКОРОНАРНОГО ШУНТИРОВАНИЯ // Современные проблемы науки и образования. – 2016. – № 6. ;URL: https://science-education.ru/ru/article/view?id=25613 (дата обращения: 18.04.2024).



