Кальцитониноциты (С-клетки) являются производными нейробластов, мигрирующих в фарингеальную эктодерму IV жаберных карманов, а оттуда – в паренхиму медиального зачатка развивающейся щитовидной железы (ЩЖ) [8]. Это обуславливает их локализацию, компактное расположение, формирование объединений (в литературе используются равнозначные термины – группы, комплексы, кластеры) [11]. Впоследствии под воздействием ряда факторов, в том числе локальной функциональной активности, происходит их диффузное распространение по всей паренхиме органа, с преобладанием в его центральной части [13].
Парафолликулярные клетки лежат одиночно или группами среди фолликулярных клеток [6], имеют индивидуальные морфологические различия, связанные с возрастом и полом, как у человека, так и у животных [4; 10].
Секреторные гранулы, заполняющие цитоплазму парафолликулярных клеток, обнаруживают сильную осмиофилию и аргирофилию и бывают двух типов: мелкие и более крупные. С-клетки синтезируют тиреокальцитонин и ряд биологических аминов, оказывающих аутокринное влияние на функцию кальцитониноцитов и паракринное действие на тироциты и сосуды ЩЖ [9]. Одним из показателей функциональной активности С-клеток является уровень заполненности и особенности расположения аргирофильных секреторных гранул, которые изменяются при экспериментальных воздействиях [3; 5].
Парафолликулярные клетки и тироциты составляют единую систему, контролирующую внутриорганный гомеостаз [2; 7], и, наряду с тканевыми базофилами, выступают в роли интратиреоидных гуморальных регуляторов.
Взаимоотношения между популяциями клеток железы носят сложный характер и лежат в основе формирования нормального и патологических состояний [14].
Цель: дать сравнительную характеристику парафолликулярных эндокриноцитов щитовидной железы собак при различных режимах бега, моделирующих морфофункциональные преобразования органа.
Материалы и методы
Объектом исследования являлась центральная часть правой доли ЩЖ собак-самцов в возрасте от 1,5 до 2 лет. Измерения проводили на поперечном срезе парафин-целлоидиновых блоков (фиксатор 10%-ный нейтральный формалин) толщиной 3 мкм, изготовленных с помощью роторного микротома (ERM-230L) после постановки иммуногистохимической окраски поликлональными антителами к кальцитонину (Dako Inc.). По позитивной реакции гранул цитоплазмы идентифицировали парафолликулярные эндокриноциты. Кальцитониноциты при данном методе окрашивания имели полигональную или округлую форму и были заполнены гранулами интенсивно темно-коричневого цвета с местом просветления в области локализации ядра. С-клетки располагались единично или формировали объединения, занимающие порой значительную часть поля зрения.
Захват кадров (микроскоп «Lеika DMLS», камера «ССВ Camera DIGITAL Kocom», ув. 400) проводился с учетом топографии всего среза относительно его геометрического центра в центральной, промежуточной и периферических зонах [1].
Измерениям предшествовало качественное описание С-клеток: положение клеток или их объединений относительно фолликулов (интра-, интер- и парафолликулярное) [6], количественный состав объединений (минимальное, среднее и максимальное число клеток в группе); полуколичественным методом (коэффициент гистосчета, H-Score) в парафолликулярных клетках определялось количество гранул. С этой целью формировалась 4-балльная шкала (0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное, 4 – очень сильное окрашивание). Коэффициент гистосчёта (McCarthy K.S. et al., 1985) Histochemical score = ∑P(i)*i, где i – интенсивность окрашивания, выраженная в баллах от 0 – 4, Р (i) – процент клеток, окрашенных с разной интенсивностью [12].
В графическом редакторе Adobe Photoshop проводилась обработка полученных кадров с удалением артефактов и выделением единичных клеток или их объединений. Морфологические показатели парафолликулярных клеток – площадь сечения и среднюю оптическую плотность гранул – определяли в программе ImageJ [1] после геометрической и фотометрической калибровки.
Из общего массива клеток среза для сравнительной характеристики функциональной активности дополнительно анализировались как единичные клетки, расположенные обособленно с хорошо видимой границей цитоплазмы, так и их объединения в случае, когда количество клеток было равно или превышало среднегрупповые значения. При этом количество измеренных единичных клеток было сопоставимо с количеством выделенных кластеров.
Животные содержались в виварии на стандартном рационе питания сроком не менее одного месяца, при этом фиксировалась продолжительность светового дня, температура окружающей среды.
Контрольная группа представлена 16 животными. Экспериментальная группа получала однократные и многократные нагрузки (бег на ленте тредмила со скоростью 15 км/час) при динамическом контроле частоты сердечных сокращений (ЧСС).
В контрольной группе средняя ЧСС составила 125±6,92 уд/мин.
Однократные нагрузки представлены тремя видами воздействий: тренирующего характера – 8 животных, время бега 27,76±4,67 мин, ЧСС 205±10,15 уд/мин; стартового характера – 12 собак, время бега 8,25±0,73 мин при ЧСС 201±13,47 уд/мин; предельными нагрузками – 14 животных, время бега 73,14±14,97 мин, ЧСС 191±6,41 уд/мин.
Многократные воздействия были в виде циклов тренировки, каждый из которых состоял из тренирующих (первый этап) и стартовых нагрузок (второй этап), и представлены тремя группами. Первая группа (12 животных) – общее количество нагрузок 23,25±0,66 – после первого этапа тренирующих индивидуально дозированных двигательных нагрузок (ИДДН) (время бега 45,64±1,83 мин, ЧСС 169±1,85 уд/мин) получала воздействия стартового характера (время бега 11,81±0,38 мин, ЧСС 168±3,30 уд/мин). Во второй группе (10 собак) – общее количество нагрузок 55,50±2,45 – тренирующими нагрузками и стартовыми ИДДН моделировали последовательно три цикла воздействий – время бега 64,02±3,4 мин и ЧСС 168±2,35 уд/мин (при стартовых нагрузках среднее время 10,4±0,27 мин, ЧСС 172±2,38 уд/мин). В третьей группе у 11 животных формировали четыре цикла – общее количество нагрузок 70,54±2,52 – время бега 71,3±2,56 мин при средней ЧСС 173,59±2,56 уд/мин (среднее время бега при стартовых нагрузках составляло 9,85±0,25 мин, ЧСС 183,33±2,57 уд/мин).
В программе Statistica StatSoft, Inc., ver.10 получали данные описательной статистики и непараметрическими критериями (U-критерий Манна-Уитни и ранговая корреляция Спирмена) проводили сравнение показателей (площади, средней оптической плотности гранул, коэффициента гистосчета) разных групп.
Результаты исследования и их обсуждение
Для животных контрольной группы общее количество С-клеток составляло 807±149 штук на препарат. Из них единичные клетки представлены 26,08%, а объединения клеток 73,92%, что в абсолютных значениях составило 210±28 и 597±130 клеток соответственно. Среднее число клеток в кластере – 4,62±0,28, максимальное количество клеток в кластере у разных животных различалось и составляло от 6 до 63 штук (таблица 1).
Однократные тренирующие нагрузки приводили к увеличению доли одиночно расположенных клеток, что сопровождалось уменьшением среднего и максимального количества клеток в кластерах. При стартовых и предельных однократных нагрузках эта зависимость не столь выражена. Доля единичных клеток у первой и второй групп при многократных воздействиях приближается к показателям контроля и отличается только в группе с самым длительным периодом тренировок (многократные 3 – общее количество нагрузок 70,54±2,52), однако тенденция уменьшения среднего количества клеток в кластере сохраняется, их максимальное количество в группе также снижается.
Таблица 1
Количество, процентное содержание и соотношение единичных кальцитониноцитов и их комплексов (X¯±S X¯ )
|
Группы |
Общее количество С-клеток, ед. |
Единичные С-клетки, ед. |
Комплексы С-клеток, ед. |
Отношение единичных клеток и С-комплексов (%) |
Кол-во клеток в кластере (среднее) |
Кол-во клеток в кластере (максим.) |
|
Контроль (n=16) |
807±149 |
210±28 |
597±130 |
26:74 |
4,62±0,28 |
63 |
|
Тренирующие нагрузки (n=8) |
219±94 |
88±27 |
149±71 |
37:63 |
3,04±0,31 |
31 |
|
Стартовые нагрузки (n=12) |
408±88 |
120±20 |
287±69 |
29:71 |
3,52±0,23 |
23 |
|
Предельные нагрузки (n=14) |
772±107 |
191±23 |
581±89 |
29:70 |
4,25±0,23 |
45 |
|
Многократные 1 (n=12) |
411±135 |
102±31 |
308±110 |
25:75 |
3,83±0,21 |
37 |
|
Многократные 2 (n=10) |
735±211 |
200±38 |
535±184 |
25:75 |
3,56±0,26 |
54 |
|
Многократные 3 (n=11) |
654±140 |
280±60 |
375±86 |
43:57 |
3,8±0,23 |
35 |
Топографически единичные С-клетки относительно фолликулов располагались преимущественно интра– и интерфолликулярно, тогда как подавляющее большинство объединений клеток находится интерфолликулярно.
При ИДДН, в основном при однократных воздействиях, уменьшалось количество клеток, выявленных в интрафолликулярном положении, но увеличивалась их интерфолликулярная локализация, в отношении объединений клеток существенной динамики не выявлено.
На графике 1 представлено соотношение кластеров с различным количеством клеток у животных всех групп. Во всех экспериментальных группах наиболее часто встречаются кластеры из двух или трех клеток. Как среднее (4,62±0,28 клетки), так и максимальное (более 12 клеток) количество клеток в конгломератах ЩЖ группы контроля превышало показатели экспериментальных животных. При однократных воздействиях чаще встречаются объединения двух клеток, при многократных воздействиях характеристика объединений (их процентное соотношения) с небольшим количеством клеток приближается к показателям контроля.
Итак, в результате различных режимов двигательной активности изменяется топографическое положение относительно фолликулов как единичных клеток, так и их комплексов, чаще встречаются небольшие кластеры клеток (2-4), С-комплексы с большим количеством клеток наблюдаются реже.
Средняя площадь сечения единично расположенных С-клеток составила 110 (92-135) мкм2, средняя оптическая плотность гранул в них 0,37 (0,29-0,48) усл. ед. (таблица 2). После однократных воздействий тренирующего характера (время бега 27,76±4,67 мин) отмечено уменьшение площади, занимаемой кальцитониноцитами, до 89 (68-107) мкм2 (p<0,05), но повышение оптической плотности гранул в них 0,69 (0,52-0,84) усл. ед. (p<0,01). При стартовых нагрузках площадь сечения клеток не изменялась 110 (96-133), непродолжительный бег (8,25±0,73 мин) приводил к увеличению оптической плотности гранул парафолликулярных эндокриноцитов 0,61 (0,45-0,87) усл. ед. (p<0,01). В группе с предельными нагрузками (среднее время бега 73,14±14,97 мин) наряду с уменьшением площади сечения клеток 94 (66-127) мкм2 (p<0,01) максимально выражена их дегрануляция 0,46 (0,35-0,64) усл. ед. (p<0,05).
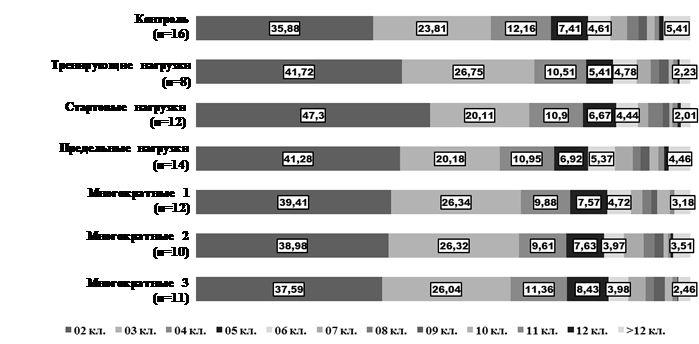
График 1. Характеристика объединений клеток у животных разных групп (%)
Многократные нагрузки приводили к повышению функциональной активности одиночных С-клеток: увеличение площади и/или средней оптической плотности. В первой группе животных, которые после цикла тренирующих воздействий получали нагрузки стартового характера, увеличивались как площадь клеток 125 (110-149) мкм2, так и оптическая плотность гранул 0,68 (0,48-1,01) усл. ед. После длительных тренирующих воздействий (вторая и третья группа) площадь сечения клеток составляла 127 (101-149) и 101 (78-122) мкм2. При этом чем продолжительнее цикл тренировок, тем ниже (p<0,05) средняя оптическая плотность (таблица 2).
Общая площадь комплексов С-клеток и их средняя оптическая плотность в экспериментальных группах зависела от количества клеток в кластерах (таблица 2).
Наши исследования показали, что различные мышечные нагрузки приводили к увеличению функциональной активности кальцитониноцитов, причем характер воздействия определял способы реагирования клеток как за счет увеличения площади, так и оптической плотности или сочетания этих признаков. Выявлено, что средняя оптическая плотность у комплексов всегда ниже, чем у одиночно расположенных клеток.
Таблица 2
Площадь сечения и средняя оптическая плотность единичных кальцитониноцитов, их комплексов и группы в целом, Me (Q1–Q3)
|
Группы |
Площадь сечения единичных С-клеток, мкм2 |
Оптическая плотность единичных С-клеток, усл. ед. |
Площадь сечения комплексов С-клеток, мкм2 |
Оптическая плотность комплексов С-клеток, усл. ед. |
Площадь сечения С-клеток, мкм2 |
Оптическая плотность С-клеток, усл. ед. |
|
Контроль (n=16) |
110 (92-135) |
0,37 (0,29-0,48)* |
828 (604-1216) |
0,31 (0,26-0,40)* |
116 (70-222) |
0,28 (0,21-0,36) |
|
Тренирующие нагрузки (n=8) |
89## (68-107) |
0,69# (0,52-0,84)* |
552# (302-774) |
0,38# (0,30-0,45)* |
66# (33-114) |
0,31 (0,23-0,41) |
|
Стартовые нагрузки (n=12) |
110 (96-133) |
0,61# (0,45-0,87)* |
731# (549-967) |
0,43# (0,32-0,52)* |
96# (56-162) |
0,44# (0,34-0,65) |
|
Предельные нагрузки (n=14) |
94# (66-127) |
0,46# (0,35-0,64)* |
785 (611-1003) |
0,33 (0,24-0,47)* |
140 (89-267) |
0,28 (0,22-0,37) |
|
Многократные 1 (n=12) |
125# (110-149) |
0,68# (0,48-1,01)* |
1008 (689-1390) |
0,36# (0,34-0,41)* |
142 (88-243) |
0,40# (0,33-0,51) |
|
Многократные 2 (n=10) |
127# (101-149) |
0,61# (0,45-0,87)* |
921# (661-1329) |
0,30 (0,20-0,41)* |
123## (70-219) |
0,38# (0,30-0,55) |
|
Многократные 3 (n=11) |
101# (78-122) |
0,52# (0,44-0,61)* |
972## (710-1289) |
0,43# (0,35-0,49)* |
99# (57-178) |
0,37## (0,30-0,46) |
p<0,05 * - в пределах группы между единичными клетками и комплексами; p<0,01 # - отличия от контроля; p<0,05 ## - отличия от контроля.
Ранговые корреляции Спирмена между площадью сечения, занимаемой клеткой или их комплексом, и средней оптической плотностью для единичных клеток (всего 1066) составили 0,01 (p>0,05), а для объединений клеток (939 комплексов) -0,22 (p <0,05). По отдельным группам животных данные представлены в таблице 3.
Проведен сравнительный анализ оптической плотности единичных клеток и их объединений. Для всех групп животных выявлены достоверные отличия (U-критерий Манна-Уитни, p <0,05) средней оптической плотности (график 2).
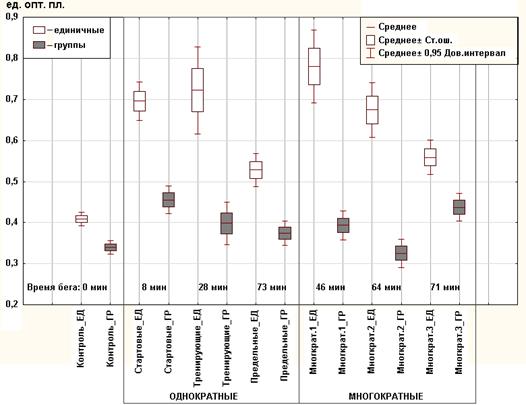
График 2. Средняя оптическая плотность кальцитониноцитов единичных клеток (ЕД), их объединений (ГР)
Полуколичественный метод оценки представительства гранул в клетке – коэффициент гистосчёта – представлен на графике 3.
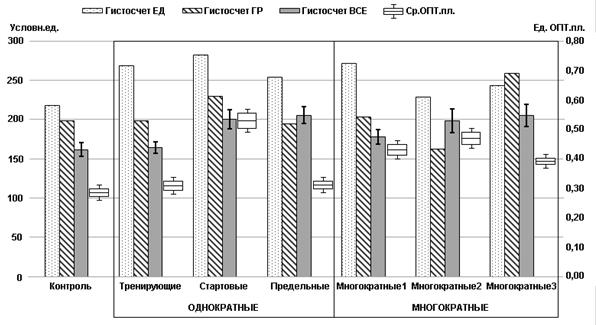
График 3. Коэффициент гистосчета единичных кальцитониноцитов (ЕД), их объединений (ГР), группы (ВСЕ) в целом и средней оптической плотности
При сравнении полуколичественных (коэффициент гистосчета) и количественных (средней оптической плотности) показателей выявлено, что у всех групп животных коэффициент гистосчета единичных клеток достоверно (p<0,05) связан с показателем средней оптической плотности (сила связи от 0,57 до 0,75). Для объединений клеток данная зависимость выявлялась не всегда или была менее выражена (сила связи от 0,33 до 0,60) (таблица 3).
Таблица 3
Корреляции между площадью сечения, средней оптической плотностью, коэффициентом гистосчета для единичных клеток и их объединений
|
Группы |
Площадь – средняя оптическая плотность единичных С-клеток |
Площадь – средняя оптическая плотность объединений С-клеток |
Коэффициент гистосчёта – средняя оптическая плотность единичных С-клеток |
Коэффициент гистосчёта – средняя оптическая плотность объединений С-клеток |
|
Контроль |
0,01 |
-0,22* |
0,67* |
-0,04 |
|
Тренирующие нагрузки |
-0,13 |
-0,16 |
0,75* |
0,60* |
|
Стартовые нагрузки |
0,06 |
-0,31* |
0,70* |
-0,03 |
|
Предельные нагрузки |
0,09 |
-0,13 |
0,69* |
0,35* |
|
Многократные 1 |
0,30* |
-0,58* |
0,78* |
-0,18 |
|
Многократные 2 |
0,02 |
-0,25* |
0,65* |
0,33* |
|
Многократные 3 |
-0,24* |
-0,52* |
0,57* |
-0,18 |
(*- p <0,05)
Первичная компактная локализация С-клеток в центре железы связана с развитием ультимобранхиальных тел (Fagman H., Nilsson M., 2010), однако причины дальнейшей миграции и перераспределения остаются невыясненными. Нами выявлено, что при двигательных нагрузках во всех экспериментальных группах меняется процентное соотношение единично расположенных кальцитониноцитов и их объединений. При однократных воздействиях происходит увеличение единичных С-клеток интерфолликулярной локализации. Двигательная активность влияла и на характеристики объединений клеток: уменьшалась доля С-комплексов с большим количеством кальцитониноцитов и увеличивалась доля небольших групп. Мы полагаем, что ввиду отсутствия сократительных филаментов в цитоплазме и плазматической мембране механизмом пассивного перемещения С-клеток может быть разделение изначальных кластеров фолликулами, которые вновь образуются из участков интерфолликулярного эпителия или за счет их активной перестройки (рост, фрагментация) в результате изменения регионарной функциональной активности ЩЖ.
Из данных литературы известно, что о функциональной активности единичных кальцитониноцитов можно судить по площади, количеству и локализации гранул в них [Павлов А.В., 1985; Виноградов С.Ю., Погорелов Ю.В., 1997; Быков В.Л., 2001]. Наши исследования показали, что при различных мышечных нагрузках увеличение размеров С-клеток и/или оптической плотности гранул кальцитонина может служить морфологическим эквивалентом активизации биосинтетических процессов, приводящих к накоплению секреторного материала. Объективным критерием функциональной активности парафолликулярных эндокриноцитов является показатель средней оптической плотности. Характер воздействия определял способы реагирования клеток – как за счет увеличения площади, так и оптической плотности или сочетания этих признаков. У интактных животных поддержание тканевого гомеостаза было обусловлено, в первую очередь, влиянием сезонных условий на функциональную активность С-клеток, что продемонстрировано еще в работах Petkó M. (1978) [15].
Единично расположенные кальцитониноциты в функциональном плане более активны, чем их группы. Нами показано, что площадь сечения С-клеток не может служить достоверным критерием их функциональной активности. Показатели гистосчета во многом субъективны и зависят от насыщенности кадра объектами, этот метод малоприменим к описанию кластеров парафолликулярных эндокриноцитов и дает большую погрешность, хотя может служить основой описания единично расположенных клеток.
Выводы
Мышечные нагрузки повышают функциональную активность С-клеток – местных гуморальных регуляторов ЩЖ. Это находит отражение в увеличении средней оптической плотности гранул и/или площади клеток, что можно трактовать как повышение резервных возможностей популяции для обеспечения необходимого уровня секреции и поддержания в крови стабильного уровня кальцитонина в ответ на различные режимы двигательной активности.
При двигательных нагрузках чаще встречаются единично расположенные парафолликулярные эндокриноциты или С-комплексы с небольшим количеством клеток. Активность одиночно расположенных клеток достоверно выше, чем кластеров С-клеток. Не выявлено зависимости между площадью сечения, занимаемой единичной клеткой, и средней оптической плотностью гранул в ней. В кластерах С-клеток площадь и оптическая плотность корреляционно зависимы.
Объективным методом оценки функциональной активности кальцитониноцитов является средняя оптическая плотность гранул единично расположенных клеток, полуколичественный метод (коэффициент гистосчета) имеет свои ограничения, применим преимущественно для единичных клеток и малоэффективен в отношении их объединений.
[1] ImageJ 1.6.0 is being developed at the National Institutes of Health by an employee of the Federal Government in the course of his official duties. Pursuant to Title 17, Section 105 of the United States Code, this software is not subject to copyright protection and is in the public domain.
Библиографическая ссылка
Безденежных А.В., Гришина Н.И. ОСОБЕННОСТИ ТОПОГРАФИИ КАЛЬЦИТОНИНОЦИТОВ ЩИТОВИДНОЙ ЖЕЛЕЗЫ СОБАК ПРИ РАЗЛИЧНЫХ РЕЖИМАХ ДВИГАТЕЛЬНОЙ АКТИВНОСТИ // Современные проблемы науки и образования. – 2017. – № 2. ;URL: https://science-education.ru/ru/article/view?id=26264 (дата обращения: 19.04.2024).



