Подростковый идиопатический сколиоз (АИС) представляет собой структурную деформацию позвоночника [9]. Рост тела позвонка происходит благодаря развитию ростовой пластины. Пролиферация и дифференцировка хондроцитов ростовой пластинки в период роста играет ключевую роль в регуляции ее развития [7]. Все больше данных свидетельствуют о том, что кинетика роста ростовой пластинки тел позвонков (РПТП) выше у пациентов AИС [8]. Тем не менее механизм регуляции пролиферации и дифференцировки хондроцитов РПТП у пациентов АИС в значительной степени неизвестен.
Существует мнение, что уровень полиаминов является показателем регуляции клеточного роста, пролиферации, тканевой регенерации и малигнизации [1]. Поэтому полиамины рассматриваются как внутриклеточные «маркеры роста» и маркеры активности пролиферативных процессов [4; 5]. Причем спермин преимущественно служит маркером дифференцировки, а спермидин - маркером пролиферации [2].
С другой стороны, в патогенезе АИС активно обсуждается гипотеза влияния дисфункции синтеза мелатонина [6]. Исследования подтверждают гипотезу о том, что дефицит мелатонина может быть связан с патогенезом АИС. Мелатонин играет важную роль в модуляции дифференцировки остеобластов и образовании костной ткани [11]. В последнее время также сообщалось об участии мелатонина в усилении синтеза хрящевого матрикса хондроцитов свиньи [12]. Тем не менее механизм регуляции пролиферации и дифференцировки хондроцитов ростовой пластинки тел позвонков у пациентов АИС в значительной степени неизвестен.
Целью настоящего исследования стало сравнение регулирующей роли мелатонина и полиаминов на пролиферацию хондроцитов ростовой пластинки тел позвонков.
Материалы и методы. Материалом для проведения исследования служили пластинки роста тел позвонков крыс. Из грудного отдела позвоночника выделяли тела позвонков и хондроциты. РПТП выделяли и культивировали in vitro методом расщепления коллагеназой и трипсином [10]. Образцы ткани позвоночника были получены из 12 пятидневных крыс линии Вистар. После промывки с помощью стерильного фосфатно-солевого буферного раствора (PBS) неповрежденные образцы РПТП расщепляли в 0,25% трипсине (Sigma-AldrichCo.) в течение 30 минут, а затем в 0,2% коллагеназе типа II (Sigma) в течение 1 часа. Избытки ткани и мышцы удаляли, а затем образцы РПТП гомогенизировали и гидролизовали в 0,2% коллагеназе типа II в течение 5 часов. После отделения хондроциты были помещены в среду DMEM (Gibco BRL), дополненную 10% фетальной бычьей сыворотки (Gibco), и инкубировали в увлажненной атмосфере с 5% СО2 при 37 °С. Клетки пересевали с помощью обработки трипсином с 0,25% трипсина до достижении состояния субконфлюэнтного монослоя с плотностью посева около 20 000 на кв. см в лунке культурального планшета. Хондроциты идентифицировали на фазово-контрастном микроскопе (CNOECOPTO-EDUA14.1101) и окрашиванием толуидиновым синим, как описано ранее [3]. В последующих исследованиях использовали первый-третий пассажи.
Анализ клеточной пролиферации. Культивируемые хондроциты высевали в 96-луночные культуральные планшеты [2000 клеток / лунку в 150 мкл стандартной среды DMEM + 2mM глутамина + 1.0 mM пируват натрия + 10% сыворотки теленка (FBS)] [11]. Для исследования влияния мелатонина и полиаминов среду заменяли бессывороточной DMEM, содержащей различные концентрации мелатонина (0,1, 1, 10 и 100 мкг / мл) или полиаминов (1,0, 40,0, 60,0 и 100 мкмоль/л). В качестве контроля использовали культуру хондроцитов (2000 клеток / лунку) в 150 мкл бессывороточной DMEM. Клетки инкубировали в течение 24 часов. Затем проводили стандартный МТТ-тест [2; 12]. 50 мкл раствора 3-(4,5-диметилтиазол)-2,5-дифенилтетразолий бромид (MTT) (250 мкг / мл в среде DMEM) добавляли в каждую лунку, и клетки инкубировали при 37 °С в течение 4 ч. планшеты центрифугировали при 380 g в течение 5 мин, супернатант удаляли, а затем добавляли 200 мкл диметилсульфоксида в каждую лунку. Через 20 мин регистрировали оптическую плотность (А) каждой лунки при длине волны 490 нм. Коэффициент выживаемости клеток рассчитывали по следующей формуле: Клеточная выживаемость (%) = A опыт/ A контроль × 100. Для контроля (без эффекторов, бессывороточной DMEM) значения А (абсорбции) для линий хондроцитов составляют 0,96 ± 0,07 нм (усредненные данные по каждой исследованной планшете, где контроль вводился в 6 лунок).
Определение ферментативной активности оксидазы полиаминов. Активность полиаминоксидазы в лизате клеток определяли, измеряя образование перекиси водорода при окислении спермина этим ферментом, как описано ранее [1]. Ферментативная активность анализировалось в глициновом буфере, pH 8.0, содержащем 5 нмолей люминола, 20μg/ml пероксидазы хрена, 0,2 мМ 2-бромэтиламина (ингибитор каталазы), 15 μM депренила (содержащий медь ингибитор полиаминоксидазы), 0,15 μM хлоргелин (митохондриальный оксидазный ингибитор) и 250 μM спермина как субстрата. Все реагенты, за исключением субстрата, были смешаны в объеме 250 μl и инкубированы 2 мин при 37 °C, далее добавляли спермин и измеряли хемилюминесценцию на люминометре (хемилюминометр ХЛ-003, УГАТУ, Россия), в течение 40 с. Активность фермента выражали в виде относительных световых единиц (RLU/ мкг белка / мин).
Статистический анализ. Результаты выражаются как среднее ± стандартное отклонение (SD). Данные из разных групп оценивали с использованием однофакторного дисперсионного анализа, следуя постанализу Даннета. Несколько сравнений выполнялись с использованием метода LSD или метода T3 Dunnett. Различия считались статистически значимыми при Р <0,05. Статистический анализ проводился с использованием программного обеспечения SPSS 13.0.
Результаты и обсуждение. Культивированные хондроциты ростовой пластинки позвонков крыс в основном были многоугольной формы, и несколько неправильной формы, их ядра были в основном круглой или овальной формы (рис. А). Окрашивание толуидиновым синим показало, что клетки имеют разную форму, ядра окрашивались интенсивно, а цитоплазма была окрашена слабо, и содержатся мелкие гранулы (рис. Б).
Первичная культура хондроцитов, выделенная из ростовой пластинки тела позвонка крыс, на первом пассаже выглядит разреженной и представлена тремя типами клеток (рис.). Клетки всех типов имеют статистически достоверные различия площади клетки, коэффициента формы ядра и ядерно-цитоплазматического отношения. Мелкие клетки обозначены как клетки 1-го типа, среднего размера – как клетки 2-го типа и самые крупные – клетки 3-го типа.
Клетки 1-го типа площадью 62,0±7,7 мкм2, преобладают при первом пересеве, их содержание достигает 75%. Округлое ядро содержит гетерохроматин и занимает больший объем клетки. Умеренно базофильная цитоплазма, слабо выражена
Клетки 2-го типа преимущественно овальные, площадью 103,5 ± 2,5 мкм2, составляют около 20% клеточной популяции. Ядро лежит эксцентрично и, в зависимости от плоскости расположения в клетке, имеет бобовидную, овальную или форму уплощенного диска. Цитоплазма умеренно оксифильная.
Клетки 3-го типа содержат крупное ядро с небольшим количеством эухроматина. В цитоплазме выявляются мелкие оксифильные гранулы. Это самая малочисленная группа клеток, насчитывает от 3,0 до 5,0% от общего числа клеток в культуре.
Предварительное исследование влияния эффекторов (мелатонина и полиаминов) на пролиферацию культивированных хондроцитов РПТП, используя максимальную концентрацию в 100 микромоль/литр, в течение 24, 48, 72 и 96 часов показало, что эффекторы проявляли максимальный эффект влияния на клетки хондроцитов ростовой пластинки тел позвонков крыс начиная со вторых суток инкубации. Более длительные сроки практически не влияли на ингибиторную активность. Было принято решение остальные эксперименты и зависимость от дозы исследовать только на культурах с 48-часовой преинкубацией.
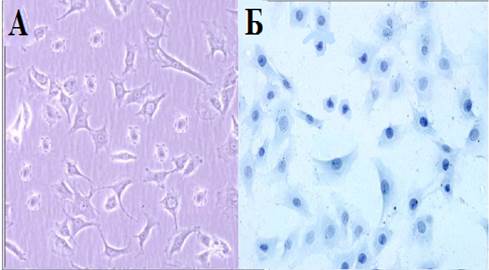
Морфологическая характеристика культивируемых хондроцитов ростовой пластинки тел позвонков крыс. Морфологию клетки оценивали с помощью инвертированного фазово-контрастного микроскопа (А) и окрашивания толуидиновым синим (Б). Ув. 10х40
Дальнейший эксперимент преследовал цель выяснения зависимости ингибирующего эффекта от концентрации эффекторов в среде культивирования. Таких исследований для каждой концентрации было проведено по 10 (n=10). В качестве контроля использовали культуру хондроцитов (2000 клеток/лунку) в 150 мкл бессывороточной DMEM (см. Материалы и методы). Результаты приведены в таблице 1.
Мелатонин значительно ингибирует пролиферацию первичных культивированных хондроцитов ростовой пластины позвонков крыс на 15,9% при 10 мкг/мл (р< 0,05), на 30,4% при 60 мкг/мл (р< 0,01), на 33,9% при 80 мкг/мл (р< 0,01), на 54,1% при 100 мкг/мл (р< 0,001), но не в 0, 0,1 и 1 мкг/мл (р> 0,05).
Таблица 1
Ингибирующий эффект мелатонина и полиаминов на пролиферацию хондроцитов ростовой пластинки тел позвонков крыс (в процентах от абсорбции контроля 0,96 ± 0,07 нм)
|
эффектор |
Концентрации, микромоль/литр |
|||||
|
0,1 |
1,0 |
10,0 |
60 |
80 |
100 |
|
|
мелатонин |
95,1±2,3% |
94,4±1,7% |
84,1±4,7% |
69,6±2,9% |
66,1±3,1% |
45,9±1,4% |
|
P |
≥0,1 |
≥0,1 |
≤0,05 |
≤0,01 |
≤0,001 |
≤0,001 |
|
спермин |
- |
96,5±4,3% |
101,2±4,8% |
94,1±4,2% |
103,6±6,2%, |
106,1±5,9% |
|
P |
- |
≥0,1 |
≥0,1 |
≥0,1 |
≥0,1 |
≥0,1 |
|
спермидин |
- |
117,4±12,3% |
134,9±5,7% |
168,7±8,6% |
177,4±9,7% |
184,5±7,1% |
|
P |
- |
≥0,1 |
≤0,005 |
≤0,001 |
≤0,001 |
≤0,001 |
Достоверность рассчитана по отношению к контролю (см. материалы и методы)
Как видно из таблицы 1, спермин практически не оказывает влияния на пролиферативные процессы в хондроцитах. Спермидин оказывает дозозависимый стимулирующий эффект на пролиферацию хондроцитов. Достоверное усиление пролиферативных процессов в хондроцитах ростовой пластинки тел позвонков крыс начинается с концентрации 10,0 микромоль/л спермидина в культуральной среде.
Нами проведено дополнительное исследование влияния спермидина на пролиферацию хондроцитов ростовой пластинки тел позвонков крыс при концентрациях 250,0; 500,0 и 1000,0 микромоль/л и показано, что при концентрациях 250,0 микромоль/л стимулирующий эффект достигает значений почти в 300% (285,8±8,9%), но при больших концентрациях достоверно не растет: при 500,0 микромоль/л равняется 291,3±11,7%, а при 1000,0 микромоль/л равняется 279,6±15,3%.
Следующий этап исследований состоял в оценке совместного воздействия мелатонина и каждого из исследованных полиаминов на пролиферацию хондроцитов ростовой пластинки тел позвонков крыс. Эксперимент был спланирован таким образом, что в культуральной среде содержалась максимальная концентрация мелатонина (100,0 микромоль/литр), и на этом фоне добавляли спермин либо спермидин в концентрациях от 10,0 до 100,0 микромоль/литр. Для каждого варианта концентрации проведено по 10 исследований. Результаты приведены в таблице 2. Приведенные в ней данные свидетельствуют, что совместное применение мелатонина и спермина приводит к резкому росту ингибиторного эффекта мелатонина. Присутствие спермина потенцирует ингибиторный эффект мелатонина на пролиферацию хондроцитов ростовой пластинки тел позвонков крыс, причем это действие носит дозозависимый эффект и начинается с концентрации 60,0 микромоль\литр. Примененная минимальная концентрация 10,0 микромоль/литр не вызывает потенцирования действия мелатонина.
Сложнее оценить взаимодействие мелатонина и спермидина. При изолированном применении эти вещества оказывают противоположное действие на пролиферацию хондроцитов ростовой пластинки тел позвонков крыс. Если ингибирующее действие мелатонина проявляется достоверно уже при концентрации 10,0 микромоль/литр и достигает максимума к 100,0 микромоль/литр, то активирующее влияние спермидина растет пропорционально его концентрации.
Таблица 2
Cовместное воздействие мелатонина и каждого из исследованных полиаминов на пролиферацию хондроцитов ростовой пластинки тел позвонков крыс в процентах от абсорбции контроля 0,96 ± 0,07 нм. Достоверность рассчитана по отношению к контролю
|
Мелатонин +полиамин |
Концентрации полиаминов, микромоль\литр |
|||
|
10,0 |
60,0 |
80,0 |
100,0 |
|
|
Мелатонин+спермин |
47,1±1,7% |
32,6±7,1% |
28,2±5,1% |
18,3±3,4% |
|
P |
≤0,01 |
≤0,01 |
≥0,05 |
≥0,1 |
|
Мелатонин+спермидин |
45,9±1,4% |
68,2±3,6% |
96,5±9,7% |
124,1±4,8% |
|
P |
≤0,01 |
≤0,01 |
≥0,1 |
≤0,01 |
При совместном применении мелатонина (концентрация мелатонина постоянная и равна 100 микромоль/литр) и спермидина – малые концентрации спермидина не способны полностью нивелировать ингибиторное действие мелатонина, и только когда их концентрации приближаются к эквимолярному состоянию, на первый план выходит стимулирующее влияние спермидина. Вероятнее всего, действие мелатонина и спермидина влияет на разные процессы в регуляции и пролиферации хондроцитов ростовой пластинки тел позвонков крыс.
Вышеуказанные результаты показали, что мелатонин ингибирует, а спермидин стимулирует пролиферацию хондроцитов ростовой пластинки тел позвонков крыс. Для того чтобы разобраться в механизмах, лежащих в основе этих эффектов, было исследовано их влияние на активность полиаминоксидазы (ПАО) в культуре хондроцитов. Полиаминоксидаза является важным ферментом, участвующим в катаболизме полиаминов. Этот фермент катализирует разложение полиаминов. Доказано также, что ПАО является важным фактором в индукции апоптоза клеток [13]. Мы провели определение активности полиаминоксидазы в хондроцитах 1-3 пассажей, обработанных мелатонином, концентрациями, указанными в таблице 1, в течение 24 ч. Каждое исследование проводили на 10 планшетах (n=10). Результаты, представленные в таблице 3, показали активацию ферментативной активности ПАО в культуре хондроцитов. Мелатонин может стимулировать активность ПАО в дозах не менее 10 микромоль/литр. Воздействие мелатонина в дозе 60 мкмоль/л в течение 24 ч приводит к ~ 2,4-кратной индукции активности ПАО. Дальнейшее увеличение дозы мелатонина не приводит к достоверному увеличению активности полиаминоксидазы.
Таблица 3
Активность полиаминоксидазы в хондроцитах ростовой пластинки тел позвонков крыс в присутствии мелатонина
|
Эффектор |
Концентрации, микромоль\литр |
||||||
|
0,1 |
1,0 |
10,0 |
60 |
80 |
100 |
0 контроль |
|
|
мелатонин |
3307,0±825,0 |
4175,0± 118,0 |
6460,0± 360,0 |
7845,0± 625,0 |
7718,0± 615,0 |
8175,0± 540,0 |
3270,0± 190,0 |
|
Р |
≥0,1 |
≥0,5 |
≤0,05 |
≤0,001 |
≤0,001 |
≤0,001 |
|
Р - достоверность различий между воздействием мелатонина и контролем.
Таким образом, показан ингибирующий эффект мелатонина на пролиферацию хондроцитов ростовой пластинки тел позвонков крыс в тесте с 3-[4,5-диметилтиазолил-2-ел]-2,5-дифенилтетразолиум бромидом (МТТ-тест). Впервые показано потенцирующее действие спермина на ингибиторный эффект мелатонина и активирующее действие спермидина на пролиферацию хондроцитов ростовой пластины тел позвонков крыс. Вероятно, потенцирующее действие спермина может быть объяснено влиянием мелатонина на активность ПАО и изменением в результате этого действия соотношения спермин/спермидин. Однако эти предположения требуют дополнительной проверки. Кроме того, полученные сведения позволяют однозначно констатировать, что мелатонин принимает то или иное участие в метаболизме полиаминов, и соответственно в реализации их многочисленных функций, и благодаря активации полиаминоксидазы может способствовать апоптозу клеток хрящевой ткани.
Обнаруженное влияние полиаминов на процессы пролиферации хондроцитов ростовой пластинки тел позвонков крыс может во многом объяснить противоречивые результаты оценки роли мелатонина в патогенезе подросткового идиопатического сколиоза.
Библиографическая ссылка
Расулов М.Д., Николаев А.А., Гончарова Л.А. ВЛИЯНИЕ ПОЛИАМИНОВ НА ПРОЛИФЕРАЦИЮ И ДИФФЕРЕНЦИРОВКУ ХОНДРОЦИТОВ РОСТОВОЙ ПЛАСТИНКИ ТЕЛ ПОЗВОНКОВ КРЫС IN VITRO // Современные проблемы науки и образования. – 2017. – № 3. ;URL: https://science-education.ru/ru/article/view?id=26517 (дата обращения: 18.04.2024).



