1. Структурная организация дентальной бляшки
Все поверхности человеческого тела, которые подвергаются внешнему воздействию, такие как полость рта, кожа, верхние дыхательные пути, репродуктивный и желудочно-кишечный тракт колонизированы микробиотой. Однако каждое из этих мест обитания таит в себе уникальную группу микроорганизмов с такими свойствами, которые отличаются от других мест обитания. Микробиота ротовой полости заселяет многослойный плоский эпителий слизистой оболочки супрогингивально (на поверхности зубов с формированием дентальной бляшки) и субгингивально (в пародонтальном кармане) [14].
Дентальная бляшка является архетипической биопленкой, состоящей из сложного микробного сообщества. Национальные институты здравоохранения организовали базу данных микробиома ротовой полости человека, чтобы получить целостное представление о биопленке дентальной бляшки. Следует также отметить, что состав биопленки дентальной бляшки весьма разнообразен между людьми, и эти различия могут генерировать с уникальными отпечатками пальцев каждого человека. Использование подхода метагеномики показало, что число видов бактерий в зрелой дентальной бляшке может достигать > 19,000 [14].
Исследования дентальной бляшки с использованием световой и электронной микроскопии сыграли решающую роль в демонстрации того, что структура дентальных бляшек тесно связана с микробным составом. Дентальная бляшка представляет собой живую, постоянно меняющуюся структуру со способностью адаптироваться к механическим, физическим и химическим условиям. Она имеет исключительно разнообразные морфологические особенности, и эти особенности могут варьировать в зависимости от возраста и генетики организма хозяина, его диеты (рациона питания), географии проживания, социо-экологических условий, образования; степени созревания и расположения дентальной бляшки на поверхности зуба [13].
1.1.Характеристика дентальной бляшки как биопленки
В основе дентальной бляшки супрагингивально расположены микроколонии бактериальных клеток. Бактерии в биопленке располагаются кластерами, формируя колонии в форме грибов. Каждая микроколония является независимым сообществом со своей собственной независимой средой обитания. Быстрое образование видимых слоев микроорганизмов при обширном росте бактерий сопровождается продукцией обильного количества внеклеточных полимеров. На нижних уровнях большинства биопленок находится плотный слой микробов, связанных друг с другом в полисахаридной матриксе с другими органическими и неорганическими материалами. Последующий слой представляет собой свободный (рыхлый) слой, который часто искривлен по внешнему виду и может, как правило, распространяться в окружающую среду [13].
Между микроколониями в составе этих биопленок находятся пустоты или водные каналы. Они обеспечивают прохождение питательных веществ и других агентов по всей биопленке, действуя как примитивная «кровеносная» система. Различные микроколонии могут содержать различные комбинации видов бактерий. Бактерии в центре микроколонии могут жить в строго анаэробной среде, в то время как другие бактерии по краям жидкостных (водных) каналов могут жить в аэробной среде. Таким образом, структура биопленки предоставляет собой широкий спектр специализированных условий жизни (разное значение ph, наличие питательных веществ и кислорода). Бактерии в составе биопленки продуцируют экзополисахариды, которые являются базовыми компонентами биопленки. Они играют важную роль в поддержании целостности биопленки, а также предотвращают высыхание и попадания вредных веществ. Одной отличительной особенностью биопленок ротовой полости является то, что многие микроорганизмы при условии недостатка питательных веществ могут одновременно синтезировать экзополисахариды и разрушать их по достижению определенной плотности бактерий при откреплении. Некоторые уникальные функции и свойства биопленки определяются способностями бактерий взаимодействовать друг с другом с помощью сигнальных систем. Одной из основополагающих сигнальных систем является чувство кворума. Чувство кворума представляет собой сигнальный путь, который активируется в ответ на плотность клеток [13].
1.2. Экологическая неоднородность (гетерогенность) позволяет существовать в биопленке дентальной бляшки микроорганизмам, которые несовместимы друг с другом в однородной среде; это объясняет, как организмы с противоречивыми требованиями метаболизма (питательные вещества, рН, кислород) сохраняются в одной нише [14].
Биопленки выступают не только образом жизни бактерий, но и протектором внешних воздействий. Бактерии дентальной бляшки показывают повышенную устойчивость к антимикробным препаратам, которые используются в средствах для чистки зубов и полоскания рта. Например, ингибирующая концентрация биопленки для хлоргексидина и аминного фторида в 300 и 75 раз больше, соответственно, при культивировании Streptococcus sobrinus как биопленки по сравнению с планктонными клетками.
Одна из особенностей микробной биопленки, в том числе биопленки дентальной бляшки – самодостаточность. Было показано, что режим роста биопленки позволяет микробам выживать в ограниченных условиях питания (алиментарные условия) в течение длительного периода времени. Микробный состав биопленки дентальной бляшки не зависит от диеты хозяина, качества пищи; он поддерживается за счет создания «пищевых цепей», связанных с другими членами сообщества. Рост биопленки дентальной бляшки зависит от питательных веществ, полученных из эндогенных источников, таких как слюна и жидкость десневой борозды, а не экзогенных – пища хозяина [14].
Например, кислотообразующие бактерии, такие как Streptococcus, Lactobacillus, Actinomyces производят лактат в качестве побочного продукта метаболизма углеводов. Другие виды бактерий, такие как Veillonella и Propionibacterium, используют лактат в качестве источника углерода, и таким образом происходит преобразование лактата в слабую пропионовую кислоту, при этом снижается риск развития кариеса. Точно так же, менахинон производится Veillonella и Propionibacterium, жизненно важен для синтеза витамина К, который способствует росту бактерий, таких как Porphyromonas, Prevotella и Bifidobacterium. Другим примером является влияние на Spirochaetales тиамина и изобутирата, которые вырабатываются видами Fusobacterium в дентальной бляшке (Обзор, 14).
Дентальная бляшка состоит из большого разнообразия бактериальных морфотипов с определенной последовательностью появления, формирования микробных сообществ. Среда биопленки придает определенные свойства бактериям, которые не обнаружены в свободном состоянии, что объясняет важность признания дентальной бляшки в качестве биопленки, а не как бактерий в планктонном состоянии [13].
2. Динамика развития дентальной бляшки
Адгезия микробов на поверхность полости рта является необходимым условием для образования биопленки дентальной бляшки. Многие виды бактерий обладают поверхностными структурами, такими как фимбрии и фибриллы, которые помогают в прикреплении к различным поверхностям. Фимбрии обнаружены у таких бактерий полости рта, как Actinobacillus actinimycetemcomitans и Porphyromonas gingivalis [15]. Тем не менее, простой поверхностный контакт или седиментация микробов не приводит к образованию биопленки. Должна произойти высокоорганизованная последовательность событий.
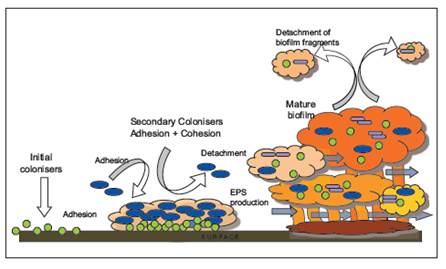
Последовательность развития биопленки: адгезия микроорганизма к поверхности; индивидуальная колонизация и организация клеток; секреция и созревание в трехмерную структуру; распространение клеток биопленки [14]
Выделяют следующие этапы развития дентальной бляшки:
(А) Формирование кондиционированной пленки (приобретенная пелликула), которая образуется почти сразу же после прорезывания или очистки зубов, непосредственно влияет на структуру исходной микробной колонизации. Адсорбция бактериальных молекул к поверхности зуба хозяина (рецептор-лигандное взаимодействие).
(Б) Пассивный транспорт бактерий полости рта к поверхности зуба. Слабые, длинноспектральные физико-химические взаимодействия между микробной клеточной поверхностью и пелликулой создают слабую область привлечения, что способствует обратимой адгезии. Сильное, короткоспектральное взаимодействие между специфическими молекулами на поверхности бактериальной клетки (адгезинов) и комплементарных рецепторов пленки приводит к необратимой адгезии и может объяснить микробный тропизм поверхностей.
(В) Коадгезия. Адгезия последующих колонизаторов к ранее уже присоединенным колонизаторам (бактерии-бактерии). Этот этап включает в себя конкретные межбактериальные взаимодействия адгезиновых рецепторов (часто с участием лектинов), приводит к увеличению разнообразия необычных морфологических структур биопленки, таких как вид «початка» и ‘test-tube brush’ (пробирка щетка). Коадгезия может также способствовать функциональной организации дентальной бляшки. Бактерии участвуют в диапазоне антагонистических и синергетических биохимических взаимодействий. Совместная адгезия облигатно анаэробных бактерий и аэробных видов может обеспечить их выживание в аэробных открытых средах ротовой полости.
(Г) Размножение прикрепленных микроорганизмов. Деление клеток приводит к конфлюэнтному росту и, в конечном итоге, к образованию трехмерной пространственно и функционально организованной, смешанной культуре биопленки.
(Д) Активное отсоединение (пространственно-временная организация). Бактерии могут реагировать на сигналы окружающей среды и отделяться от поверхности, что позволяет клеткам колонизировать другие места. Например, ферменты, вырабатываемые прикрепленными бактериями, могут гидролизовать специфические адгезины, которые закрепляют клетки к поверхности (Обзор, 14).
При анализе последовательных этапов развития субгингивальной и супрагингивальной боипленок, проведенном W. H. Van Palenstein Helderman, были проанализированы 1, 4, 7, 11 и 14 дни с помощью темнопольной микроскопии и анаэробных культуральных методов. В 1 день в супрагингивальной и субгингивальной бляшках содержится преимущественно грамположительная кокковая флора, с меньшим процентом грамположительных палочек; в значительно меньшем количестве Vibrio, Campylobacter, Eikenella corrodens и corroding Bacteroides, Capnocytophaga и Selenomonas, Fusobacterium и Veillonella. Численность всех этих микроорганизмов пропорционально увеличивалась в течение 2 недель за счет доли грамположительных кокков. Spirochaetales появились спорадически на 7 – и 14-день субгингивальной бляшки. Bacteroides melaninogenicus были обнаружены только один раз в 1-й день супрагингивальной и субгингивальной бляшек. Грамположительные палочки были широко распространены в развивающейся супрагингивальной бляшке, в то время как подвижные палочки и спирохеты были найдены в чуть большей пропорции в более зрелой субгингивальной бляшке. Эти наблюдения указывают на дискретные локальные различия в развитии дентальной бляшки [12].
3. Микробиом дентальной бляшки (Бактериальный состав дентальной бляшки)
Еще в 1683 году Антони Ван Левенгук описывал взаимосвязь между микроорганизмами и стоматологией. Более поздние исследования показали, что «самой большой разновидностью», которую он упоминал, мог быть вид Selenomonas (Borrelia burgdorferi), обитающий в дентальной бляшке. Следовательно, дентальная бляшка, как известно, является резервуаром микроорганизмов с самого рассвета микробиологии [14].
Молекулярные подходы, основанные на анализе нуклеотидной последовательности, характеризуют полное разнообразие дентальной бляшки и привели к идентификации приблизительно 700 микробных таксонов, из которых примерно 50 %, не могут быть выращены in vitro [10].
Первичные колонизаторы дентальной бляшки – это аэробы или факультативные аэробы, такие как Streptococcus sanguinis, Streptococcus oralis, Streptococcus mitis, Fusobacterium и виды Neisseria. Отрицательно заряженная клеточная поверхность стенки бактерий облегчает их связывание с положительно заряженными молекулами рецептора на пелликуле. Первичные колонизаторы снижают уровень кислорода, позволяя анаэробным бактериям внедриться в сообщество биопленки в качестве вторичных колонизаторов.
Вторичные колонизаторы, главным образом, грамотрицательные микроорганизмы, такие как Actinomyces, Fusobacterium nucleatum, Prevotella intermedia и Capnocytophaga. Было показано, что коагрегация при развитии дентальной бляшки может происходить между грамположительными видами, такими как S. Sanguinis и Actinomyces; между грамотрицательными видами, такими как Prevotella melaninogenica и F. nucleatum; а также между грамположительными и грамотрицательными видами, такими как Streptococcus и Fusobacterium, соответственно. Если биопленку дентальной бляшки не трогали в течение примерно 7 дней, местная окружающая среда быстро меняется, способствуя колонизации некоторых грамотрицательных анаэробных, условно патогенных видов бактерий, таких как Porphyromonas gingivalis и Aggregatibacter actinomycetemcomitans, и спирохеты, такие как Treponema denticola. У P. Gingivalis выявлена коагрегация с факультативно-аэробными бактериями, такими как виды Neisseria в качестве стратегии выживания.
Хотя развитие дентальной бляшки в целом соответствует вышеупомянутой последовательности событий, существует огромное разнообразие этого процесса между людьми, даже в нормальных условиях.
Микрофлора различается по составу на различных поверхностях зубов, каждая поверхность имеет характерный состав. Трещины колонизированы в основном грамположительными бактериями, особенно стрептококками; гингивальная щель – грамотрицательными бактериями. Это иллюстрирует важную концепцию: количество и типы бактерий отражают локальные биологические и физические условия места проживания. Таким образом, изменение ключевых параметров окружающей среды может привести к изменению конкурентоспособности отдельных видов и изменению баланса микрофлоры [10].
Важными характеристиками бактериальной популяции конкретного участка являются структура и композиция сообщества специфических организмов [5].
4. Функции дентальной бляшки
Присутствие резидентной микрофлоры, и её важнейшая функция – колонизационная резистентность являются необходимым важным компонентом организма хозяина в здоровом состоянии. Информация о благотворной роли резидентной микробной флоры известна из ранних исследований, сравнивающих физиологию неинфицированных (стерильных) и обычных лабораторных животных, а также людей, чья нормальная микрофлора была подорвана длительным применением антибиотиков. Большинство исследований были сосредоточены на кишечной микрофлоре, но такие выводы также актуальны в отношении ротовой полости.
Резидентная микрофлора всех участков в организме может влиять на физиологию хозяина и внести свой вклад во врожденную защиту хозяина, будучи барьером для экзогенных видов. Этот барьерный эффект называется «колонизационной резистентностью» [8]. Механизмы колонизационной резистентности включают конкуренцию за (а) питательные вещества и (б) участки прикрепления. Кроме того, колонизационная резистентность будет поддерживаться (с) производством ингибирующих метаболитов и (г) созданием неблагоприятных условий окружающей среды для экзогенных организмов [7]. Например, производство перекиси водорода S. mitis может подавить рост потенциальных патогенов пародонта в дентальной бляшке, таких как A. Actinomycetemcomitans [11].
5. Супрагингивальная дентальная бляшка в развитии кариеса зубов
Установлено, что частое потребление в пищу сахаров предоставляет возможность для кислотообразующих бактерий биопленки дентальной бляшки, таким как S. mutans и Lactobacillus acidophilus создать устойчивую кислую среду, что приводит к сдвигу равновесия в сторону деминерализации поверхности зуба.
Некоторые авторы предполагают, что снижение уровня Veillonella spp. в дентальной бляшке может снизить её потенциал использования молочной кислоты, производимой другими бактериями, и, следовательно, увеличить риск возникновения кариеса на участке, деминерализации [9].
Эти данные свидетельствуют о том, что стратегии профилактики кариеса, ориентированные только на определенные бактерии, будут частично успешны, в то время как подходы, которые снижают выработку кислоты и поддержание рН дентальной бляшки ближе к нейтральному, будут наиболее эффективны.
Клинические исследования показали, что кариес связан с увеличением доли кислотообразующих и кислотоустойчивых бактерий, особенно стрептококков (Streptococcus mutans и Streptococcus sobrinus) и Lactobacilli, которые способны деминерализовать эмаль; бифидобактерии также признаны как потенциально кариесогенные бактерии при распространенном поражении. Эти бактерии могут метаболизировать сахар в кислоту, создавая локально низкий уровень рН. Такие микроорганизмы растут и оптимально метаболизируют при низких значениях рН; при таких условиях они становятся более конкурентоспособными, тогда как большинство видов, ассоциированных со здоровой эмалью, являются чувствительными к кислым условиям окружающей среды.
Существуют современные гипотезы "Specific Plaque Hypothesis" «Специфическая гипотеза бляшки (биопленки)», объясняющие роль бактерий дентальной бляшки в этиологии кариеса. Она предполагает, что из разных организмов, составляющих резидентную микрофлору дентальной бляшки, лишь несколько видов участвуют в развитии заболевания. Это гипотеза ориентирована на контроль болезни путем целенаправленной профилактики и лечения против ограниченного числа микроорганизмов [10].
Взаимосвязь между бактериальным составом бляшки и зубным кариесом была широко изучена, существует много доказательств в поддержку роли S. mutans в развитии кариеса зубов. Однако, несмотря на несколько перекрестных исследований, показывающих такую ассоциацию, характер этих исследований был таков, что причинно-следственная связь может не иметь статистической значимости. Многие проблемы возникают, когда проводятся клинические исследования по микробной этиологии кариеса эмали человека. К ним относятся: (1) большое число участков, которые должны находиться под контролем, (2) трудности в раннем выявлении поражений и (3) проблема точной выборки места взятия образца из дискретных кариозных участков. Следовательно, соотнести микробный состав дентальной бляшки с очень ранними стадиями деминерализации эмали является чрезвычайно трудным [16].
6. Дентальная бляшка (при кариесе) в детском, пожилом и старческом возрасте
Такие процессы как поражение эмали зубов и деструкция дентина инициирует специфическая микрофлора дентальной бляшки – Streptococcus mutans, Lactobacteria и Actinomycetis viscosus, которые ферментируют пищевые углеводы с образованием кислот. Условно патогенные бактерии не проявляют агрессивности до тех пор, пока степень их вирулентности не позволит эффективно преодолеть защиту организма хозяина. Микрофлора полости рта принимает участие в формировании пелликулы – биопленки, защищающей эмаль и дентин зубов. Понимание взаимоотношений факторов защиты и патогенности микрофлоры полости рта необходимо для разработки эффективных методов профилактики и лечения [3].
Первичный кариес возникает преимущественно в детском возрасте, и поэтому эта группа населения выбирается в качестве субъектов при длительных и перекрестных клинических исследованиях заболеваний микробной этиологии [9].
Показано, что чаще всего инфицирование ребёнка кариесогенной микрофлорой происходит от матери или других людей, которые ухаживают за ним. Снижение уровня S. mutans у лиц, ухаживающих за ребенком, может снизить риск развития кариеса у детей раннего возраста. Возраст, в котором произошло инфицирование ребенка S. mutans, очень важен, так как чем раньше оно произошло, тем выше риск и интенсивность кариозного процесса. Ранее считалось, что колонизация полости рта кариесогенной микрофлорой беззубых младенцев невозможна. Однако клинические исследования, проведенные в последние годы, показали, что S. mutans имеет способность образовывать колонии в бороздках спинки языка еще до прорезывания зубов. Вертикальный путь является не единственным способом передачи кариесогенной микрофлоры в человеческой популяции [2].
У такой категории лиц, как пожилые люди и люди старческого возраста, одной из основных проблем стоматологического здоровья являются частичная или полная утрата зубов. Процессы старения человека приводят к снижению резервных возможностей организма, что имеет большое значение в патогенезе заболеваний твердых и мягких тканей полости рта. Кариес пожилых людей протекает вторично на фоне хронических процессов. В его появлении участвуют такие факторы, как некачественная гигиена полости рта, у пожилых с заболеваниями сердечно-сосудистой системы наличие эрозий эмали за счет ее деминерализации обусловлено снижением рН слюны из-за чрезмерного приема аспирина, витамина C и других медикаментов. Уменьшение в слюне концентрации sIgA способствует адгезии S.mutans к эмали зуба, что вызывает развитие кариеса. Важное значение в развитии основных заболеваний полости рта имеют свойства слюны. С возрастом уменьшается ее количество, что затрудняет жевание, глотание и речь [1].
Прогрессированию патологических и возрастных изменений зубочелюстной системы лиц пожилого и старческого возраста также способствуют недостаточная физическая нагрузка, несбалансированный по составу рацион питания и др. [1].
Необходимо учесть, что у лиц пожилого и старческого возраста высоко распространены дисбаланс кишечной микробной экологии, тяжелые соматические заболевания, социальные особенности (бедность, вредные привычки), психологические факторы (одиночество, депрессии и т.д.) [4].
Одним из интересных наблюдений Omry Korena является соотношение в сочетании содержания Veillonella и Streptococcus в образцах атеросклеротических бляшек и в образцах ротовой полости разных пациентов. Эти два рода известны как первые колонизаторы поверхностей зуба, которые взаимодействуют для формирования дентальной бляшки: Streptococcus производит предпочтительный продукт ферментации для Veillonella. Патология атеросклеротической бляшки может быть похожа на дентальную бляшку – это полимикробная инфекция, характеризующаяся несколькими ключевыми участниками, необходимыми для инициации заболевания [8].
Помимо предположительной связи между здоровьем полости рта и хроническими системными заболеваниями, сейчас представляется связь между здоровьем полости рта и нейродегенеративными заболеваниями, начиная от легкой до умеренной потери когнитивной функции и болезни Альцгеймера (БА). Когнитивные нарушения значительно влияют на повседневную жизнь и ставят под угрозу здоровье полости рта, системное здоровье и качество жизни пожилых людей. Xi Chen предположил, что в результате когнитивных нарушений снижается способность к самообслуживанию, а именно – проведение гигиены ротовой полости, что опосредует связь между когнитивными нарушениями и степенью кариеса у пациентов с когнитивными нарушениями. Снижение способности проводить гигиену полости рта может возникнуть в результате нарушения в нескольких когнитивных областях. Например, процедурная память – это вид долговременной памяти для выполнения интегрированных процедур, связанных с когнитивными и моторными навыками. При нарушении зрения пациенты могут потерять способность чистить зубы, умение, которое развивается благодаря обучению и практике в раннем возрасте. Исполнительная функция, когнитивная способность, которые включают планирование и выполнение целенаправленного поведения, абстрактное мышление тесно связаны с гигиеной полости рта. Нарушение исполнительных функций ставит под угрозу способность инициировать, планировать, последовательно выполнять сложные задачи, такие как чистка зубов или следование инструкциям по удалению и чистке протезов перед сном, что приводит к плохой гигиене полости рта и повышенному риску возникновения стоматологических заболеваний. В результате этих множественных дефицитов когнитивной области пожилые люди постепенно теряют способность к уходу за полостью рта, что приводит к ухудшению гигиены полости рта и / или зубов [6].
Необходимы эффективные меры для профилактики и лечения заболеваний полости рта и их последующего воздействия на системное здоровье и качество жизни пожилых людей. Лучшее понимание роли когнитивных нарушений и функциональной неспособности в отношении степени развития кариеса зубов у пожилых людей может помочь стоматологам решить проблемы гигиены полости рта, разработать конкретные для пациента эффективные стратегии профилактики и лечения кариеса зубов и, следовательно, улучшать клинические результаты и качество ухода за этой группой населения [6].
Заключение
Данные, накопленные в течение нескольких десятилетий, обеспечили прочную основу для текущих исследований дентальной бляшки. Многочисленные исследования выявили разнообразие резидентов микробиома дентальной бляшки как на уровне рода и вида, так и в отношении здоровья и болезни, возраста организма хозяина, его диеты (рациона питания). Состав дентальной бляшки также изменяется на различных анатомических поверхностях в связи со сложившимися физическими и биологическими свойствами каждого участка.
Более глубокое понимание значения дентальной бляшки как смешанной биопленки может оказать значительное влияние на клиническую практику. Дентальные бляшки не могут быть устранены, тем не менее патогенный характер биопленки может быть уменьшен путем снижения бионагрузки и поддержанием нормальной мифлоры соответствующими методами гигиены полости рта.
Библиографическая ссылка
Хабибуллина А.Р., Тимофеева А.В. МИКРОБИОМ ДЕНТАЛЬНОЙ БЛЯШКИ ЧЕЛОВЕКА // Современные проблемы науки и образования. – 2017. – № 3. ;URL: https://science-education.ru/ru/article/view?id=26539 (дата обращения: 16.04.2024).



