Лечение хронического остеомиелита остается одной из наиболее актуальных проблем хирургии. Частые случаи рецидивов, достигающие 30 % [1], а по некоторым данным более 60 % [2] нередко приводят к возникновению функциональной неполноценности конечности и высокой частоте ампутаций [3,4].
Установлено, что иммунные механизмы играют важную роль в патогенезе хронического остеомиелита, участвуя в формировании у пациента состояния вторичного иммунодефицита того или иного уровня. Многими авторами показано, что у пациентов с хроническим остеомиелитом происходят изменения в составе основных популяций лимфоцитов периферической крови: Т-клеток, Т-хелперов, цитотоксических Т-лимфоцитов, В-лимфоцитов и NK-клеток, а также обнаруживаются сдвиги в системе гуморального иммунитета и фагоцитарного звена [5–9]. Данные говорят о том, что проводимое стандартное лечение не приводит к нормализации иммунологических показателей, и при этом многие авторы сходятся во мнении, что одним из современных подходов к терапии остеомиелита является коррекция иммунологического статуса пациентов. Данные литературы подтверждаются и нашими исследованиями, проведенными ранее. Проведенное хирургическое и медикаментозное лечение, исключающее иммунотерапию, не давало изменений в динамике показателей клеточного иммунитета [10].
В литературе есть данные о применении у пациентов с хроническим остеомиелитом различных иммуномодулирующих препаратов. Среди них использовались такие как ликопид, ксимедон, лавомакс, иммунофан, ронколейкин, тимоген, тимолин, иммуновенин, глутоксим, полиоксидоний [1, 8, 11–14]. Исследователи наблюдали положительную динамику иммунологических показателей, остававшихся, однако, ниже значений здоровых людей. Тем не менее такое изменение иммунного статуса соответствовало особенностям клинического течения остеомиелита, что подтверждает целесообразность проведения иммунокорректирующего лечения [13]. Описанная авторами терапия применялась при госпитализации пациентов в стационар и сочеталась с выполнением различных реконструктивно-восстановительных вмешательств на пораженном участке. Однако, как уже было сказано, частые рецидивы остеомиелитического процесса, вынуждают пациентов вновь обращаться за хирургической помощью, что заставляет задуматься о возможном удлинении периода ремиссии и снижении частоты рецидивов. На данный момент остается неясным, насколько эффективна корректировка иммунологических показателей в отношении увеличения периода ремиссии и улучшения качества жизни пациентов.
Исходя из этого, было высказано предположение, что проведение иммуномодулирующей терапии позволит добиться удлинения срока безрецидивного периода. Целью работы явилась проверка гипотезы об эффективности применения иммунотерапии после проведения основного хирургического лечения в период ремиссии в отношении удлинения сроков безрецидивного периода.
Материалы и методы
В проводимое исследование включались пациенты, соответствовавшие определенным критериям: пациенты 17–65 лет мужского и женского пола, страдающие хроническим остеомиелитом длинной трубчатой кости с наличием одного или множественных костных секвестров; хронический остеомиелитический процесс представлен моноочагом; локализация поражений в бедренной кости, на голени, плечевой кости; раневая флора представлена Staphylococcus aureus; дефект костной ткани пораженного сегмента до 6 см по максимальному размеру; ранее не использовались остеозамещающие препараты; ранее не использовались иммуномодулирующие препараты. Критерии исключения: ложный сустав или сегментарный дефект поражённого сегмента; наличие грубой рубцовой деформации области остеомиелитического очага, требующей хирургической коррекции; недостаточность кровообращения III степени; дыхательная недостаточность III степени; почечная и/или печеночная недостаточность II степени; злокачественные новообразования, декомпенсированный сахарный диабет; сепсис; наличие ВИЧ-инфекции и вирусных гепатитов.
В исследование вошли 33 пациента, находившихся на хирургическом лечении в отделении гнойной хирургии в 2015–2017 году по поводу хронического остеомиелита. Возраст больных на момент проведения исследования составлял от 22 до 58 лет. Длительность остеомиелитического процесса к моменту госпитализации составила от 7 месяцев до 19 лет. Каждый больной предварительно перенёс от 1 до 4 оперативных вмешательств по поводу обострений хронического остеомиелита. Оперативное вмешательство, проводимое всем больным на момент последней госпитализации, заключалось в остеонекрсеквестрэтомии и последующей санации гнойного очага при помощи ультразвукового кавитатора в антибактериальном растворе. Заполнение костного дефекта проводили препаратом на основе коллагена.
Пациенты были рандомизированно разделены на 2 группы. В контрольную группу вошли каждый первый и второй пациент, а в группу наблюдения – каждый третий. На момент проводимого исследования и получения результатов фенотипирования лимфоцитов исследователям не было известно отнесение пациента к определенной группе, а врачам отделения – показатели субпопуляционного состава лимфоцитов (двойное слепое исследование). Участники контрольной группы (23 человека) получали хирургическое лечение, медикаментозную терапию. Пациентам из группы наблюдения (10 человек) проводилось хирургическое лечение, медикаментозная терапия, а в период ремиссии они получали препарат «Полиоксидоний» (Азоксимера бромид; ООО «НПО Петровакс Фарм», Россия) по 12 мг 2 раза в день в течение 15 дней.
Определение субпопуляций лимфоцитов проводили через 1 месяц после выписки пациента из стационара. Исследование осуществлялось на проточном цитофлуориметре Navios с использованием пятицветной панели моноклональных антител против CD45, CD4, CD8, CD3 и CD19, а так же четырехцветной панели моноклональных антител против CD45, CD3, CD16/56 и HLA-DR (Beckman Culter, США). Результаты выражали в процентном содержании клеток. Иммунорегуляторный индекс (ИРИ) рассчитывали как соотношение СD4+/CD8+-клеток.
Статистическую обработку проводили с помощью программы Statistica 6.1. Распределение выборки оценивалось на нормальность, результаты выражали в виде M±σ медианы признака и 25–75 % квартилей, проверку гипотез об отсутствии различий в группах проводили с использованием t-критерия Стьюдента и U-критерия Манна – Уитни в зависимости от выполнения условий их применимости. Различия считали статистически значимыми при вероятности ошибки p<0,05.
Результаты и обсуждение
Проведенное исследование показало, что сроки безрецидивного течения остеомиелита у пациентов группы наблюдения на настоящее время составляют от 10 до 14 месяцев. Важно подчеркнуть, что до настоящего времени данные пациенты на повторную госпитализацию не поступали. Что касается пациентов группы контроля, то сроки ремиссии составили от 11 до 13 месяцев. При этом рецидивы выявлены у 4 больных. Это свидетельствует об обоснованности применения иммуномодулирующей терапии на этапе послеоперационных регенеративных процессов с целью создания оптимальных условий для реализации адаптационных и защитных механизмов.
Полученные клинические данные сопровождались следующими изменениями лабораторных показателей. Результаты исследования содержания субпопуляций лимфоцитов в периферической крови пациентов с остеомиелитом в период ремиссии показали в первую очередь изменение относительного содержания Т-лимфоцитов и Т-хелперов (таблица). Группа пациентов, получавших только стандартную терапию, через месяц после выписки из стационара имела статистически значимо более низкий уровень содержания CD3+-лимфоцитов и CD3+CD4+-клеток (хелперов) (рисунок). При этом содержание CD3+CD8+-лимфоцитов было практически равно в обеих группах. С одной стороны, это говорит о том, что «Полиоксидоний» действует преимущественно на общую популяцию Т-лимфоцитов и субпопуляцию Т-хелперов. С другой стороны, нельзя исключить того, что уровень отдельных субпопуляций лимфоцитов в периферической крови пациентов не всегда отражает истинное содержание субпопуляций иммунокомпетентных клеток в организме в целом. Не исключено влияние препарата и на субпопуляцию цитотоксических Т-лимфоцитов, однако их потребность в затронутом органе может привести к исчерпыванию клеточных факторов в периферической крови, что лабораторно будет выражаться в отсутствии возрастания количества клеток. В литературе имеются сведения о том, что в остеомиелитическом очаге обнаруживаются преимущественно CD3+CD8+-клетки и нейтрофилы [15]. Такая находка была неожиданна и для самих авторов и заставила задуматься о роли также CD8+-Т-клеток в развитии и патогенезе бактериальных инфекций. Здесь можно предположить, что цитотоксические лимфоциты помогают избавиться от фагоцитирующих клеток, внутри которых способны выживать инфекционные агенты. А также о возможном выделении растворимых медиаторов, участвующих в резорбции кости, которые небезынтересно было бы определять в дальнейших исследованиях.
Содержание основных субпопуляций лимфоцитов периферической крови пациентов с остеомиелитом
|
Показатель |
Группа контроля |
Группа наблюдения |
||||||
|
M±σ |
Ме |
Q25 |
Q75 |
M±σ |
Ме |
Q25 |
Q75 |
|
|
CD3+- лимфоциты, % |
76,2±9,37 |
77,20 |
70,35 |
82,45 |
82,5±6,40* |
83,65 |
77,48 |
87,08 |
|
CD3+CD4+- лимфоциты, % |
47,2±10,62 |
46,80 |
38,45 |
55,35 |
56,19±9,29* |
56,55 |
48,40 |
59,85 |
|
CD3+CD8+- лимфоциты, % |
28,52±9,45 |
28,50 |
21,90 |
34,40 |
26,79±9,31 |
24,95 |
20,75 |
29,83 |
|
CD19+- лимфоциты, % |
11,03±7,30 |
9,20 |
6,30 |
12,00 |
9,33±3,22 |
9,55 |
5,98 |
11,80 |
|
CD16/56+- лимфоциты, % |
25,21±12,02 |
25,20 |
14,85 |
37,10 |
24,57±10,34 |
28,45 |
14,7 |
33,55 |
|
HLA-DR+- лимфоциты, % |
20,00±9,74 |
18,10 |
13,65 |
24,60 |
20,47±8,38 |
18,10 |
14,38 |
23,88 |
|
ИРИ, % |
1,96±1,10 |
1,53 |
1,19 |
2,36 |
2,34±0,99 |
1,99 |
1,75 |
2,92 |
|
CD3- CD16/56+-лимфоциты, % |
13,58±7,45 |
14,7 |
6,60 |
17,35 |
10,62±7,06 |
9,05 |
5,10 |
14,9 |
|
CD3+ CD16/56+-лимфоциты, % |
6,38±5,29 |
4,30 |
2,75 |
9,85 |
10,21±8,90 |
5,25 |
2,93 |
18,23 |
|
CD3- HLA-DR+-лимфоциты, % |
9,71±5,79 |
8,40 |
5,70 |
11,80 |
7,97±3,20 |
9,00 |
4,85 |
9,90 |
|
CD3+ HLA-DR+-лимфоциты, % |
8,40±6,90 |
5,60 |
3,75 |
11,95 |
10,53±8,96 |
10,45 |
3,50 |
13,95 |
Примечание: * – статистически значимые отличия по сравнению с группой контроля (p<0,05).
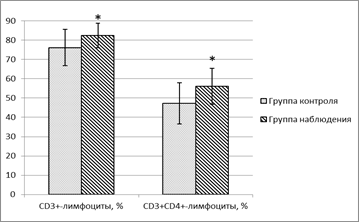
Содержание CD3+ и CD3+CD4+-лимфоцитов в периферической крови пациентов с остеомиелитом
Примечание: * – статистически значимые отличия по сравнению с группой контроля (p<0,05).
Статистически значимых различий других исследуемых показателей установить не удалось, однако прослеживаются тенденции, что в группе пациентов, получавших «Полиоксидоний», снижается количество естественных киллеров (CD16/56+-клеток), но повышается число TNK клеток (CD3+CD16/56+), а также увеличивается относительное количество активированных Т-лимфоцитов, несущих на поверхности молекулу HLA-DR, что также может свидетельствовать в пользу гипотезы об участии Т-лимфоцитов в патогенезе остеомиелита.
Заключение
На данный момент полученные результаты позволяют предположить, что проводимая терапия, вероятно, может приводить к увеличению срока безрецидивного периода, что сопровождается увеличением содержания CD3+ и CD3+CD4+-лимфоцитов. Применяемая иммунотерапия может содействовать улучшению послеоперационных регенеративных процессов, включающих реакцию тканей на операционную травму, регенераторные процессы в области санированного остеомиелитического очага, формирование послеоперационного рубца. С уверенностью судить об увеличении сроков ремиссии можно будет с течением времени и последующем наблюдении за пациентами, проходящими лечение по указанным схемам. Также хочется отметить, что интересным будет дальнейшее изучение динамики изменения показателей и оценка их стабильности после проведения терапии, изучение возможности назначения повторного курса. Что касается роли эффекторов иммунитета в патогенезе заболевания и применения иммунотерапии с целью продления ремиссии, то немаловажным является исследование кооперации клеток иммунной системы с клетками костной ткани и, как следствие, изучение растворимых медиаторов иммунного ответа – цитокинов и растворимых рецепторов.
Библиографическая ссылка
Лебедев М.Ю., Крестова Е.И., Живцов О.П. ОЦЕНКА ПРИМЕНЕНИЯ ИММУНОМОДУЛИРУЮЩЕЙ ТЕРАПИИ В ЛЕЧЕНИИ ХРОНИЧЕСКОГО ОСТЕОМИЕЛИТА ДЛИННЫХ ТРУБЧАТЫХ КОСТЕЙ // Современные проблемы науки и образования. – 2017. – № 5. ;URL: https://science-education.ru/ru/article/view?id=27014 (дата обращения: 18.04.2024).



