Воздействие радона хорошо изучено в диапазоне высоких концентраций. Установленные гигиенические нормативы предусматривают уровень эквивалентной равновесной объемной активности (ЭРОА) в 200 Бк/м3 как границу допустимой объемной активности радона в воздухе жилых помещений. В то же время в ряде стран допустимый уровень увеличен до 400 Бк/м3, что объясняется, прежде всего, геологическими особенностями территории. С другой стороны, существует точка зрения о необходимости снижения допустимого уровня до 2 пКю/л, что соответствует 74 Бк/м3. В рамках современной парадигмы ВОЗ и принципа линейного беспорогового увеличения радиационных эффектов даже небольшое радиационное воздействие приводит к увеличению риска возникновения стохастических эффектов (прежде всего онкозаболеваний).
Очевидно, что небольшие радиационные эффекты, воздействующие на большие группы людей, могут приводить к социально значимому увеличению частоты онкологической заболеваемости [1]. Вследствие этого представляется крайне актуальным накопление информации об эффектах действия различных типов ионизирующего излучения в малых дозах, которому подвержено в той или иной степени все население планеты. Увеличение ЭРОА радона выше 200 Бк/м3 признается нежелательным для большинства принятых нормативов в области радиационной гигиены. В то же время лишь 5-10% жилых помещений можно отнести к помещениям с таким уровнем воздействия. Уровень объемной активности (ОА) радона в 2 пКю/л (74 Бк/м3) и выше может отмечаться в 20-50% жилых помещений в зависимости от типа застройки и географического расположения. Очевидно, что даже малоинтенсивное воздействие радона может приводить к значимому увеличению заболеваемости, учитывая глобальные масштабы проблемы. Представляется актуальным исследование влияния низкодозовых нагрузок плотноионизирующего излучения на организм человека.
Радон признается в настоящее время одним из наиболее опасных канцерогенов, действующих на человека. В природе радиационный радоновый фактор не играет существенной роли, поскольку газ радон рассеивается в большом объеме воздуха и достаточно быстро распадается (период полураспад Rn222=3,82 суток). В то же время жилые и технические постройки представляют собой своеобразные ловушки, накапливающие радон (до 10 крат в сравнении с открытым воздухом). Очаги выделения радона часто располагаются спорадически, радон рассматривается в качестве ведущей причины повышения частоты хромосомных аберраций в схожих экспонированных группах [2].
Одним из эффективных методов биомониторинга является прямая оценка степени повреждения ДНК в клетках крови методом «ДНК-комет» (гель-электрофорез отдельных клеток). Данный метод предусматривает лизис клеток, помещенных в агарозный гель, при этом ДНК мигрирует в электрическом поле. Клетки с увеличенной частотой двойных разрывов характеризуются увеличением миграции ДНК к аноду. В 1988 году в работе Singh и коллег была предложена щелочная модификация метода, включающая этап лизиса при рН>13 [3]. Данная версия значительно повышает чувствительность метода, позволяя выявлять одиночные разрывы, щелочелабильные сайты, сшивки ДНК-ДНК и ДНК-белок, а также сайты незавершенной репарации [4]. Поскольку для большинства генотоксикантов преобладают эффекты одиночных разрывов ДНК, щелочная модификация метода позволила существенно увеличить информативность и чувствительность теста. Одно из главных преимуществ – возможность выявить генотоксическое воздействие в условиях одновременного действия цитотоксических факторов, которые приводят к формированию хромосомных нарушений, но не обладают генотоксическим действием. В условиях рН>12 ДНК денатурирует, и нити расплетаются вследствие разрушения водородных связей между 2 спиралями. При достижении рН 12,6 щелочелабильные сайты, например апуриновые/апиримидиновые сайты, трансформируются в одиночные разрывы ДНК. При рН>13 достигается максимальная степень трансформации щелочелабильных сайтов.
Материалы и методы
Характеристика выборки
Каждый обследованный заполнял персональную анкету, включавшую информацию о возрасте, состоянии здоровья, употреблении табака и алкоголя, производственных вредностях, рентгенодиагностических процедурах, авиаперелетах, прививках и приемах лекарственных препаратов в течение 3 месяцев, предшествующих обследованию. Была отобрана группа из 39 обследованных, не подвергавшихся потенциально генотоксическим факторам. Все обследованные были не старше 40 лет. Всего было обследовано 18 мужчин (средний возраст 29 лет) и 21 женщина (средний возраст 31 год).
Исследование проводили в соответствии с требованиями Комиссии по этике Кемеровского государственного университета, протокол исследования утвержден на заседании Комиссии № 4 от 10.10.2016 г. Каждый участник подписывал форму информированного согласия, содержащую информацию о целях исследования.
Образцы биоматериала
Образцы венозной крови собирались в вакуумные пробирки емкостью 4 мл, содержащие натрий-ЭДТА в качестве антикоагулянта. Сбор материала происходил в период с ноября 2016 г. по апрель 2017 г. В течение 1-2 часов образцы переправлялись лабораторию. Все образцы кодировались и обрабатывались. Выполнение метода «ДНК-комет» начиналось немедленно после поступления образцов.
Гель-электрофорез отдельных клеток (метод «ДНК-комет»)
Метод «ДНК-комет» выполнялся в щелочной модификации, разработанной Singh с коллегами [3]. Первый слой геля представлял собой 1% раствор стандартной агарозы (Applichem, США). Для нанесения клеток использовали 1% агарозу с низкой температурой плавления (low melting point agarose, Applichem, США) при 39 °С. 70 мкл взвеси клеток крови в легкоплавкой агарозе вносили на стекло со стандартной агарозой и помещали на лед до полного застывания геля. После застывания стекла помещали в лизирующий буфер при температуре 4 °С на 12 часов. Состав лизирующего буфера: 2,5 моль/л NaCl («Вектон», Россия), 0,1 моль/л Nа2ЭДТА («Вектон», Россия), 1% Тriton Х-100 (Amresco, США), 10% ДМSO («Вектон», Россия). После лизиса проводился горизонтальный электрофорез (300 мА, 25 В, 30 мин.) в щелочном буфере (pH>13). Электрофорезу предшествовала 20-мин. обработка щелочным буфером (300 мМ NaOH («Вектон», Россия), 1 мМ Nа2ЭДТА («Вектон», Россия). Лизис и электрофорез проводился при 4 °С при отсутствии прямых солнечных лучей. После электрофореза стекла троекратно нейтрализовали в фосфатно-солевом буфере PBS рН 7,5 (Amresco, США). После этого стекла обрабатывались 70% этанолом в течение 5 минут. Препараты высушивались и окрашивались 50 мкл однократного SYBR GREEN («Биотех-Индустрия», Россия).
Анализ «комет»
Оценка параметров фрагментации проводилась путем микрофотографирования препаратов, окрашенных SYBR GREEN, с помощью микроскопа Zeiss Axio Imager 2. Всего фотографировалось 100 случайно отобранных комет от каждого исследованного образца при увеличении х400. Последующая обработка фотографий проведена с помощью комплекта ПО CASP [5]. Рассчитывались параметры длины хвоста кометы, момента хвоста, а также доля ДНК в хвосте кометы.
Статистические методы
Статистический анализ данных проводили с использованием пакета Statistica 10.0. Для количественных показателей рассчитывались средние значения и пределы 95% доверительного интервала (CI 95). Сравнение групп выполняли с использованием U-теста Манна-Уитни. Степень значимости была принята на уровне 5%. Корреляцию между показателями для случая непараметрических данных рассчитывали с использованием коэффициента корреляции Пирсона для рангов. При этом для выборок более 50 человек также рассчитывали значение критерия Стьюдента, основанное на значении коэффициента корреляции Пирсона [6].
Результаты
Доля ДНК в хвосте кометы не превышала 15%. Среднее значение объемной активности (ОА) радона в воздухе помещений составило 89,4 Бк/м3, значение МАЭД гамма-фона составило 0,12 мкЗв/ч, плотность потока бета-излучения 0,6 с-1. Уровень фрагментации ДНК по 3 показателям был повышен у мужчин, но данная тенденция не достигала статистической значимости (табл. 1).
Таблица 1
Показатели фрагментации ДНК у обследованных мужчин и женщин
|
Пол |
N |
Доля ДНК в хвосте кометы, % [95% CI] |
Длина хвоста кометы, мкм [95% CI] |
Момент хвоста кометы [95% CI] |
|
Муж. |
18 |
3,83 [2,69-4,97] |
14,17 [10,85-17,48] |
1,21 [0,58-1,84] |
|
Жен. |
21 |
3,17 [2,12-4,22] |
12,67 [9,60-15,73] |
0,82 [0,23-1,40] |
|
Всего |
39 |
3,48 [2,70-4,35] |
13,36 [11,12-15,59] |
1,00 [0,57-1,42] |
В качестве граничного уровня ОА радона в воздухе был выбран уровень 74 Бк/м3, соответствующий 2 пКю/л воздуха. Средняя ОА радона составила 47 Бк/м3 в первой группе и 143 Бк/м3 во второй группе. Наибольшая информативность была установлена для показателя момента хвоста комет. Момент хвоста был повышен в группе с более высоким уровнем радона, но эта тенденция не достигла уровня статистической достоверности (табл. 2). Данная тенденция характерна только для обследованных мужчин.
Таблица 2
Показатели фрагментации ДНК в группах, дифференцированных по полу и ОА радона
|
ОА радона в воздухе помещений, Бк/м3 |
N |
% ДНК в хвосте кометы [95% CI] |
Длина хвоста, мкм [95% CI] |
Момент хвоста кометы [95% CI] |
|
Мужчины |
||||
|
< 74 |
8 |
3,65 [1,31-6,00] |
13,73 [7,45-20,01] |
0,94 [0,44-2,31] |
|
> 74 |
10 |
3,97 [1,87-6,07] |
14,52 [8,90-20,14] |
1,43 [0,20-2,66] |
|
Женщины |
||||
|
< 74 |
12 |
3,30 [2,29-4,30] |
13,21 [9,68-16,74] |
0,88 [0,44-1,31] |
|
> 74 |
9 |
3,00 [1,84-4,17] |
11,95 [7,87-16,02] |
0,72 [0,22-1,23] |
|
Всего |
||||
|
< 74 |
20 |
3,43 [2,34-4,53] |
13,42 [10,25-16,58] |
0,90 [0,30-1,51] |
|
> 74 |
19 |
3,51 [2,40-4,63] |
13,30 [10,05-16,54] |
1,09 [0,47-1,71] |
Также была исследована возможная зависимость показателей ДНК от величины МАЭД гамма-излучения в жилых помещениях. Для проверки был рассчитан коэффициент корреляции между показателями повреждений ДНК и МАЭД гамма-излучения. Была обнаружена положительная корреляция показателей ДНК-комет с увеличением мощности гамма-излучения (рисунок). При этом МАЭД гамма-излучения находилась в пределах допустимых норм во всех обследованных помещениях.
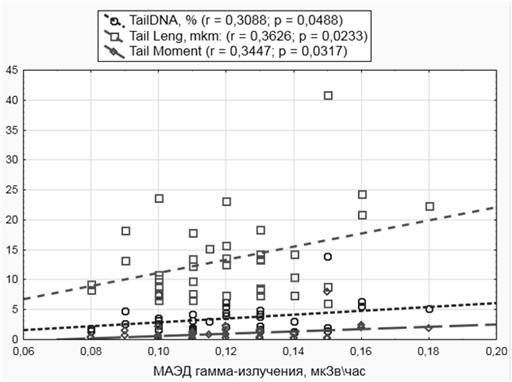
Зависимость показателей фрагментации ДНК от МАЭД гамма-излучения в жилых помещениях (r – коэффициент корреляции Спирмена, p – вероятность «нулевой» гипотезы)
Обсуждение
Радиационное воздействие
Ионизирующее излучение способно индуцировать образование кластеров повреждения ДНК, что реализуется в форме двухцепочечных разрывов и другими повреждениями, расположенными компактно. Редко- и плотноионизирующее излучение вызывает примерно одинаковое количество отдельных ДНК-поражений на единицу поглощенной дозы, но в случае с плотноионизирующим излучением (альфа-частицы) эти поражения распределены в меньшем количестве участков ДНК, что подразумевает увеличение числа повреждений в кластере; например, среднее число повреждений по кластеру, как правило, увеличивается с увеличением линейной передачи энергии [7]. Гамма-излучение, зафиксированное в местах проживания всех обследованных, не превышает регламентированных фоновых значений. Изменения гамма-фона, скорее всего, были вызваны особенностями строений и строительными материалами.
Анализ «комет»
Метод «ДНК-комет» представляет простой и быстрый тест, позволяющий эффективно измерять уровень повреждений ДНК и репарации повреждений, следующей после экспонирования. В данном исследовании не было обнаружено значительной гетерогенности в отношении уровня повреждения ДНК в исследованной популяции. В ряде работ, посвященных биологической дозиметрии, ранее отмечались трудности выявления эффекта малых доз облучения [8; 9]. В то же время в большинстве работ исследовались группы лиц, облученных внешним искусственным источником, например персонал радиологических и рентгенологических установок.
Измерения показателей фрагментации ДНК могут отражать как индивидуальный уровень повреждений ДНК, так и способность к репарации радиационных повреждений. Ранее в ряде работ установлена способность генов репарации модулировать частоту нарушений наследственного материала [10-12]. Наблюдаемая картина повреждений ДНК является результатом равновесия между нарушениями и репарацией ДНК, и низкий уровень повреждений или отсутствие выраженных корреляций может быть результатом как низкого числа повреждений, так и высокой индивидуальной эффективности репарации [13].
По некоторым оценкам, наибольший вклад в увеличение показателей ДНК комет для непроизводственных факторов вносят сезон года (параметры увеличены летом) и медицинское облучение [14]. В нашей работе эти факторы не могут оказывать значимого влияния, поскольку сбор биологического материала проводился в зимний период года, а все лица, проходившие рентгеновские обследования в течение 3 месяцев, предшествующих исследованию, были исключены из выборки. Отсутствие корреляций с объемной концентрацией радона, возможно, объясняется небольшим размером выборки. В дальнейшем планируется продолжение данной линии исследования с увеличением размера выборки.
Заключение
Исследование эффектов длительного воздействия малых доз облучения представляется сложной задачей, необходимость подбора выборок и контроля сопутствующих факторов способна исказить картину. В представленном исследовании не удалось выявить статистически значимых корреляций с показателями объемной активности радона, но в то же время обнаруженные корреляции с показателями гамма-фона указывают на перспективы данного исследования. Очевидна необходимость оценки фактора эффективности репарации обследованных для исследования такого типа, это позволило бы провести дифференцировку и сравнить людей с близкими характеристиками репарации.
Конфликты интересов, связанные с данным исследованием, отсутствуют.
Исследование выполнено при финансовой поддержке РФФИ (№ 16-34-60069\15 мол_а_дк).
Библиографическая ссылка
Ларионов А.В., Волобаев В.П., Сердюкова Е.С. ИЗУЧЕНИЕ ПОКАЗАТЕЛЕЙ ДНК-КОМЕТ У ЗДОРОВЫХ ДОНОРОВ В УСЛОВИЯХ РАЗЛИЧНЫХ РАДИАЦИОННЫХ ПАРАМЕТРОВ ЖИЛЫХ ПОМЕЩЕНИЙ // Современные проблемы науки и образования. – 2017. – № 6. ;URL: https://science-education.ru/ru/article/view?id=27215 (дата обращения: 25.04.2024).



