На сегодняшний день прогноз для пациентов с тяжелым заболеванием периферических артерий остается неутешительным, поскольку современные хирургические, медикаментозные методы лечения не спасают от ампутаций пациентов с критической ишемией нижних конечностей [1]. Таким образом, в последнее время активно развивается новое направление - клеточная терапия, направленная на стимуляцию реваскуляризации ишемических тканей. Клинические исследования показали, что аутологичные стволовые клетки костного мозга способны улучшать кровоснабжение у пациентов с критической ишемией нижних конечностей [2; 3]. Для стимуляции ангиогенеза при ишемии нижних конечностей используются разные типы клеток, в том числе активно применяют мультипотентные мезенхимальные стволовые клетки (ММСК) костного мозга [4]. Несмотря на имеющиеся предварительные положительные результаты экспериментальных и клинических исследований эффективности клеточной терапии стволовыми/прогениторными клетками ишемии нижних конечностей, исследователи продолжают поиск новых методов стимуляции ангиогенеза [5; 6].
Оказалось, что эритропоэтин способен не только стимулировать эритропоэз, но и обладает цитопротективным действием как in vivo, так и in vitro [7], способствует эндотелиальной дифференцировке и повышает экспрессию факторов дифференцировки стволовых клеток, увеличивает секрецию ими проангиогенных цитокинов [8; 9], подавляет апоптоз стволовых/прогениторных клеток и повышает их выживаемость [10]. Также кратковременное культивирование стволовых/прогениторных клеток с эритропоэтином значительно стимулирует их пролиферацию, миграцию и образование первичной тубулярной сосудистой сети, приводит к увеличению плотности капилляров при экспериментальной ишемии нижних конечностей [11]. Кроме того, имеются лишь немногочисленные работы исследователей, посвященные изучению влияния эритропоэтина на активность стволовых/прогениторных клеток [12-14]. В связи с этим необходимо изучение эффекта эритропоэтина на функциональный резерв стволовых/прогениторных клеток с целью дальнейшего применения в качестве клеточной терапии при ишемии. Таким образом, целью исследования стало изучение влияния эритропоэтина на пролиферативную и миграционную активность ММСК костного мозга крысы.
Материал и методы исследования
ММСК получали из клеток костного мозга бедренных костей у крыс. Клетки культивировали в питательной среде DMEM с 10%-ным содержанием эмбриональной телячьей сыворотки («Биолот», Россия), 160 мкг/мл гентамицина сульфата («Дальхимфарм», Россия), 2 ммоль L-глутамина (ICN, США) при 37 °С во влажной атмосфере с 5%-ным содержанием СО2. В работе использовали клетки 3-5 пассажей.
Фенотип ММСК определяли на проточном цитофлуориметре FACSCantoII (BD, США) с использованием моноклональных антител к CD90, СD105, CD73, CD34 и CD45, меченых FITC и PE (BD, США). По изменению клеточного импеданса на аппарате xCELLigence (Roche Applies Science, Германия) в одно- или двухуровневых камерах оценивали пролиферацию и миграцию ММСК. Влияние эритропоэтина на пролиферацию и миграцию ММСК оценивали в дозах 34, 68, 100 МЕ/мл («Рекормон», Германия), а также VEGF (10 нг/мл, BioVision, США) в среде с 1% FCS. В условиях исследования задавалось общее время сканирования и интервал сканирования, далее все измерения проводились в автоматическом режиме. Изменение импеданса на микроэлектродах, обусловленного прикреплением и распластыванием клеток, выражали как клеточный индекс (КИ), который автоматически вычисляется программой: КИ=(Rn-Rb)/t, где Rb – исходное значение импеданса в лунке, содержащей только ростовую среду для клеток, Rn – значение импеданса в любое время t в лунке, содержащей, помимо ростовой среды, тестируемые клетки. КИ, таким образом, отражает изменения количества клеток, качества прикрепления клеток и морфологию клеток в лунке, которые могут меняться во времени. Образование тубулоподобных структур проводили следующим образом. Дно 24-луночного планшета покрывали раствором Матригеля и инкубировали 20 минут при 37 °С до полимеризации. Далее клетки вносили в лунки, покрытые Матригелем, и инкубировали в СО2-инкубаторе в течение 4–5 часов. В качестве положительного контроля использовали эндотелиальные клетки линии EaHy.926. ММСК наносили на матригель с добавлением эритропоэтина в дозе 34 МЕ/мл. Оценивали степень сформированность сети. Статистическую обработку результатов проводили при помощи программы Statistica 10,0. Данные представлены в виде среднего значения (M) и ошибки среднего (m). Достоверность различий оценивали по критериям Манна-Уитни в независимых группах. Различия считались достоверными при p<0,05.
Результаты исследования и их обсуждение
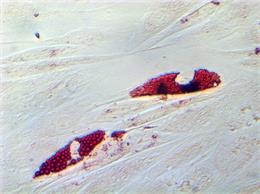
Методом проточной цитометрии была установлена фенотипическая характеристика ММСК, выделенных из костного мозга крысы. Получено, что ММСК на своей поверхности экспрессируют такие маркеры, как CD90 97,4±0,25%, CD29 99,4±0,13% и CD73 17,1±0,1%, при этом практически не экспрессируют маркеры гемопоэтических клеток CD34 0,1±0,01%, CD45 0,2±0,03%. Также мы подтвердили способность ММСК костного мозга крысы дифференцироваться в адипогенном и остеогенном направлениях (рис. 1). Таким образом, нами была подтверждена фенотипическая принадлежность клеток, полученных из костного мозга крыс, к мезенхимальным стволовым клеткам.
 А
А 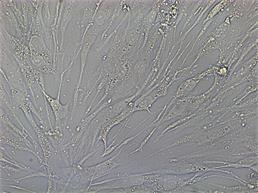 Б
Б
Рис. 1. Дифференцировочный потенциал ММСК костного мозга крыс: А – адипогенная дифференцировка по окраске Oil red (х40); Б – остеогенная дифференцировка (х20)
На рисунке 2 представлена оценка влияния эритропоэтина в трех дозах 34, 68, 100 МЕ/мл на пролиферативную и миграционную активность ММСК костного мозга. Выявлено, что уже в первые часы (1-4 ч.) эксперимента эритропоэтин в дозах 34 и 68 МЕ/мл оказывает стимулирующее действие на пролиферацию ММСК.
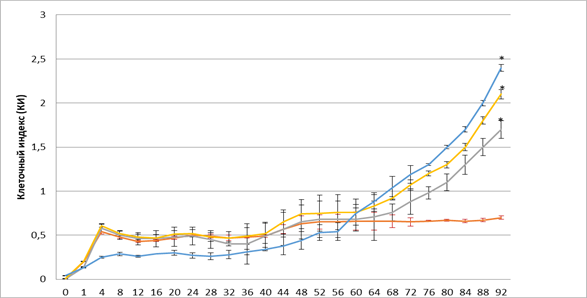
Рис. 2. Динамика изменения значений клеточного индекса ММСК в присутствии различных доз эритропоэтина
Примечание: – спонтанная пролиферация клеток, – пролиферация клеток в присутствии 34 МЕ; – пролиферация клеток в присутствии 68 МЕ, – пролиферация клеток в присутствии 100 МЕ. * - достоверность различия со спонтанной пролиферацией p < 0,05.
Отмечено, что пролиферативный потенциал клеток имел волнообразный характер. Нами не выявлено статистически значимого различия по уровню пролиферации ММСК с 10 по 40 час эксперимента в присутствии эритропоэтина. В этот период происходят колебания значения клеточного индекса, что связано с адгезией и распластыванием клеток в лунках планшета. На более поздних сроках эксперимента к 44-му часу отмечено увеличение пролиферативной активности ММСК в присутствии эритропоэтина в дозе 68 МЕ/мл (КИ=0,65) по сравнению с контролем (КИ=0,57). После 60-го часа эксперимента отмечено увеличение пролиферации ММСК в присутствии эритропоэтина в дозах 34, 68 и 100 МЕ/мл. В последующие часы эксперимента стимулирующее действие эритропоэтина, отражающееся в КИ, составило в дозе 34 МЕ/мл (КИ=0,71; КИ=1,7; p?0,05), в дозе 68 МЕ/мл (КИ=0,83; КИ=2,1; p?0,05), в дозе 100 МЕ/мл (КИ=0,88; КИ=2,4; p?0,05) и усиливалось, что приводило к статистически значимому возрастанию пролиферативной активности ММСК по сравнению с контролем (КИ=0,6; КИ=0,7). Необходимо отметить, что стимулирующее действие эритропоэтина обладает дозозависимым эффектом.
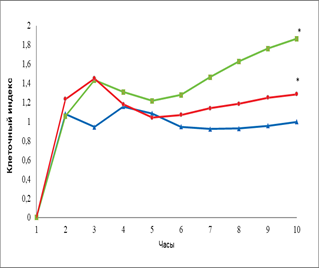
Кроме того, мы провели сравнение действия эритропоэтина в дозе 34 МЕ/мл с влиянием главного фактора ангиогенеза VEGF на ММСК костного мозга крысы (рис. 3).
 А
А 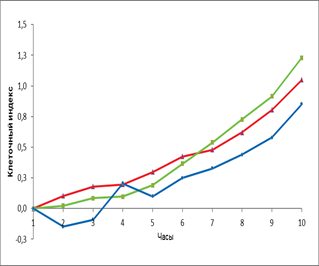 Б
Б
Рис. 3. Динамика изменения пролиферативной (А) и миграционной активности (Б) ММСК костного мозга в присутствии эритропоэтина и VEGF
Примечание: – спонтанная пролиферация клеток, – пролиферация клеток в присутствии VEGF; – пролиферация клеток в присутствии эритропоэтина, * - достоверность различия со спонтанной пролиферацией p < 0,05.
Нами не выявлено статистически значимого различия по уровню пролиферации ММСК к 8 часам эксперимента в присутствии эритропоэтина и VEGF. На более поздних сроках эксперимента к 16 часам отмечено увеличение пролиферации ММСК в присутствии VEGF (КИ=1,5) и эритропоэтина (КИ=1,5) по сравнению с контролем (КИ=1,1). Спустя ещё 8 часов отмечено снижение интенсивности пролиферации ММСК, а к 48 часам эксперимента показано, что эритропоэтин статистически значимо стимулировал пролиферативный потенциал клеток (КИ=1,6) по сравнению с VEGF (КИ= 1,1) и контролем (КИ=1). Стимулирующее влияние эритропоэтина сохранялось до конца эксперимента и достигло величины КИ=1,86. Что касается VEGF, то он оказывал стимулирующее влияние на пролиферацию ММСК (КИ=1,28) по сравнению с контролем (КИ=1,1), хотя и статистически незначимое.
В отношении миграции ММСК под влиянием эритропоэтина и VEGF не выявлено статистически значимых различий по сравнению с контролем. При этом показано, что миграционная активность ММСК в направлении градиента концентрации эритропоэтина увеличивается по сравнению с контролем, но данные не статистически значимы.
Таким образом, нами показано, что эритропоэтин в большей степени стимулирует пролиферативный потенциал ММСК, в меньшей степени стимулируя миграционную активность клеток. Кроме того, установлено, что эритропоэтин в большей степени стимулирует пролиферацию и миграцию ММСК, чем ангиогенный фактор VEGF.
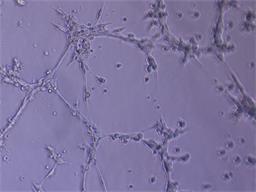
Для оценки проангиогенных свойств эритропоэтина был проведен тест по образованию первичных тубулоподобных структур на Матригеле in vitro. Установлено, что эритропоэтин в дозе 34 МЕ/мл стимулирует ММСК к образованию тубулоподобных структур по сравнению с контролем, где без добавления фактора ММСК не образовывали тубулярные структуры. В качестве положительного контроля использовали клетки эндотелиальной линии Ea.Hy926, которая в полной также образовывала тубулярную сеть (рис. 4).
 А
А 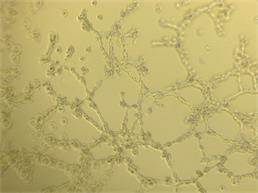 Б
Б
Рис. 4. Образованные тубулоподобные структуры на Матригеле in vitro: А – ММСК в присутствии эритропоэтина; Б – клетки эндотелиальной линии EaHy.926
Таким образом, в нашем исследовании были выявлены различия в характере и степени изменения функциональных характеристик ММСК под влиянием различных доз эритропоэтина. Ряд исследований посвящен изучению влияния эритропоэтина на пролиферацию, миграцию в модели «раны», фибробластов, мезенхимальных стволовых клеток [13; 15]. В связи с этим полученные данные о стимулирующем эффекте эритропоэтина на функциональную активность ММСК согласуются с предыдущими исследованиями. При этом необходимо отметить, что данные о влиянии эритропоэтина на пролиферацию и миграцию ММСК в режиме реального времени отсутствуют. Поэтому использованный нами метод и полученные результаты дают возможность сравнить динамику пролиферативного и миграционного ответа ММСК под действием эритропоэтина в режиме реального времени. Кроме того, установлено, что эритропоэтин обладает проангиогенными свойствами, влияя на способность ММСК к формированию тубулоподобных структур, и в большей степени стимулирует пролиферацию клеток, чем ангиогенный фактор VEGF. В связи с вышеизложенным полученные данные свидетельствуют о стимулирующем влиянии эритропоэтина на функциональные свойства ММСК костного мозга крысы в отношении пролиферации и миграции клеток.
Заключение
Полученные результаты свидетельствуют о стимулирующем влиянии эритропоэтина на функциональную активность ММСК костного мозга крысы, в частности увеличивается пролиферация, миграция клеток. Данные свойства эритропоэтина можно использовать для увеличения функциональной активности ММСК, что имеет практическое значение при использовании ММСК, предобработанных эритропоэтином, в целях клеточной терапии ишемических заболеваний.
Работа выполнена при поддержке гранта РФФИ Номер проекта 16-34-00076.
Библиографическая ссылка
Бондаренко Н.А., Лыков А.П., Казаков О.В., Кабаков А.В., Повещенко О.В., Суровцева М.А., Ким И.И., Повещенко А.Ф. ИЗМЕНЕНИЯ ФУНКЦИОНАЛЬНЫХ СВОЙСТВ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ПОД ВЛИЯНИЕМ ЭРИТРОПОЭТИНА // Современные проблемы науки и образования. – 2017. – № 6. ;URL: https://science-education.ru/ru/article/view?id=27257 (дата обращения: 20.04.2024).



