Аутологичная трансплантация гемопоэтических стволовых клеток (АутоТГСК) широко применяется в мире с целью восстановления кроветворения после высокодозной химиотерапии [1]. Это позволяет сократить риск развития инфекционных осложнений и кровотечений, связанных с терапией. Для успешного восстановления кроветворения в минимальные сроки необходимо трансплантировать достаточное количество гемопоэтических стволовых клеток (от 2×106 ГСК на килограмм массы тела) или ядросодержащих клеток (4-8×108 ЯСК на килограмм массы тела) [2-4]. С этой целью на этапе получения трансплантата производится лабораторный мониторинг количества собранных клеток. Процедуру получения завершают только после получения требуемой трансплантационной дозы. Однако контроля количества ГСК и ЯСК в полученном у пациента трансплантате недостаточно, чтобы гарантировать необходимую трансплантационную дозу, так как в процессе размораживания и оттаивания сохранность клеток может меняться в широких пределах [5]. Поэтому с целью оценки трансплантационной дозы необходимо выполнить анализ образцов, полученных из размороженного трансплантационного материала. При этом достоверность данной оценки может зависеть от способа получения пробы для анализа.
Очевидно, что наиболее достоверные результаты можно получить из проб, отобранных непосредственно из криопакетов с размороженным трансплантационным материалом. Однако отбор пробы из криопакета нежелательно выполнять до инфузии трансплантата пациенту, так как процесс отбора сопряжен с риском контаминации биоматериала, что на фоне высокодозной химиотерапии чревато опасными инфекционными осложнениями. Необходимо завершить инфузию трансплантата и только после этого произвести отбор пробы из остатков биоматериала. Затем пробу транспортируют в лабораторию и готовят к анализу. В совокупности от момента размораживания трансплантата до получения результатов может пройти много времени, и количество трансплантированных клеток будет известно уже после завершения трансплантации. В таких условиях невозможно заранее запланировать объемы необходимого для трансплантации биоматериала. Кроме того, длительный промежуток времени от размораживания до получения результатов анализа может негативно влиять на достоверность оценки количества клеток в трансплантате, который был введен пациенту сразу после размораживания.
Для решения данной проблемы трансплантационными центрами применяется контроль качества трансплантационного материала с помощью криопробирок-спутников. Данные криопробирки с аликвотами трансплантата замораживаются одновременно с основным трансплантатом в криопакетах. Криопробирки-спутники можно разморозить в лаборатории непосредственно перед анализом, что исключает временной промежуток между размораживанием и анализом, тем самым увеличивается достоверность контроля количества клеток. Кроме того, размораживание криопробирок и контроль количества клеток можно выполнить заблаговременно до трансплантации. Данная тактика позволяет планировать трансплантацию обоснованно с учетом уже готовых результатов контроля количества ГСК и ЯСК в хранящемся трансплантате.
С другой стороны, значительное различие объемов собственно трансплантата (25–150 мл) и аликвот в криопробирках-спутниках (2–6 мл) может влиять на скорость охлаждения и кристаллизации биоматериала в них [6], что, в свою очередь, может негативно сказываться на сохранности клеток [7] и снижать достоверность контроля качества. Таким образом, у описанных способов отбора проб имеются преимущества и недостатки, которые потенциально могут влиять на достоверность контроля количества ГСК и ЯСК в трансплантационном материале.
Учитывая выше сказанное, нами сформулирована цель исследования: оценить достоверность контроля количества ГСК и ЯСК в размороженном трансплантационном материале.
В соответствии с целью поставлены следующие задачи:
1. Оценить влияние экспозиции проб трансплантационного материала от момента размораживания до анализа на результаты лабораторного контроля количества трансплантированных ГСК и ЯСК.
2. Оценить достоверность контроля количества ГСК и ЯСК в размороженном материале с использованием криопробирок-спутников.
Материалы и методы
Для решения поставленных задач было проанализировано 30 образцов пуповинной крови и 25 лейкоконцентратов, полученных у пациентов с онкогематологическими заболеваниями.
Образцы пуповинной крови и полученные у пациентов лейкоконцентраты были расфасованы в криопакеты с добавлением криопротектора ДМСО с конечной концентрацией 7,5% и заморожены с помощью программного замораживателя. Одновременно были заморожены аликвоты биоматериала в криопробирках-спутниках. Экспериментальный материал пуповинной крови позволил применить термодатчики, погруженные непосредственно в клеточную взвесь для мониторинга изменения температуры в процессе замораживания. Дальнейшее хранение выполнялось в жидком азоте.
Перед испытанием все образцы были разморожены, после чего из каждого криопакета и криопробирок-спутников был произведен отбор проб для определения концентрации жизнеспособных ГСК и доли ЯСК с целыми мембранами. Аналогичный отбор проб был произведен еще 2 раза с интервалом в 10 минут из криопакетов. Таким образом, отбор проб выполнялся в следующем порядке:
1) отбор проб № 1 – сразу после размораживания из криопакетов и криопробирок-спутников;
2) отбор проб № 2 – через 10 минут экспозиции после размораживания из криопакетов;
3) отбор проб № 3 – через 20 минут экспозиции после размораживания из криопакетов.
Лабораторный анализ проб выполнялся непосредственно после их отбора. Концентрацию жизнеспособных ГСК и ЯСК выполняли с помощью проточной цитометрии с использованием протокола ISHAGE и заводского набора реагентов («Stem-Kit», Beckman Coulter, USA). Количество ГСК оценивалось по фенотипу CD34+/CD45dim/7AAD–, а количество ЯСК – по фенотипу CD45+/7AAD–. Сохранность ГСК и ЯСК при экспозиции 10 и 20 минут рассчитывали как процентное отношение концентрации данных клеток соответственно в пробах № 2 и № 3 к концентрации в пробах № 1, отобранных сразу после размораживания. Сохранность ГСК и ЯСК в криопробирках-спутниках сравнивали с таковыми показателями в пробах, отобранных из только что размороженного трансплантационного материала. Достоверность изменения сохранности клеток, после предварительной оценки нормальности распределения показателей, оценивали с помощью критерия Стьюдента.
Результаты исследования
Оценка влияния экспозиции размороженного трансплантационного материала на результаты анализа сохранности клеток
Полученные результаты сохранности ГСК и ЯСК через 10 и 20 минут после размораживания образцов пуповинной крови и клинического трансплантационного материала представлены в таблице 1.
Таблица 1
Результаты сохранности ГСК и ЯСК через 10 и 20 минут после размораживания образцов пуповинной крови и клинического трансплантационного материала
|
|
Пуповинная кровь, n=39 |
Клинический трансплантат, n=39 |
||
|
Экспозиция 10 минут |
Экспозиция 20 минут |
Экспозиция 10 минут |
Экспозиция 20 минут |
|
|
Сохранность ГСК, % |
103±24 |
102±26 |
81±30 |
76±29 |
|
Сохранность ЯСК, % |
69±5 |
67±5 |
68±11 |
68±11 |
По результатам исследования установлено, что через 10 и 20 минут экспозиции образцов пуповинной крови концентрация ГСК не изменялась от исходного уровня. Доля ЯСК достоверно (p≤0,05) снижается до 68% через 10 минут экспозиции, но после дополнительных 10 минут экспозиции не изменяется.
При аналогичном исследовании образцов клинического трансплантационного материала установлено, что через 10 минут экспозиции после размораживания концентрация ГСК и доля лейкоцитов с неповрежденными мембранами достоверно (p≤0,05) снижаются соответственно до 81% и 68% от исходных уровней. Еще через 10 минут экспозиции сохранность ГСК продолжает снижаться и достигает 76%, но изменения показателя не достоверны, а доля ЯСК с неповрежденными мембранами остается без изменений.
Таким образом, лабораторный контроль количества ГСК и ЯСК необходимо выполнять в наиболее короткие сроки после размораживания трансплантационного материала, что увеличивает достоверность анализа.
Оценка достоверности контроля сохранности ГСК в размороженном материале с использованием криопробирок-спутников
Экспериментальный материал пуповинной крови позволил непосредственно определить динамику изменений температуры в процессе криоконсервации с помощью термодатчиков, погруженных в биоматериал. Динамика изменения температуры в криопробирках-спутниках и криопакетах в процессе замораживания графически представлена на рисунке.
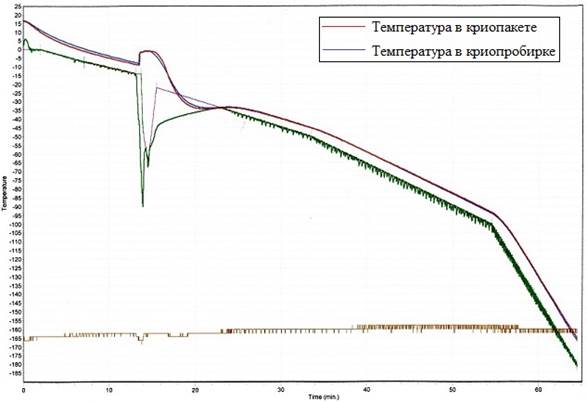
Динамика изменения температуры в криопробирках-спутниках и криопакетах в процессе замораживания
На графике видно, что динамика изменения температуры в криопробирках-спутниках полностью совпадает с таковым показателем в криопакетах на всем протяжении процедуры криоконсервации. Это косвенно может свидетельствовать о том, что процессы замораживания в криопробирках и криопакетах происходят синхронно.
Однако косвенной оценки недостаточно для выводов о достоверности контроля количества клеток в трансплантате с помощью криопробирок. Кроме того, возможность непосредственного измерения температуры трансплантата доступна только при использовании экспериментального материала пуповинной крови и экстраполировать данные результаты на клинический трансплантат, в который вводить термодатчики недопустимо, опрометчиво. Необходимо прямо оценить сохранность ГСК и ЯСК в обоих образцах. Результаты данной оценки представлены в таблице 2.
Таблица 2
Результаты сохранности ГСК и ЯСК в криопробирках-спутниках и трансплантационного материала после размораживания образцов пуповинной крови и клинического трансплантационного материала
|
|
Пуповинная кровь, n=39 |
Клинический трансплантат, n=39 |
||
|
Криопробирка |
Криопакет |
Криопробирка |
Криопакет |
|
|
Сохранность ГСК, % |
101±40 |
98±34 |
76±18 |
85±19 |
|
Сохранность ЯСК, % |
67±10 |
70±9 |
55±20 |
64±15 |
По результатам исследования установлено, что сохранность ГСК и ЯСК пуповинной крови, взятых из криопробирок-спутников, не значимо отличается от таковых показателей, полученных из проб, взятых из криопакетов. При аналогичном исследовании образцов клинического трансплантационного материала установлено, что сохранность ГСК и ЯСК достоверно ниже, чем в криопакетах.
Обращают на себя внимание различия результатов для разных биологических материалов – пуповинной крови и лейкоконцентрата, полученного из периферической крови. Принципиальное различие данных биоматериалов заключается в разном клеточном составе. Лейкоконцентрат, полученный из периферической крови, содержал 46 – 177×109 ЯСК/л, в то время как пуповинная кровь содержала не более 43×109 ЯСК/л. Как было показано нами в предыдущих исследованиях, концентрация ЯСК может значительно влиять на сохранность клеток на этапах замораживания-оттаивания лейкоконцентрата периферической крови [5]. Аналогичную зависимость ранее описывали другие авторы, исследовавшие сохранность эмбриональных стволовых клеток человека и пуповинной крови [8; 9]. Следовательно, протоколы лабораторного контроля клеточного состава трансплантата могут отличаться в зависимости от источника его получения.
Заключение
Таким образом, использование криопробирок спутников с целью контроля качества трансплантата обоснованно при планировании трансплантации пуповинной крови. При использовании клинического трансплантационного материала, полученного из периферической крови, целесообразно выполнять контроль качества проб, взятых непосредственно после трансплантации и в наиболее короткие сроки после размораживания и инфузии. Для сокращения данного промежутка времени можно рассмотреть возможность отбора пробы для анализа перед инфузией, но с условием наличия мероприятий, исключающих риск контаминации трансплантата. Использование протоколов лабораторного контроля, разработанных на основе данных принципов, позволит повысить достоверность оценки достаточности трансплантационной дозы и обоснованно спланировать индивидуальную тактику терапии с применением трансплантации гемопоэтических стволовых клеток.
Библиографическая ссылка
Коротаев Е.В., Косарев А.Н., Степанов А.А., Пономарев С.А. ОПТИМИЗАЦИЯ КОНТРОЛЯ СОХРАННОСТИ КЛЕТОК В РАЗМОРОЖЕННОМ ТРАНСПЛАНТАЦИОННОМ МАТЕРИАЛЕ, ПРЕДНАЗНАЧЕННОМ ДЛЯ ТРАНСПЛАНТАЦИИ ПАЦИЕНТАМ С ГЕМОБЛАСТОЗАМИ // Современные проблемы науки и образования. – 2018. – № 1. ;URL: https://science-education.ru/ru/article/view?id=27403 (дата обращения: 19.04.2024).



